2种药用甘草种子对盐渍环境的萌发响应及其甘草酸含量变化
沈步芳, 李予霞, 马 淼, 李桂芳, 肖星辉, 刘惠东, 冯 雪, 庄 丽, 刘红玲,2
(1.石河子大学生命科学学院,新疆石河子 832000; 2.成都师范学院,四川成都 611130)
新疆为远离海洋的内陆盆地,其盐渍土地面积约占全国盐碱土面积的1/3,达11万km2,是我国土壤盐碱化分布面积最广、类型最多、积盐最重的地区。当土壤中的水溶性盐浓度大于0.1%时,便会对植物产生盐害,盐害程度随浓度的增大而增大,种子萌发阶段对土壤中的盐碱浓度尤为敏感,因此土壤盐渍化是造成新疆农业低产的重要原因之一,严重影响了新疆干旱区农业发展和绿洲生态环境的稳定[1]。新疆传统的改良盐碱土的方法需要大量的水作保证,成本高但效果不理想,利用盐生植物修复土壤,能够有效改善盐碱地区生态环境,推进农业结构调整,促进可持续发展。
胀果甘草(Glycyrrhizainflata)和乌拉尔甘草(Glycyrrhizauralensis)是豆科多年生草本植物,胀果甘草主要分布于新疆地区,乌拉尔甘草广泛分布于我国北方地区[2-3],皆为《中国药典》收载的药用甘草的原植物。甘草因其生境较耐盐碱、抗旱、耐寒、适应性强等优良特性及其独特的药用价值,已成为我国西北干旱、半干旱区盐碱地植被恢复与资源重建的重要药用植物[4]。甘草酸是甘草的主要药用活性成分,常作为甘草制剂中的定量指标来评价药材及成药的质量[5]。目前对甘草的研究主要集中在资源、分类、化学成分、药理和药效等方面[6-10],对甘草种子生理生态学方面的研究较少,种子耐盐性的研究报道也仅见于乌拉尔甘草[11-13],盐胁迫下甘草种子萌发进程中甘草酸积累与盐环境之间的相关关系未见报道。本研究在不同浓度的3种盐胁迫下对胀果甘草和乌拉尔甘草种子的发芽率、发芽势、萌发进程、种子活力、盐胁迫解除后种子的发芽率及不同浓度盐溶液处理下种子中内源甘草酸的含量等指标进行测定,揭示了2种主栽药用甘草种子的萌发特性,探讨了荒漠生境下甘草的种植对策。
1 材料与方法
1.1 试验材料
胀果甘草和乌拉尔甘草种子于2013年采自新疆石河子大学甘草研究所。胀果甘草种子千粒质量为8.547 6 g,乌拉尔甘草种子千粒质量为8.978 8 g。盐处理所用试剂(NaCl、Na2SO4和Na2CO3)均为分析纯。
1.2 试验方法
1.2.1 种子处理方法 试验于2016年4月在石河子大学生命科学学院实验室进行,分别选大小均匀的2种甘草的健康种子,用0.5%高锰酸钾溶液浸种消毒10 min,再用无菌水冲洗干净,吹干后置于小烧杯中,用85%浓硫酸浸泡种子 20 min,用无菌蒸馏水反复冲洗干净后备用。将NaCl、Na2SO4、Na2CO3盐分别配制成40、80、120、160、200、240、280、320、360、400 mmol/L等10个浓度的单盐溶液,备用。
选用直径9 cm的培养皿,无菌水冲洗后放入2层无菌滤纸,压平,分别用上述浓度的单盐溶液浸泡种子12 h,让种子充分吸足水分,然后每个培养皿内放入50粒经过预处理的种子,并加入8 mL相应浓度的单盐溶液,5次重复,并以蒸馏水处理为对照(CK),放入(25±2)℃恒温箱内,光照 4 000 lx,12 h/d催芽。24 h后开始逐日观察,直至种子萌发试验结束。为保持培养皿中的盐溶液浓度稳定并且减少因种皮褐化而影响种子发芽和导致霉变,每天更换滤纸,并以相应浓度盐溶液冲洗种子及培养皿。
1.2.2 观测方法及评价指标 将处理好的培养皿放入恒温箱后,每隔24 h观察1次,以重复中最早的1粒种子发芽之日作为该处理萌发的开始期,以胚根露出0.2 cm作为萌发标志[14],直至萌发试验结束。统计发芽种子数,计算发芽率、发芽势、发芽指数、活力指数和相对盐害率[15]。发芽结束后,将全部未发芽种子冲洗干净,以相同条件在蒸馏水中继续复水萌发,并用相同方法计算发芽率(鉴于不同浓度盐溶液处理种子数量有限,因此只做种子发芽率小于50%的盐浓度下的复水试验)。
发芽率=种子发芽粒数/种子播种总粒数×100%;发芽势=3~7 d发芽种子总数/种子播种总粒数×100%;发芽指数=∑Gt/Dt(Gt为td的发芽率,Dt为相应种子发芽的天数,按8 d计);活力指数=发芽指数×S(S为胚根+胚轴的总平均长度,cm);相对盐害率=(对照发芽率-盐处理发芽率)/对照发芽率×100%。用直尺测量2种甘草种子胚根和胚轴长度,分别计算平均值。
1.2.3 耐盐界限的确定[16]种子最终发芽率达到对照75%以上时的盐浓度为种子萌发的耐盐适宜范围;最终发芽率达对照50%时的盐浓度为种子萌发的耐盐临界值;最终发芽率为0时的盐浓度为种子萌发的耐盐极限值。
1.2.4 甘草酸含量的提取与测定 将发芽率大于50%的各盐溶液处理7 d的2种甘草种子分别收集并放入105 ℃烘箱中杀青15 min,再以70 ℃烘干、粉碎、过60目筛备用(发芽率过低,样品量太少)。采用香草醛-高氯酸法测定甘草酸含量[17-18]。
1.2.5 试验数据 采用SPSS 23.0进行方差分析和线性回归分析。
2 结果与分析
2.1 3种盐胁迫对2种甘草种子发芽天数的影响
分别用蒸馏水、中性盐较佳发芽浓度(Na2SO4120 mmol/L、NaCl 200 mmol/L)和碱性盐较低浓度(Na2CO380 mmol/L)处理2种甘草种子,24 h内开始发芽,3 d后出现日发芽率高峰,7 d后无新增发芽种子,少数种子出现发霉腐烂。因此,盐溶液处理和对照处理的2种甘草种子的累计发芽时间为7~8 d。
2.2 3种盐胁迫对2种甘草种子发芽率的影响
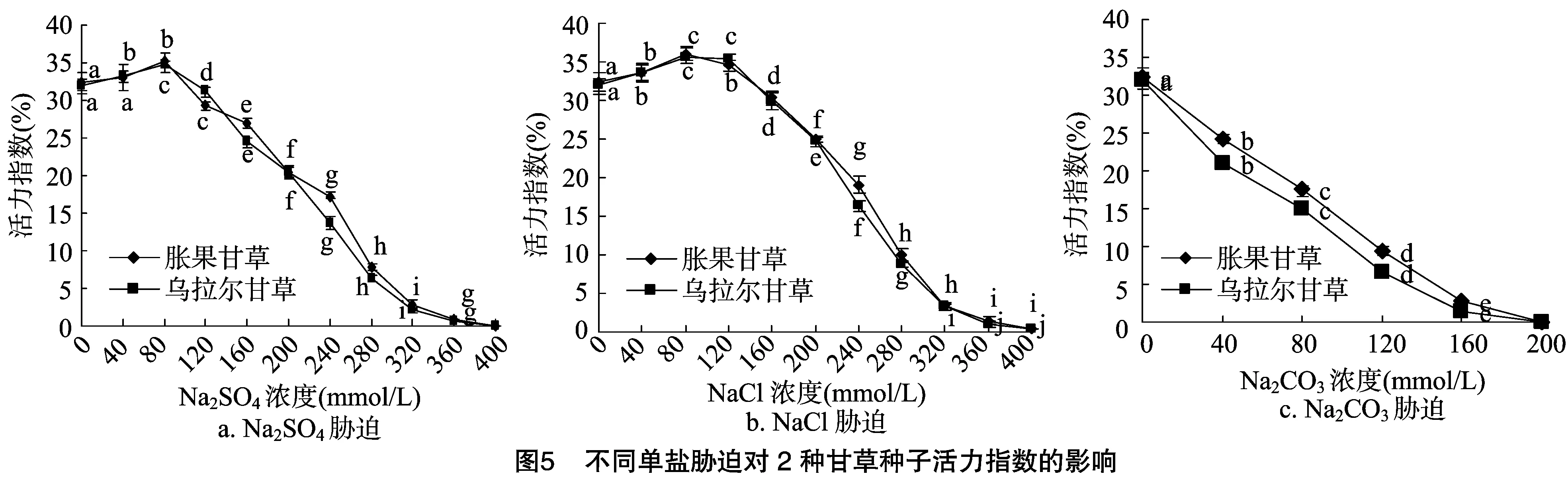
从图1可以看出,在3种单盐溶液处理条件下,2种甘草种子的发芽率除在较低中性盐溶液浓度(Na2SO4、NaCl浓度<80 mmol/L)时高于对照外,在其他盐浓度处理下均下降。不同单盐对2种甘草种子萌发的抑制程度存在显著差异,在Na2CO3胁迫下发芽率下降最为剧烈,方差分析和多重比较结果表明,在较低Na2CO3盐浓度下,2种甘草种子发芽率即与对照存在显著差异,表明Na2CO3对种子萌发的抑制程度最强。同一单盐对不同甘草种子发芽率的影响也存在明显差异,与胀果甘草种子相比,乌拉尔甘草种子在3种单盐胁迫下发芽率降低得较快,碱性盐和较高浓度中性盐胁迫与对照间发芽率存在着显著差异。
2.3 3种盐胁迫下2种甘草种子的萌发进程
种子初始萌发时间、发芽时间和发芽高峰期反映了种子的萌发启动速度(图2),当中性盐在较低浓度(NaCl、Na2SO4浓度为80~160 mmol/L)时,种子均从1 d后开始萌发,3 d后出现发芽高峰期,与对照一致,但日发芽率却高于对照,说明低盐促进了种子萌发;当NaCl盐溶液浓度在240 mmol/L时,发芽高峰期虽与对照一致,但日发芽率却比对照低,表明在此浓度下,种子的萌发已开始受到抑制。Na2CO3盐溶液在较低浓度下即对种子萌发产生抑制作用,发芽高峰期延后,而Na2SO4盐溶液浓度大于240 mmol/L和NaCl盐溶液浓度大于320 mmol/L时,种子的日发芽高峰期才开始延后,且随着盐浓度上升愈加明显。可以看出,Na2CO3胁迫抑制作用显著强于NaCl和Na2SO4;不同种类盐胁迫对2种药用甘草种子萌发速度的降低程度存在显著差异,且盐胁迫对乌拉尔甘草种子萌发速度的抑制程度强于胀果甘草种子。


2.4 盐胁迫对2种甘草种子其他相关萌发指标的影响
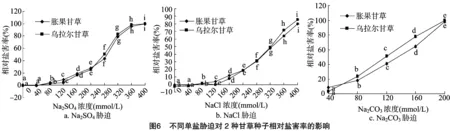
图3至图6分别表示的是不同单盐胁迫对2种甘草种子发芽势、发芽指数、活力指数、相对盐害率的影响。中性盐胁迫下,2种甘草种子的发芽势、发芽指数和活力指数均随着盐浓度增加呈现出先增大后减小的趋势。胀果甘草种子在Na2SO4浓度为 160 mmol/L 和NaCl浓度为80 mmol/L时表现出了最高的发芽势,在Na2SO4浓度为120 mmol/L和NaCl浓度为 120 mmol/L 时表现出了最高的发芽指数,在Na2SO4浓度为80 mmol/L和NaCl浓度为80 mmol/L时表现出了最高的活力指数。乌拉尔甘草种子在Na2SO4浓度为 120 mmol/L 和NaCl浓度为120 mmol/L时表现出了最高的发芽势,在Na2SO4浓度为80 mmol/L和NaCl浓度为 120 mmol/L 时表现出了最高的发芽指数,在Na2SO4浓度为80 mmol/L和NaCl浓度为80 mmol/L时表现出了最高的活力指数。碱性盐胁迫下,随着盐浓度的增加,2种甘草种子的发芽势、发芽指数和活力指数与对照相比均显著下降。相对盐害率的分析也验证了上述结果,即低浓度中性盐有利于种子萌发,碱性盐和高浓度中性盐抑制了种子萌发。
2.5 3种盐胁迫对2种甘草种子胚生长的影响
一定浓度的盐胁迫均对2种药用甘草胚的生长有抑制作用,表现为随着盐浓度的上升,萌发种子的胚根和胚轴总长度总体呈下降趋势(图7)。胀果甘草在低盐(Na2SO4浓度0~80 mmol/L、NaCl浓度0~80 mmol/L、Na2CO3浓度0~40 mmol/L)范围内,萌发种子的胚根和胚轴总长度与对照相比虽有所增加,但并无显著差异,在NaCl浓度为120 mmol/L时,萌发种子的总胚长与对照相比显著增加,说明此浓度有利于胀果甘草种子胚的生长。对乌拉尔甘草种子而言,盐胁迫对其影响与胀果甘草类似,在低盐(Na2SO4浓度0~80 mmol/L、NaCl浓度0~120 mmol/L)范围内,种子萌发总长度与对照相比无显著差异,但在NaCl为80 mmol/L时,萌发种子的总胚长与对照相比显著增加,Na2CO3在较低浓度时就显著抑制了胚长,且抑制作用明显强于胀果甘草。就萌发种子胚的生长情况来看,胀果甘草相比乌拉尔甘草更耐碱性盐。
2.6 2种甘草种子在3种盐胁迫下的耐盐范围
表1所示的是2种甘草种子发芽率与盐度的相关回归方程,分析“浓度-发芽率”关系可知2种甘草种子盐胁迫下的耐盐界限。胀果甘草耐盐临界值为:Na2SO40~248.35 mmol/L、NaCl 0~299.02 mmol/L、Na2CO30~151.20 mmol/L;耐盐极限值为:Na2SO40~406.35 mmol/L、NaCl 0~496.37 mmol/L、Na2CO30~298.0 mmol/L。乌拉尔甘草耐盐临界值为:Na2SO40~230.96 mmol/L、NaCl 0~278.36 mmol/L、Na2CO30~136.94 mmol/L;耐盐极值为:Na2SO40~395.66 mmol/L、NaCl 0~474.26 mmol/L、Na2CO30~289.34 mmol/L。这进一步说明了胀果甘草种子的耐盐能力强于乌拉尔甘草种子。


2.7 2种甘草种子盐胁迫解除后萌发能力分析
通过复水试验,盐胁迫下未萌发的种子活力并未完全丧失,中性盐胁迫下,胀果甘草种子盐胁迫解除后的发芽率均高于乌拉尔甘草种子,但两者均表现出了较高的发芽率(48%~88%);碱性盐胁迫下,虽然乌拉尔甘草种子的发芽率较高,但其在Na2CO3浓度为160 mmol/L时的发芽率却为0,说明其比胀果甘草耐高浓度碱性盐的能力弱。相比于中性盐,2种甘草均不耐碱性盐,盐胁迫解除后的发芽率最高才能达到32%,且随着盐溶液浓度的增加而迅速降低(图8)。
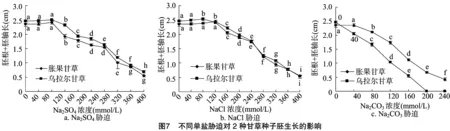

表1 2种甘草种子发芽率与盐度的相关回归方程

2.8 3种盐胁迫对2种甘草种子萌发过程中甘草酸含量的影响
水培对照处理的胀果甘草萌发种子中甘草酸含量为 2.56 mg/g,乌拉尔甘草萌发种子中甘草酸含量为3.09 mg/g。中性盐胁迫下,2种甘草种子种内源甘草酸的含量总体呈现出先增加后减少的趋势,且在Na2SO4和NaCl度均为 80 mmol/L 时达到最高值,与对照相比差异显著。碱性盐严重抑制了2种甘草种子甘草酸的合成,随着盐浓度的升高,其甘草酸含量与对照相比显著降低。乌拉尔甘草种子中内源甘草酸含量高于胀果甘草种子,应与品种有关(图9)。

3 讨论与结论
本试验结果表明,2种药用甘草种子萌发期对3种钠盐(Na2SO4、NaCl和Na2CO3)胁迫的响应基本一致,但对不同盐种类响应程度的差异较大。低浓度中性盐(Na2SO4、NaCl)溶液有利于种子的萌发,并且能够促进胚根和胚轴的伸长生长,表现为种子的发芽率、发芽势、发芽指数、活力指数均有所升高。但中性盐溶液浓度高于一定值时,抑制了2种甘草种子的萌发,且随着浓度的增加,抑制作用增强。碱性盐(Na2CO3)溶液在较低浓度时就严重抑制了种子的萌发,且其相对2种中性盐(Na2SO4、NaCl)溶液对甘草种子萌发的影响较强,这与陆嘉惠等研究盐胁迫对乌拉尔甘草和光果甘草种子萌发影响的结果[18-20]相似。低浓度中性盐促进种子萌发的原因可能是低浓度盐分促进了细胞膜的渗透调节,也可能是微量的无机离子对呼吸酶有一定的激活作用,从而提高了种子的各项萌发指标;高浓度盐分胁迫降低种子储藏物质分解和转化速率,损伤膜脂和膜蛋白,抑制种子萌发[21]。其响应机制与不同物种长期生存条件,尤其是气候、土壤条件密切相关。胀果甘草和乌拉尔甘草生境土壤常轻度、中度或重度盐渍化,刚好与盐胁迫及解除盐胁迫处理下甘草种子萌发的响应一致,表明土壤盐浓度高时,能避开逆境,延缓萌发,在降雨表层土壤盐分下降后能够迅速恢复萌发、生长,这是2种甘草种子萌发对盐渍环境的适应策略。
离子毒害和渗透效应被认为是盐对植物种子盐害作用的主要表现。在种子萌发期,这2种效应作用往往同时存在,通常可通过种子复水试验来判断这2种效应的作用大小。一些盐生植物种子从盐溶液转到淡水中可以获得全部萌发,渗透效应大于离子毒害[21]。本试验中,中性盐胁迫下2种甘草种子盐胁迫解除后的发芽率较高,说明盐胁迫下种子的低发芽率主要是渗透效应造成的,而碱性盐处理下,2种甘草种子复水后的发芽率仍然很低,说明碱性盐破坏了种子活性,其对种子的胁迫效应主要为离子毒害。
大多数研究表明,逆境胁迫有利于植物次生代谢产物的累积,甚至有些次生代谢产物是同植物在逆境胁迫的协同作用下而产生的[22-23]。甘草酸既是甘草的主要次生代谢产物,又是一种天然非离子型表面活性剂,它能维持膜表面的液化状态,在盐与膜之间形成盐桥,缓解盐在膜上的结晶,从而能够通过维持细胞膜的稳定性和清除自由基来减少盐害[24]。试验结果表明,乌拉尔甘草种子萌发过程中甘草酸含量高于胀果甘草,但其种子萌发抗盐碱性指标却低于后者,其机制还有待深入研究。由于发芽期和幼苗期是植物对盐胁迫最敏感的时期[25],可通过推测种子萌芽期的耐盐性来反映该品种在其他时期的耐盐性。因此,可在甘草种植过程中,先测定土壤盐碱度再选择适当的盐环境胁迫来提高甘草酸含量,精准地营造既增加产量,又提高其活性成分的生境条件,对提高药用植物的药用价值和种植效益具有重要意义。
参考文献:
[1]陈 镭,侯东升,郭玲玲,等. 新疆盐碱地形成特点及改良措施[J]. 新疆农垦科技,2009,32(5):56-57.
[2]李学禹,陆源芬,阎 平. 中国西部地区药用甘草的生态学特征及群落分类[J]. 石河子农学院学报,1991,18(3):1-6.
[3]周小玲,马新娥,尚可为,等. 不同物候期胀果甘草生物量和营养物质生殖分配研究[J]. 草业学报,2012,21(4):25-32.
[4]郗金标,张福锁. 新疆盐生植物[M]. 北京:科学出版社,2006:129.
[5]陈云华. 不同来源甘草的化学成分及相关药效的研究[D]. 北京:北京中医药大学,2008:5-7.
[6]李学禹. 甘草属分类系统与新分类群的研究[J]. 植物研究,1993,13(1):14-43.
[7]刘伯衡,李学禹,田丽萍,等. 新疆产甘草属植物化学成分的研究[J]. 干旱区研究,1992,9(1):39-46.
[8]朱任之. 甘草次酸钠口服给药的抗炎及免疫调节作用[J]. 中国药理学通报,1996,12(6):542-544.
[9]张东方,黄 炜,黄济群,等. 甘草酸抗人肺癌细胞增殖和侵袭作用的研究[J]. 中国现代医学杂志,2003,13(14):29-31.
[10]张永锋,梁正伟,隋 丽,等. 盐碱胁迫对苗期紫花苜蓿生理特性的影响[J]. 草业学报,2009,18(4):230-235.
[11]杨秀红,李建民,董学会,等. 盐胁迫对甘草种子发芽与子叶抗氧化指标的影响[J]. 种子,2005,24(9):30-32.
[12]刘广明,塔依尔,杨劲松,等. 中性盐胁迫对乌拉尔甘草种子萌发的影响研究[J]. 土壤,2011,43(1):135-139.
[13]起登凤,古再况努尔·吾甫尔,努尔艾合买提·依不热依木,等. 盐胁迫对胀果甘草种子发芽、幼苗生长及抗氧化指标的影响[J]. 安徽农业科学,2010,38(19):10049-10050.
[14]Rim B,Abderrahmane R,Abdeiaziz A. The effect of salinity on the germination,plant growth and essential oil content ofThymesbroussonetiiBoiss:an endemic species in Morocco[J]. India Journal of Agricultural Research,2009,4(1):211-219.
[15]Debez A,Hamed K B,Grignon C,et al. Salinity effect on germination,growth,and seed production of the halophyte Cakile maritime[J]. Plant and soil,2004,262(1/2):179-189.
[16]宋士清. 不同处理对云南黑籽南瓜种子发芽特性的影响[J]. 河北职业技术师范学院学报,2000,14(2):17-20.
[17]兰 霞,王洪新. 比色法测定甘草中总皂苷的含量[J]. 时珍国医国药,2007,18(4):886-887.
[18]张慧慧,刘明言,凌宁生. 香草醛-硫酸测定甘草浸膏中甘草酸含量[J]. 化工进展,2013,32(1):180-183.
[19]陆嘉惠,吕 新,吴 玲,等. 三种药用甘草种子对盐渍环境的萌发响应及其适宜生态种植区[J]. 草业学报,2013,22(2):195-202.
[20]李吉玫,张毓涛. NaCl胁迫对2种豆科植物种子萌发及生理指标的影响[J]. 福建林学院学报,2013,33(4):334-339.
[21]赵可夫,范 海. 盐生植物及其对盐渍环境的适应生理[M]. 北京:科学出版社,2005.
[22]王永路,孙正海,邓 艳,等. 盐胁迫提高金盏菊和万寿菊的耐盐性[J]. 江苏农业科学,2016,44(8):269-272.
[23]郭 晖,冯文君,朱红霞,等. 土壤盐胁迫下4种园林植物的生理抗性[J]. 江苏农业科学,2017,45(14):115-118.
[24]廖建雄,王根轩. 甘草酸在甘草适应荒漠生境中的可能作用[J]. 植物生理学通讯,2003,39(4):367-370.
[25]孙小芳,郑青松,刘友良. NaCl胁迫对棉花种子萌发及幼苗生长的伤害[J]. 植物资源与环境学报,2000,9(3):22-25.

