家蚕油蚕的研究进展及其开发利用
韦伟洋 赵巧玲
(江苏科技大学, 江苏镇江 212018)
家蚕(Bombyxmori)作为重要的农业经济昆虫,其遗传突变体的种类十分丰富,可以作为一种模式生物用于鳞翅目生物的科学研究[1]。随着家蚕全部基因组测序的完成[2],对家蚕各方面的探究也进入了新的阶段。在家蚕的后基因组时期[3-5],一些特殊家蚕突变体的研究利用也备受研究人员的青睐。
油蚕由于较少的尿酸盐(urate)积累,以它为模型研究家蚕的尿酸盐代谢通路和信号传导机制,对于人类痛风疾病的治疗具有积极意义。因此人们对油蚕的研究也越来越深入,对其形成机制的认识也越来越清晰。为了更全面地了解油蚕,现将油蚕的有关研究进展整理如下,以供参考。
1 油蚕的种类
家蚕是一种排泄尿酸(uric acid)的昆虫,正常家蚕幼虫体表表皮内含有丰富的白色小球型的尿酸盐结晶成分,使其表皮不会呈现透明状。而油蚕幼虫,由于其表皮中含有的尿酸盐成分非常少,使其全身表皮呈现出完全透明或半透明状,犹如一张油纸一样[6]。油蚕体内的尿酸盐含量一般为普通野生型家蚕的3%~80%,而且油蚕体内的尿酸盐含量越少,其表皮的透明度就会越高[7-8]。相对比较透明的,被称之为高度油蚕;相对没有那么透明的,被称之为低度油蚕。部分油蚕可以透过表皮看到其体内的背脉管、马氏管等功能器官,而大部分油蚕在2龄起蚕的时候就可以辨识,4龄到5龄期油蚕性状会变得更加明显[7-8]。
据报道,迄今已发现40多个基因能引起油蚕突变,通过经典遗传分析已有20多个基因定位于不同连锁群上,有的位点有多个等位基因,例如青熟油蚕oa有第2青熟油蚕oa2和斑青熟油蚕oav等位基因,均位于14-42.2座位上。目前,油蚕突变体中只有显性短节油蚕(Obs,18-6.2)和显性筑紫油蚕(Odc,16-29.7)是由显性突变基因导致的,其余都是由隐性突变基因所调控[9]。主要油蚕种类及其基因如表1所示。
2 油蚕形成的原因
研究显示,家蚕体内的尿酸是由嘌呤代谢而来的,其代谢途径如下:首先,腺嘌呤在腺嘌呤脱氨酶的作用下脱氨产生次黄嘌呤(hypoxanthine),次黄嘌呤再在黄嘌呤氧化酶(xanthine oxidase)的作用下,发生氧化反应生成黄嘌呤(xanthine);而鸟嘌呤在鸟嘌呤脱氨酶的作用下直接生成黄嘌呤。然后,黄嘌呤在黄嘌呤脱氢酶(XDH)作用下氧化成尿酸(图1)。尿酸是在家蚕脂肪体等器官中生成的,一部分随代谢废物如粪便、尿液排出体外,另一部分形成尿酸盐通过血液运输到真皮细胞,以尿酸盐颗粒状蓄积在真皮细胞中,使家蚕表皮呈白色不透明状。不同于除人类、灵长类外的其他哺乳动物,尿酸还会在尿酸氧化酶(urate oxidase)作用下产生尿囊素(allantoin)和二氧化碳(CO2),尿囊素在尿囊素酶(allantoinase)作用下水解成尿囊酸(allantoin acid),尿囊酸在尿囊酸酶作用下进一步产生尿素和乙醛酸(glyoxylic acid),而且尿素在不同生物个体中代谢的中间产物也不一样[13-14]。
而在发生突变的油蚕个体表皮中的尿酸盐粒子较少,所以导致家蚕表皮呈现出某种程度的透明状[15]。认为其原因是在尿酸生成、运输、蓄积过程发生异常。og和oq突变体是由于尿酸合成不足导致的;ow、os和ok突变体是由于尿酸不能正常转运引起的;而od和oa突变体则是由于尿酸盐不能在表皮细胞中积累造成的。有研究发现,在给正常家蚕食用的桑叶中添加蜜胺[C3N3(NH2)]能够得到与油蚕非常相似的表型,认为可能是因为蜜胺切断了家蚕表皮中尿酸与蛋白之间的结合,尿酸被排泄出体外,无法在家蚕表皮中积累,导致了家蚕表皮呈透明状[16-17]。
表1油蚕的主要种类及其基因
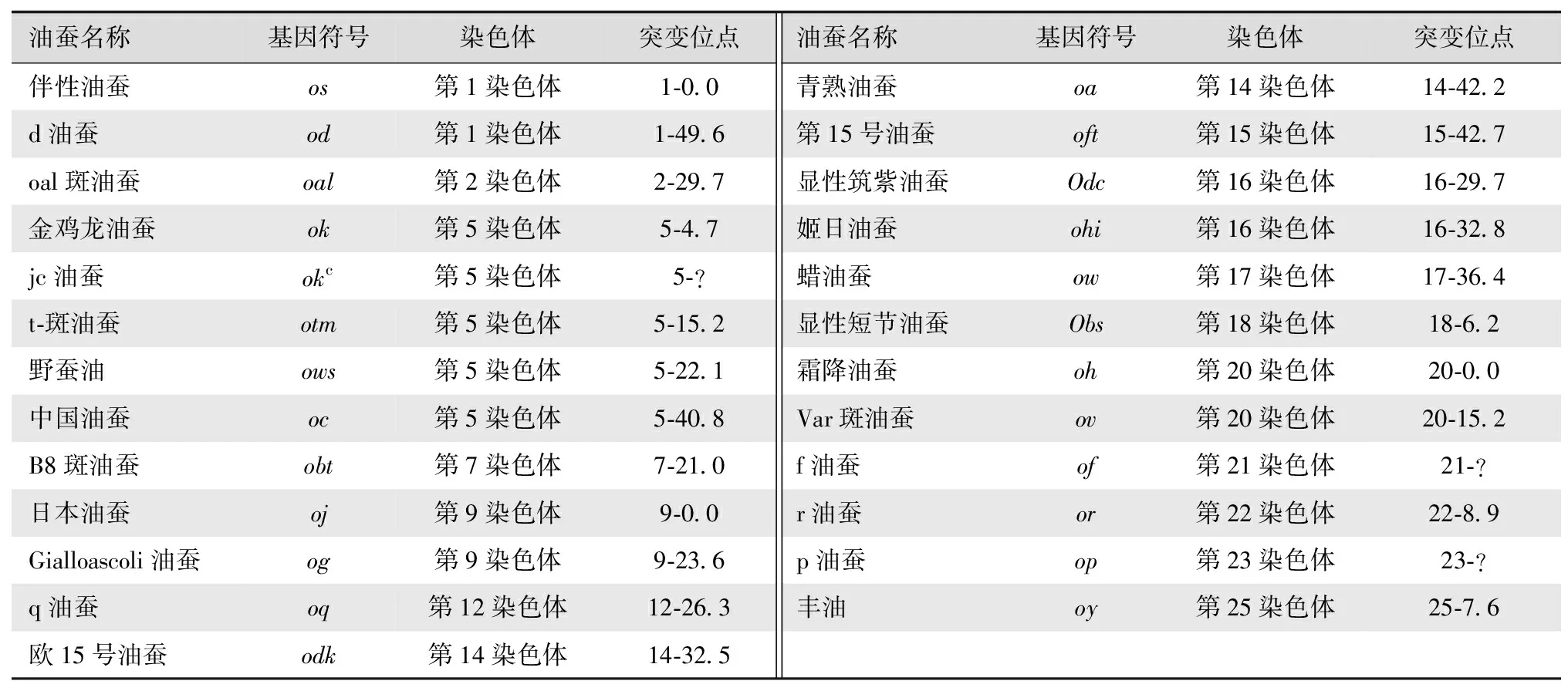
油蚕名称基因符号染色体突变位点油蚕名称基因符号染色体突变位点伴性油蚕os第1染色体1-0.0青熟油蚕oa第14染色体14-42.2d油蚕od第1染色体1-49.6第15号油蚕oft第15染色体15-42.7oal斑油蚕oal第2染色体2-29.7显性筑紫油蚕Odc第16染色体16-29.7金鸡龙油蚕ok第5染色体5-4.7姬日油蚕ohi第16染色体16-32.8jc油蚕okc第5染色体5-?蜡油蚕ow第17染色体17-36.4t-斑油蚕otm第5染色体5-15.2显性短节油蚕Obs第18染色体18-6.2野蚕油ows第5染色体5-22.1霜降油蚕oh第20染色体20-0.0中国油蚕oc第5染色体5-40.8Var斑油蚕ov第20染色体20-15.2B8斑油蚕obt第7染色体7-21.0f油蚕of第21染色体21-?日本油蚕oj第9染色体9-0.0r油蚕or第22染色体22-8.9Gialloascoli油蚕og第9染色体9-23.6p油蚕op第23染色体23-?q油蚕oq第12染色体12-26.3丰油oy第25染色体25-7.6欧15号油蚕odk第14染色体14-32.5
表中数据来源于参考文献[10-12]。
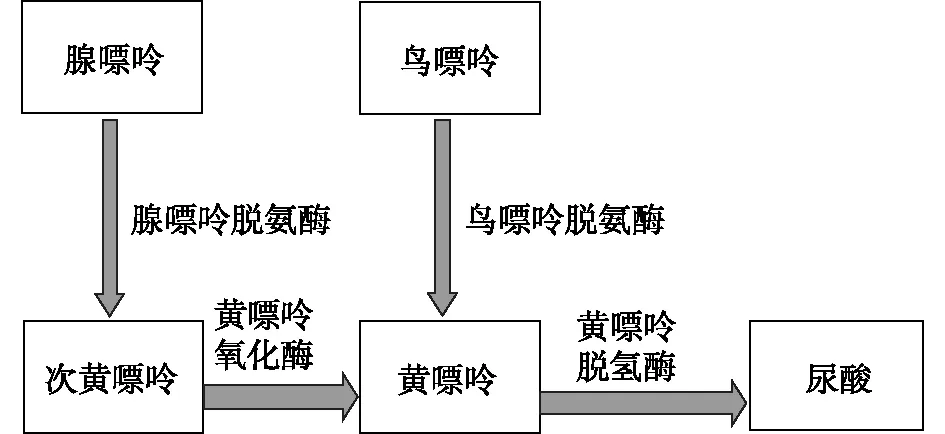
图1 尿酸生成途径
3 油蚕形成的分子机制
目前,对于油蚕形成的分子机制方面的研究获得了许多的成果。相对而言,XDH在家蚕尿酸代谢路径上探究的较为详细,XDH是一个含钼的同型二聚体酶,每一个单体含有1个钼辅因子(MoCo)、1个黄素腺嘌呤二核苷酸(FAD)和1对铁硫蛋白(2Fe/2S)中心,在家蚕幼虫期的脂肪体、马氏管、中肠等器官中都有一定的活性,在家蚕的这些器官和组织中,黄嘌呤可以被XDH氧化产生尿酸,当中有一些被运输至家蚕皮肤之中,并以尿酸盐晶体粒子的形式累积了起来,所以导致家蚕幼虫的皮肤不会表现出透明状。正常家蚕幼虫脂肪体中XDH有XDHα和XDHβ 2个亚型。家蚕中有2个XDH基因,即BmXDH1和BmXDH2,在基因组上同方向排列,相距1.6 kb。
实验表明,Gialloascoli油蚕和q油蚕,这2个油蚕品种发生突变的原因是由于缺少了XDH的活性,导致它们无法合成尿酸而形成透明的幼虫皮肤[18-19]。控制oq突变体的基因目前已被确定是1个XDH基因,并且已经被克隆出来,研究者们将其称为BmXDH1[20],在MoCo结合区域缺失8 bp,导致基因转录提前终止。oq突变体中缺失XDHα活性,但有XDHβ活性。BmXDH1是编码XDHα的基因。og突变体有ogk和ogt2个等位基因,它们的蛹期死亡率高,og突变体的雌体及ogk和ogt突变型的雌雄体都是不育的[18-19]。虽然og突变体的XDH的活性欠缺,但引起og突变体的关键基因并非BmXDH,它与钼辅因子的生成有关,是钼辅硫化酶(MoCoS)的编码基因。ogk在第4~5外显子缺失了1 kb,而ogt在第4外显子插入了551 bp,在插入序列中出现了终止密码,也出现有缺失第4外显子的一部分mRNA的情况。
在2009年,东京大学的研究者ITO等[21]首次向人们阐述了ow油蚕形成的分子机制,成功地在野生型家蚕中克隆了ow基因的完整DNA序列,总长3 105 bp,编码了920个氨基酸的蛋白质,通过BLAST的对比分析表明,ow基因编码的蛋白质和Varp蛋白有着非常高的同源性,因此被称为BmVarp,Varp蛋白有着调节细胞内各种物质运转的作用,所以预测BmVarp在家蚕表皮中对尿酸盐的运转有着十分关键的作用。ow突变体中出现了一段25 bp的插入序列,引起了自身的编码框产生了位移,导致过早地出现了1个终止密码子,并且使BmVarp蛋白结构发生了改变,因此猜测这个基因突变对其转运尿酸的能力产生了一定程度上限制,导致了尿酸盐无法高效地在家蚕表皮中累积,所以才会让家蚕的表皮表现出某种程度的透明状。
位于第5连锁群发生突变形成的ok突变体,是由于1个名为Bm-ok基因的结构和功能出现缺陷,导致突变体中的蛋白质无法正常翻译,研究发现,在2个ok突变体品系中,Bm-ok基因的mRNAs分别出现了49 bp碱基的缺失和233 bp碱基的重复,通过蛋白数据库的比对结果显示,Bm-ok蛋白与果蝇中的“half-type ABC转运蛋白”以及“ABC-g”家族同源[22],认为它与尿酸的运输有关。
位于第14连锁群发生突变形成的oa突变体,是因为BmHPS5发生突变导致的。研究表明,BmHPS5是溶酶体相关细胞器复合物-2的生物起源的HPS5亚基的同源物,其基因有5个外显子,oa突变体的3个等位基因oa、oa2、oav分别是由于第4号外显子中4 bp(CAGA)的缺失、第4号外显子中1 bp(T)碱基的缺失以及第5号外显子中碱基的突变(GGA→TGA)引起的[23]。
4 油蚕的利用与产品研发
1995年,韩国的研究者RYU等人提出了选用5龄第3天家蚕的幼虫,对之实施冷藏和干燥处理,然后将其制成全蚕粉用来医治糖尿病,试验发现,患者在食用第4周后能够降低20%的血糖,全蚕粉用来降低血糖的功能机制的探究和利用有了突破性进展[24]。目前,世界各地多个国家和地区正在把全蚕粉当作Ⅱ型糖尿病患者的养生良药。在我国,桂仲争等[25]也展示了全蚕粉作为食物的营养价值以及它降血糖的医疗效果,用5龄成熟的家蚕生产的全蚕粉不仅能够降低血糖和血脂,并且还有助于提高免疫力,调节人体代谢平衡[26]。
然而用一般的普通家蚕制成的全蚕粉都有一些明显的不足,如普通的家蚕制成的全蚕粉尿酸盐结晶成分的含量过高,而这些结晶能导致人类身体产生肾结石、尿道结石以及出现痛风等病症,而且尿酸盐还会导致一些人出现过敏反应。但是,以各种油蚕突变体为主要原材料,可以制成非常高效的能够降低血糖并且尿酸盐含量非常低的全蚕粉或蚕蛹粉[27]。
另外,家蚕有与哺乳动物相同的药物代谢酶,体内药物吸收与哺乳动物类似,而且家蚕具有个体大小合适、方便手持注射,饲养成本较低,不易造成生物公害等明显的优势[28],可以利用家蚕建立生物模型来评价药物的疗效。家蚕与人同是以尿酸作为氮代谢废物排泄的,将油蚕作为研究尿酸代谢的模型,有助于进行对人的高尿酸血症和痛风的治疗药物的开发。
如何更好地对油蚕进行各个方面的功能价值研究与功能产品开发必将会是一个新的研究热点,也会使得今后蚕桑产业研究的重点有所转移,对整个蚕桑产业结构的调整以及如何高效地增加蚕桑产业的产值等都将起到重要作用。
[1] 秦俭,何宁佳,向仲怀.家蚕模式化研究进展[J].蚕业科学,2010,36(4):645-649.
[2] MITA K,KASAHARA M,SASAKI S,et al.The genome sequence of silkworm,Bombyxmori[J].DNA Res,2004,11(1):27-35.
[3] XIA Q,ZHOU Z,LU C,et al.A draft sequence for the genome of the domesticated silkworm (Bombyxmori)[J].Science,2004,306(5703):1 937.
[4] MITA K.Genome of a lepidopteran model insect,the silkwormBombyxmori[J].Insect Biochem Mol Biol,2009,81(5):353.
[5] ZHOU Z H,YANG H J,ZHONG B X.From genome to proteome:great progress in the domesticated silkworm (BombyxmoriL.)[J].Acta Biochimica Et Biophysica Sinica,2008,40(7):601-611.
[6] 伊藤智夫.家蚕生化学[M].东京:裳华房,1984:171-192.
[7] 秦俭.家蚕oe油蚕的遗传学研究[J].蚕业科学,1987,13(3):183-185.
[8] 火田村又好.油蚕性与尿酸的关系[J].蚕试报告,1943(11):347.
[9] 土井良宏,筑紫春生.关于油蚕形质发现的特异性的遗传学解析I[J].九州大学农学部学艺杂志,1962,19(4):411-427.
[10] 伴野丰,藤井博,河口丰,等.家蚕突变手册2005——基因名和基因符号[M].福冈:九州大学大学院,2005.
[11] 赵巧玲,叶夏裕,夏定国,等.家蚕jc油蚕的发现和连锁分析[J].蚕业科学,1997,23(4):211-214.
[12] 胡海,李涛,代方银,等.家蚕jc油蚕基因座的确定及pe-wb-okc三隐性系的建立[J].蚕学通讯,2010,30(1):8-11.
[13] 清水滋.关于家蚕马氏管排泄作用的研究(VI)油蚕尿酸的排泄[J].蚕试报告,1943(11):379.
[14] 土井良宏,木原始,中山光育.oq油蚕的遗传学的研究[J].日蚕杂,1987,56(2):120-123.
[15] 刘劲,代方银,朱勇,等.家蚕突变体的嘌呤代谢[J].蚕学通讯,2005,25(3):6-11.
[16] 代方银,鲁成,向仲怀.家蚕基因资源品系油蚕突变体的鉴定试验[J].蚕学通讯,1997,17(2):2-6.
[17] 土井良宏,木原始,河口丰.家蚕的新突变日本油蚕的遗传学研究[J].日蚕杂,1992,61(5):451-454.
[18] KOMOTO N. A deleted portion of one of the two xanthine dehydrogenase genes causes translucent larval skin in theoqmutant of the silkworm[J].Insect Biochem Mol Biol,2002(32):591-597.
[20] 罗亭玉.伴性油蚕(os)的分子标记定位及形成机理初探[D].重庆:西南大学,2010.
[21] ITO K, SUSUMU K, YAMAMOTO K, et al. A 25 bp-long insertional mutation in theBmVarpgene causes the waxytranslucent skin of the silkworm,Bombyxmori[J].Insect Biochem Mol Biol,2009,39(4):287-293.
[22] WANG L,KIUCHI T,FUJII T,et al.Mutation of a novelABCtransporter gene is responsible for the failure to incorporate uric acid in the epidermis ofokmutants of the silkworm,Bombyxmori[J].Insect Biochem Mol Biol,2013,43(7):562-571.
[23] FUJII T,BANNO Y,ABE H,et al.A homolog of the human Hermansky-Pudluck syndrome-5 (HPS5) gene is responsible for theoalarval translucent mutants in the silkworm,Bombyxmori[J].Genetica,2012,140(10-12):463-468.
[24] 郑露露.蚕的药用价值和开放前景[J].蚕桑茶叶通讯,2001(3):38-39.
[25] 桂仲争,庄大桓.全蚕粉及其生理功能[J].中国蚕业,2000,21(2):34.
[26] 马宝俊,高玉军.特殊用途家蚕品种介绍[J].承德医学院学报,2005,22(1):70-71.
[27] 王安皆,娄齐年,周丽霞,等.油蚕的生理特征及其开发利用[J].北方蚕业,2009,30(2):9-10.
[28] 王长春.建立家蚕痛风药物筛选模型的初探[D].重庆:西南大学,2012.

