P2X4过表达对帕金森病模型大鼠脑内细胞凋亡的作用☆
刘佳琳 花菲菲 张英英 侯炳辉 谢安木○☆
帕金森病(Parkinson disease,PD)尚未有明确的发病机制,既往PD患者临床病理学研究、动物模型研究和神经炎症靶治疗研究均表明神经炎症及凋亡反应可介导多巴胺能神经元的进行性死亡,与PD密切相关[1-3]。大量研究为NLRP3炎性小体在中枢神经系统免疫炎症中的作用提供了依据,NLRP3炎性小体在上游信号因子ATP的激活下可以促进凋亡蛋白酶的产生从而调控一系列下游炎症因子的成熟和分泌,从而引发炎症放大反应,在PD的发生发展中发挥关键的调控作用[4]。P2X4是中枢神经系统中分布最广泛的ATP受体[5]。因此,我们推测,在PD动物模型中P2X4作为NLRP3上游激活物ATP的受体,参与DA神经元的炎症及凋亡过程,从而介导PD的发生发展。为此,本实验通过检测6-OHDA诱导的PD模型大鼠及病毒干扰模型大鼠处理侧黑质中P2X4R、NLRP3、caspase-1表达水平以及处理侧黑质中多DA神经元的数量,探讨P2X4基因过表达对6-OHDA诱导的帕金森病模型大鼠脑内细胞凋亡的作用。
1 动物与方法
1.1 实验动物与分组实验采用清洁级雄性wistar大鼠(手术时体重 200~250 g,n=120)由青岛市实验动物和动物实验中心提供[许可证号SCXK(鲁)2014 0001],在标准温度(21±2℃)下饲养,2 只/笼,并可自由获得食物和水。实验开始前至少适应实验室环境1周。
将大鼠按照完全随机分配原则分为6组,处理如下:①对照组:经立体定位仪用微量注射器向大鼠左侧黑质注射等量生理盐水;②6-OHDA组:经立体定位仪用微量注射器向大鼠左侧黑质注射6-OHDA(Sigma,美国);③单纯目的基因(RNAP2X4)组:经立体定位仪用微量注射器向大鼠左侧黑质注射携带P2X4目的基因的RNA-P2X4慢病毒(吉凯基因,中国),1周后经立体定位仪用微量注射器向大鼠左侧黑质注射生理盐水;④目的基因(RNA-P2X4)+6-OHDA组:经立体定位仪和微量注射器向大鼠左侧黑质注射携带空载RNA的P2X4-NC慢病毒,1周后经立体定位仪用微量注射器向大鼠左侧黑质注射6-OHDA;⑤单纯阴性病毒(P2X4-NC)组:经立体定位仪和微量注射器向大鼠左侧黑质注射携带空载RNA的P2X4-NC慢病毒,1周后经立体定位仪用微量注射器向大鼠左侧黑质注射生理盐水;⑥阴性病毒(P2X4-NC)+6-OHDA组:经立体定位仪和微量注射器向大鼠左侧黑质注射携带空载RNA的P2X4-NC慢病毒,1周后经立体定位仪用微量注射器向大鼠左侧黑质注射6-OHDA。
1.2 PD动物模型的制备[6]
1.2.1 慢病毒及6-OHDA的定位注射 大鼠称重麻醉(10%水合氯醛,4 mg/100 g,腹腔注射)后将将大鼠置于小动物立体定位仪上(瑞沃德,中国)备皮、消毒后切开颅顶皮肤。以前囟为原点,参照PAXINOS[7]大鼠脑立体定位图谱标记左侧黑质坐标(前囟后5.0 mm,旁开左侧2.1 mm,深度7.7 mm)[6]进行定位并钻孔。用微量注射器吸取携带目的基因P2X4的慢病毒或阴性对照慢病毒 2 μL定位注射,针头留置5 min后,以1 mm/min速度缓慢退针,对照组采用相同体积生理盐水。预处理1周后,于左侧黑质定位注射6-OHDA(8μg/2 μL 0.2%抗坏血酸)[6]或等量0.2%抗坏血酸。
1.2.2 行为学检查 造模1周后,应用阿朴吗啡(Sigma,美国),0.5 mg/kg,腹腔注射诱发旋转实验记录30 min内向右侧旋转次数,成功的PD大鼠模型旋转速度≥7转/min[8]。每周诱发1次,连续3周,取平均值。
1.3 免疫荧光染色造模4周后,每组取10只大鼠用10%水合氯醛腹腔麻醉后,开胸暴露心脏,先后经生理盐水、4%多聚甲醛灌注后断头取脑,然后分别用4%多聚甲醛、20%及30%蔗糖固定及脱水,于-80℃冰箱冻存。参照大鼠脑立体定位图谱[6],包埋剂包埋鼠脑后于冰冻切片机中对大鼠脑组织进行冰冻切片,切取的脑片用PBST洗涤3次后加入 TH 抗体(CST,美国,1∶2000),孵育过夜(4℃摇床)。次日用PBST洗涤3次后加荧光二抗(Abcam,英国,1∶500),室温摇床孵育 2 h 后,再用PBST冲洗 3次后于载玻片上,指甲油封片后于4℃冰箱保存。在100倍倒置荧光显微镜下携带目的基因的慢病毒在左侧黑质中的表达情况并用Image-J软件对TH染色阳性的多巴胺能神经元进行计数。
1.4 Western blot法检测 P2X4R、NLRP3 和 caspase-1含量造模4周后,每组取10只大鼠用10%水合氯醛腹腔麻醉后断头取脑,冰上操作,快速分离出新鲜的大鼠左侧黑质组织,称重后分别置于EP管中,每个EP管中加入 200μL细胞裂解液、2μL蛋白酶抑制剂、20μL磷酸酶抑制剂,碾磨后冰上裂解,4℃高速离心 (12000 r·min-1)15 min后取上清,用 BCA法测定上清液中总蛋白含量。
配制SDS-PAGE凝胶,根据BCA法测得的蛋白浓度计算上样体积进行上样,80 V恒压电泳30 min,120 V恒压电泳60 min,电泳完毕后取出凝胶,与PVDF膜按顺序摆放于装膜夹中,于转膜槽中300 mA恒流转膜90 min。取出PVDF膜,PBST洗涤1次后封闭(5%脱脂牛奶,1 h,室温),封闭后加入相应一抗 :anti-P2X4R(Alomone labs,以色列,1∶200);anti-NLRP3 (Abcam, 英国,1∶1000);anti-caspase-1(Abcam,英国,1∶500);anti-GAPDH(CST,美国,1∶1000)。 孵育过夜(4 ℃摇床),次日PBST洗涤 3次后加入二抗 (浓度 1∶2000),孵育1 h(室温摇床),再次洗涤3次后加入化学发光剂作用,于显影仪中避光显影。用Image-J软件对目标条带的灰度值进行分析。目的蛋白的相对表达水平以目的蛋白与GAPDH(内参)条带灰度值的比值表示,并进行统计学分析。
1.5 统计学方法实验所得数据用统计软件SPSS Statistics19.0进行分析,数据以(x±s)表示。两组比较采用t检验,组间比较采用单因素方差分析。检验水准α=0.05。
2 结果
2.1 免疫荧光染色法免疫荧光显微镜下 (如图1),携带目的基因的慢病毒在大鼠左侧黑质中DA神经元中表达相对稳定。与A组 (7326.0±139.8)相比较,B 组(5756.0±76.5)、黑质中 TH 阳性DA神经元数量显著减少,差异有统计学意义(P<0.0001)。 与 F 组(5594.0±143.1)相比较,D 组(4934.0±212.8)黑质中TH阳性DA神经元数量减少,差异有统计学意义 (P=0.0087)。C组(7261.0±133.7)、E 组(7341.0±176.1)大鼠黑质 TH 阳性 DA神经元数量与A比较,无统计学差异(P=0.7425,P=0.9499)。
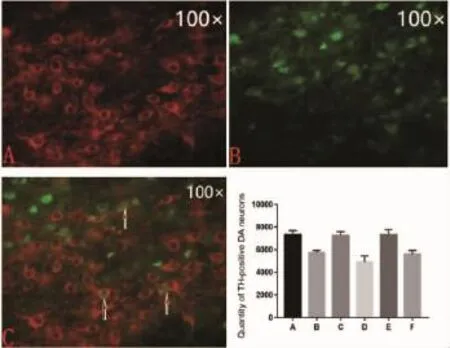
图1 携带目的基因或空载慢病毒在大鼠左侧黑质中的分布情况
2.2 Western blot法检测 P2X4R、NLRP3及Caspase-1蛋白含量与A组比较,B组 P2X4、NLRP3、caspase-1的表达均明显增加,差异有统计学意义(P<0.05)而 E 组 P2X4R、NLRP3、caspase-1的表达无明显增加,差异无统计学意义(P>0.05)。 与 F 组相比较,D 组 P2X4R、NLRP3、caspase-1表达明显增加,差异有统计学意义(P<0.05)(见表 1,图 2)。
3 讨论
PD的主要病理特征即为DA神经元的损伤,损伤后的DA神经元会释放大量ATP[9]。NLRP3炎症小体可在ATP诱导下活化,活化后的NLRP3炎症小体可以促进下游炎症因子及凋亡蛋白酶的产生和激活,放大炎症反应及促进细胞凋亡[10-12]。早期研究表明,细胞的凋亡及存活受caspase家族调控,其中caspase-1作为caspase家族成员之一,参与细胞内NLRP3炎症小体的组成,促进炎症因子IL-1β和IL-18的成熟分泌,这些促炎因子作用于神经元表面受体,参与细胞凋亡反应的发生,从而使caspase-1发挥了超越炎症小体功能的精密调控作用[13-15]。近年研究表明,ATP调控激活NLRP3炎症小体,活化的NLRP3炎症小体及cas-pase-1引发的炎症反应在一些中枢神经系统神经退行疾病(如PD、亨廷顿舞蹈病等)的发病过程中发挥重要作用[16]。P2X4作为ATP的受体,广泛分布于中枢神经系统中,细胞损伤后或者凋亡后,胞内大量ATP直接释放入细胞外液,介导P2X4受体激活。因此推测,P2X4在ATP激活NLRP3及Caspase-1过程中发挥重要,从而参与帕金森病的炎症机制过程,P2X4受体表达上调可以促进NLRP3炎症小体激活,从而提高caspase-1蛋白表达水平,介导DA神经元细胞的凋亡。
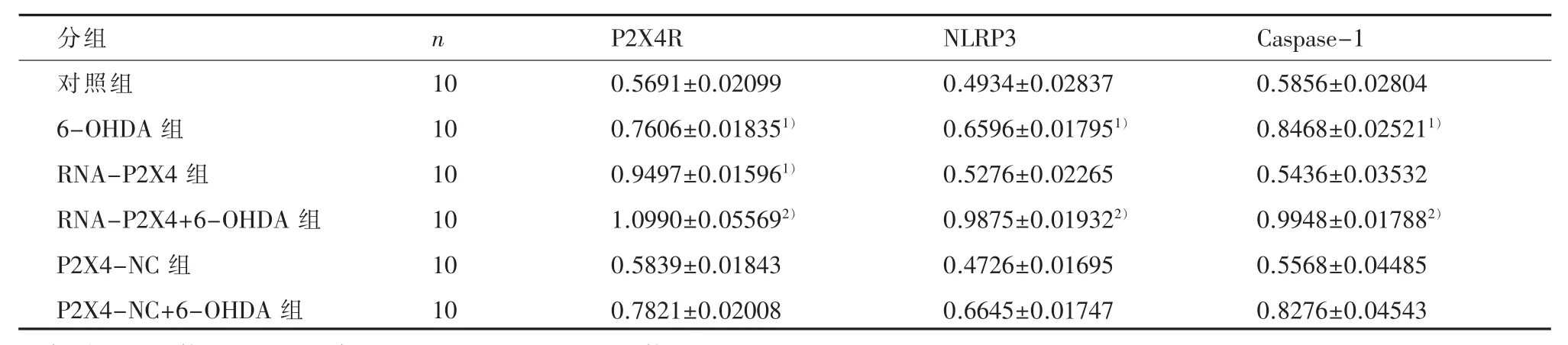
表1 各组目的蛋白的相对表达量
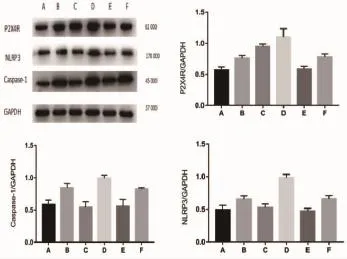
图2 Western blot法测定各目的蛋白含量 (A:对照组;B:6-OHDA 组;C:RNA-P2X4 组;D:RNA-P2X4+6-OHDA 组;E:P2X4-NC 组;F:P2X4-NC+6-OHDA 组)
本实验发现,与对照组比较,6-OHDA诱导的PD大鼠模型中P2X4R、NLRP3和caspase-1蛋白表达量显著升高,表明P2X4在PD发病机制中发挥重要作用。用携带P2X4基因的慢病毒处理大鼠后,处理侧黑质中P2X4R蛋白表达较单纯PD模型组或阴性对照慢病毒处理的PD模型组显著增加,而DA神经元数变化趋势与之相反,表明P2X4R蛋白增加促进了DA神经元的凋亡。而处理侧黑质内caspase-1、NLRP3蛋白表达量明显增加,与P2X4R蛋白变化趋势相同。因此,我们推测,P2X4通过促进NLRP3炎性小体的激活,提高凋亡蛋白酶caspase-1的释放从而参与PD的发生发展。本研究结果表明,在PD模型大鼠中,P2X4通过调控caspase-1的释放增加DA神经元的凋亡,在PD的凋亡机制中发挥重要作用。
综上所述,本实验通过上调P2X4受体的表达,并检测各组PD大鼠模型黑质中P2X4、NLRP3、caspase-1蛋白的表达情况及DA神经元数,证实了P2X4在PD发生发展过程中发挥重要作用,P2X4过表达可以提高PD模型中DA神经元caspase-1蛋白表达水平,促进炎症及凋亡反应,损伤DA神经元,导致大鼠黑质DA神经元的死亡。这可为PD的抗凋亡治疗提供了新可能及新靶点。
[1]TROMPETERO A,GORDILLO A,MORA CP,et al.Alzheimer's disease and Parkinson's disease:a review of current treatment adopting a nanotechnology approach[J].Curr Pharm Des,2017,28(1):187-197.
[2]GONZALEZ H,ELGUETA D,MONTOYA A,et a1.Neuroimmune regulation of mieroglial activity involved in neuroinflammation and neurodegenerative diseases[J].Neuroimmune,2014,274(1-2):1-13.
[3]HATTOM,GOUAUX E.MoIecuIarmechanism of ATP binding and ion channeI activation in P2X receptors[J].Nature,2012,485(7397):207-212.
[4]魏祺,程晓曙.NLRP3炎性小体研究进展[J].基础医学与临床,2015,35(1):117-121..
[5]LEVINSOLM JL,NEWMAN ZL,HELLMICH KA,et al.Anthrax lethal factor cleavage of Nlrp1 is required for activation of the inflammasome[J].PLoSpathogens,2012,8(3):e002638.
[6]SILVA TP,POLIA,HARA DB,et al.Time course study ofmicroglial and behavioral alterations induced by 6-hydroxydopamine in rats[J].Neurosci Lett,2016,622(27):83-87.
[7]PAXINOSG,CHARLESW.大鼠脑立体定位图谱 [M].3版,北京:人民卫生出版社,2005:23-35.
[8]DECRESSACM,MATTSSON B.Comparison of the behavioural and histological characteristics of the 6-OHDA andαsynuclein ratmodels of Parkinson’s disease[J].Experimental Neurology,2012,(1):306-315.
[9]SINGHALG,JAEHNE EJ,CORRIGAN F,et al.Inflammasomes in neuroinflammation and changes in brain function:a focused review[J].Frontiers inneuroscience,2014,315(8):339-343.
[10]PEDRAZA A,PEREZM,VALDEZHEMANDEZL,et al.Negative regulation of the inflammasome:keeping inflammation under control[J].Immunological reviews,2015,265(1):231-257.
[11]FREEMAN LC,TING JP.The pathogenic role of the inflammasome in neurodegenerative diseases [J],Joumal of neurochemistry,2016,136(1):29-38.
[12]BAUNE BT.Inflammation and neurodegenerative disorders:is there still hope for therapeutic intervention [J].Current opinion in psychiatry,2015,28(2):148-1 54.
[13]Man SM,KANNEEGANTI TD.Regulation of inflammasome activation[J].Immunological Reviews,2015,265(1):6-21.
[14]POREBA M,STROZYK A,SALVESEN GS,et al.Caspase substrates and inhibitors[J],Cold Spring Harbor perspectives in biology,2013,5(8):e008680.
[15]SOLLBERGER G,STRITTMATTER GE,GARSTKIEWICZ M,et al.Caspase-1:the inflammasome and beyond[J].Innate immunity,2014,20(2):115-125.
[16]COLLINS LM,TOULOUSE A,CONNOR TJ,et al.Contributions of central and systemic inflammation to the pathophysiology of Parkinson’s disease[J].Neuropharmacology,2012,62(7):2154--2168.

