基于功能磁性材料的细菌富集与鉴别
黄艳玲,张泽生,闫爽
(1.天津科技大学,天津300457;2.天津现代职业技术学院,天津300350;3.天津广播电视大学,天津300350)
面对当前严峻的食品安全问题,食源性致病菌的快速分析与鉴别已经成为多学科研究的热点[1]。由于传统微生物分析的耗时费力的不足,许多新技术已经应用到微生物的分析与鉴别。首先,基于质谱技术分析方法使微生物快速分析成为可能,特别是基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF MS),其使用方法简单、快速、精确和低成本,现已成为微生物分类鉴别的重要工具[2]。当前,利用MALDI-TOF MS分析微生物主要有两种方法分别是数据库法与生物信息学法[3]。数据库鉴别法就是把待检测微生物与数据库中标准菌质谱图进行比对,满足阈值后来确定待测菌的种属[4]。生物信息学法就是利用标准蛋白数据库对微生物蛋白标志物进行比对,从而对微生物进行分类鉴别。该方法中利用完整核糖体蛋白标志物鉴别微生物已被广泛报道。Tanigawa[5]利用核糖体蛋白通过搜索核糖体蛋白鉴别数据库对25个乳酸乳球菌菌株进行鉴别。
另外,为了提高MALDI-TOF MS检测效率,功能性纳米材料已经被广泛应用于微生物的富集与鉴别,功能性纳米材料的富集可提高质谱检测的检测限与检测效率。这些纳米材料主要是通过在纳米Fe3O4微粒表面固定靶向作用分析对微生物进行选择性富集,主要包括抗体[6-8]、核酸适配体[9]、生物蛋白[10]、糖类物质[11]。从而促进微生物的分离鉴别。由于大肠杆菌O157:H7是一株重要的食源性致病菌,本文通过开发一种简单、成本低的NH2-Fe3O4磁性颗粒,对大肠杆菌O157:H7进行快速富集,然后利用MALDI-TOF MS对其进行快速检测,再利用核糖体蛋白库对大肠杆菌O157:H7进行鉴别。
1 材料与方法
1.1 材料与仪器
FeCl·36H2O、FeSO·47H2O、Na2HPO·412H2O、NaH2PO·42H2O、N,N-二甲基甲酰胺(DMF)、甲苯、氨水:天津市光复精细化工研究所;四乙氧基硅烷(TEOS)、γ-氨丙基三乙氧基硅烷(APTES):武汉大学有机硅新材料股份有限公司;TSB培养基和琼脂粉:北京奥博星生物制品有限公司;α-腈基-4-羟基苯丙烯酸(CHCA):Bruker Daltonics;三氟乙酸(TFA:色谱纯):J.T.Baker;乙腈(ACN:色谱纯):J.T.Baker。
超声清洗器:宁波新芝生物公司;MALDI TOF MS/MS:spectrometer,Autoflex III Bruker Daltonics;Milli-Q水纯化系统:Millipore,Milford,MA;振荡培养箱:上海博迅实业有限公司;磁性分离器:DYNAL®invitrogen;紫外-可见吸收分光光度计:北京普析通用仪器有限责任公司;扫描电子显微镜(scanning electron microscope S4800 SEM):日立(中国)有限公司;LDJ 9600-1振动样品磁强度计:深圳市泰立仪器仪表有限公司。
1.2 方法
1.2.1 NH2-Fe3O4磁性颗粒的合成
NH2-Fe3O4磁性颗粒的合成按照Fan[12]报道的方法。
1.2.2 NH2-Fe3O4磁性颗粒的表征
扫描电镜图像(SEM)表征NH2-Fe3O4磁性颗粒形貌特征。红外光谱谱图的采集是通过傅里叶变换红外光谱仪采用压片法对NH2-Fe3O4磁性颗粒的官能团进行分析。NH2-Fe3O4磁性颗粒的磁性是在室温条件下通过LDJ 9600-1振动样品磁强度计对材料的磁性进行表征。
1.2.3 大肠杆菌O157:H7的富集
在37℃下,大肠杆菌O157:H7接种于25 mL灭菌TSB培养基中,摇床120 r/min培养16 h后,1 mL细菌菌悬液离心(12 000 r/min)5min,倒出上清,并用磷酸盐(phosphate buffer saline,PBS)缓冲液清洗两次,然后,利用紫外-可见吸收分光光度计600 nm波长调整到所需的浓度,另外,利用活菌计数法对其进行计数。
用PBS缓冲液配制NH2-Fe3O4磁性颗粒悬浊液(10 mg/mL),不同体积NH2-Fe3O4磁性颗粒悬浊液加入到菌液中,涡旋振荡,然后磁性分离,并用紫外-可见吸收分光光度计600 nm波长测量溶液OD值。
1.2.4 大肠杆菌O157:H7分析与鉴别
NH2-Fe3O4磁性颗粒吸附完毕,倒出上清后,加入50 μL氨水,在超声清洗器中振荡3min,磁性分离,去除NH2-Fe3O4磁性颗粒,上清12 000 r/min离心,然后分别加入10 μL 0.1%TFA与ACN后,涡旋振荡,取1 μL溶液用于MALDI MS线性模式进行分析。
利用 Flexanalysis软件 (version 3.0;Bruker Dal tonics)对质谱数据进行基线校正、平滑和标峰。然后利用 Tagident搜索工具(http://web.expasy.org/tagident/)对质谱峰进行数据库检索 (UniProtKB/Swiss-Prot和UniProtKB/TrEMBL)确定蛋白。然后,利用得到的核糖体蛋白搜索微生物快速鉴别数据库(rapid microorganism identification database;http://rmidb.org)确定大肠杆菌归属。
1.3 模拟实际样本大肠杆菌O157:H7分析与鉴别
从超市中购买的碳酸饮料,加入活菌计数完毕的不同浓度的大肠杆菌O157:H7的菌悬液,然后利用NH2-Fe3O4磁性颗粒富集,MALDI MS检测,并利用数据库进行菌株鉴别。
2 结果与分析
2.1 NH2-Fe3O4磁性颗粒表征
NH2-Fe3O4磁性颗粒合成完毕后,分别利用扫描电镜、磁滞回线与红外光谱对磁性颗粒的形貌、磁性能力与官能团进行分析见图1。从电镜图上可以看出(图1),NH2-Fe3O4磁性颗粒成球形,其直径800 nm左右,其粒径较大,为了便于超声从菌体表面去除,以利于菌体检测。另外,在磁滞回线图上(图2),其磁化值分别为50emu/g,这非常便于磁球从溶液中分离。同时,从红外谱图上(图3),可以看到在620 cm-1和453 cm-1吸收峰对应为Fe-O键的振动吸收和1 630 cm-1处NH的弯曲振动,由红外光谱图可知,NH2-Fe3O4磁性颗粒被成功合成。

图1 NH2-Fe3O4颗粒扫描电镜Fig.1 Scanning electron microscopy of NH2-Fe3O4particles

图2 NH2-Fe3O4颗粒磁滞回线Fig.2 Hysteresis loop of NH2-Fe3O4particles
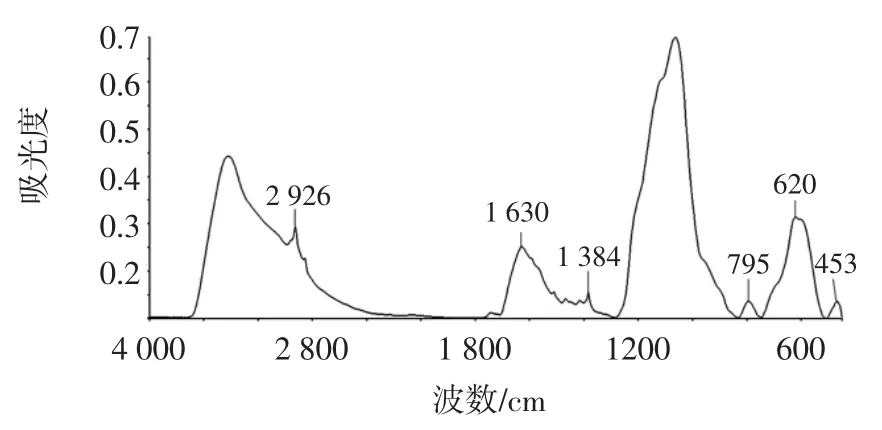
图3 NH2-Fe3O4颗粒红外谱图Fig.3 Infrared spectrum of NH2-Fe3O4particles
2.2 NH2-Fe3O4磁性颗粒对大肠杆菌O157:H7的富集
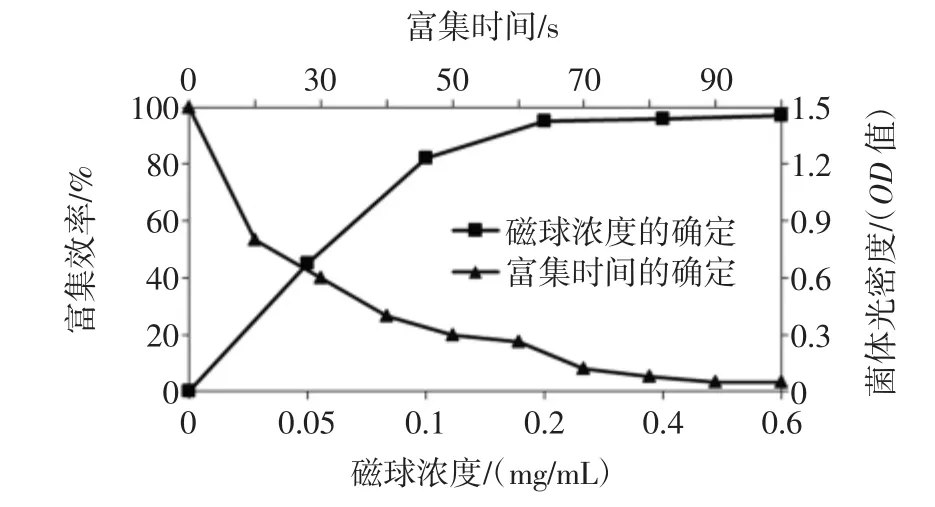
图4 NH2-Fe3O4磁性颗粒富集的优化Fig.4 Enrichment optimization of NH2-Fe3O4magnetic particle
由于细菌PBS缓冲液条件下带负电荷,而NH2-Fe3O4磁性颗粒的等电点为3,而使磁球带正电荷,因此磁球会很快吸附到菌体表面,在外加磁场的作用下,菌体会脱离水溶液,而得到富集。磁球富集条件的优化见图4。
从图4可以看出,当富集时间到达70 s时,菌体几乎100%得到富集。而磁球浓度为0.5 mg/mL时,磁球富集的效果最佳。因此,利用NH2-Fe3O4磁性颗粒富集大肠杆菌简单、快速,而且合成的成本很低。
2.3 MALDI/TOF MS对大肠杆菌O157:H7的检测限
通过NH2-Fe3O4磁性颗粒富集,使MALDI/TOF MS对低浓度细菌进行检测,不同细菌浓度的质谱图见图5,NH2-Fe3O4磁性颗粒富集效果的对比见图6。

图5 不同细菌浓度的质谱图Fig.5 Mass spectra of different bacterial concentrations

图6 NH2-Fe3O4磁性颗粒富集效果的对比Fig.6 Comparison of enrichment effects of NH2-Fe3O4magnetic particles
从图5可以看出,通过对大肠杆菌O157:H7一系列的稀释,富集后,当细菌浓度为3.5×102CFU/mL时(图5A),几乎没有质谱信号,而当细菌浓度达到3.5×103CFU/mL时(图5B),有清晰的质谱信号,而主要的质谱峰与细菌浓度在3.5×104CFU/mL时几乎无异(图5C),同时这些质谱的信噪比超过5,因此MALDI/TOF MS对大肠杆菌O157:H7的检测限达到3.5×103CFU/mL。
另外,通过对比未富集的大肠杆菌O157:H7的质谱图可以看出(图6),在细菌浓度为3.5×104CFU/mL时,未富集的质谱在大于5 000 m/z以上,未有质谱峰出现,而富集后,质谱峰数量大大增加,因此,通过NH2-Fe3O4磁性颗粒的富集,可以大大提高MALDI/TOF MS的检测能力。
2.4 模拟实际样本中大肠杆菌MALDI/TOF MS检测与鉴别
本文采用的模拟实际样本为超市购买的碳酸饮料,通过添加不同浓度的大肠杆菌O157:H7,然后利用NH2-Fe3O4磁性颗粒富集及MALDI/TOF MS对大肠杆菌O157:H7进行检测,由于实际样本中成分比较复杂,饮料中的阳离子会压制质谱信号,通过一系列不同菌浓的检测,发现细菌浓度在8×103CFU/mL得到的谱图可以用于菌株的鉴别,细菌浓度在8×103CFU/mL,MAL DI/TOF MS对大肠杆菌O157:H7的质谱图见图7。
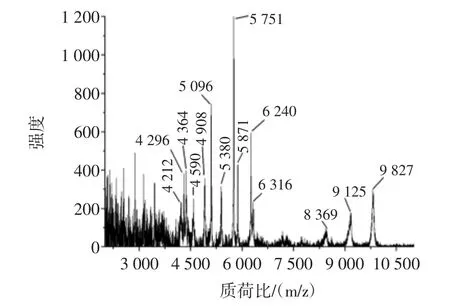
图7 MALDI/TOF MS对实际样本中大肠杆菌O157:H7检测Fig.7 Detection of Escherichia coli O157:H7 in real samples using MALDI/TOF MS
为了利用质谱对大肠杆菌O157:H7进行鉴别,对质谱图进行处理包括基线校正、平滑,选取信噪比大于5的14个质谱峰作为菌株鉴别的依据,这些质谱峰通过搜索UniProtKB/Swiss-Prot和UniProtKB/TrEMBL的蛋白数据库,最终确定14个质谱峰蛋白归属,每个质谱峰的蛋白搜索结果见表1。
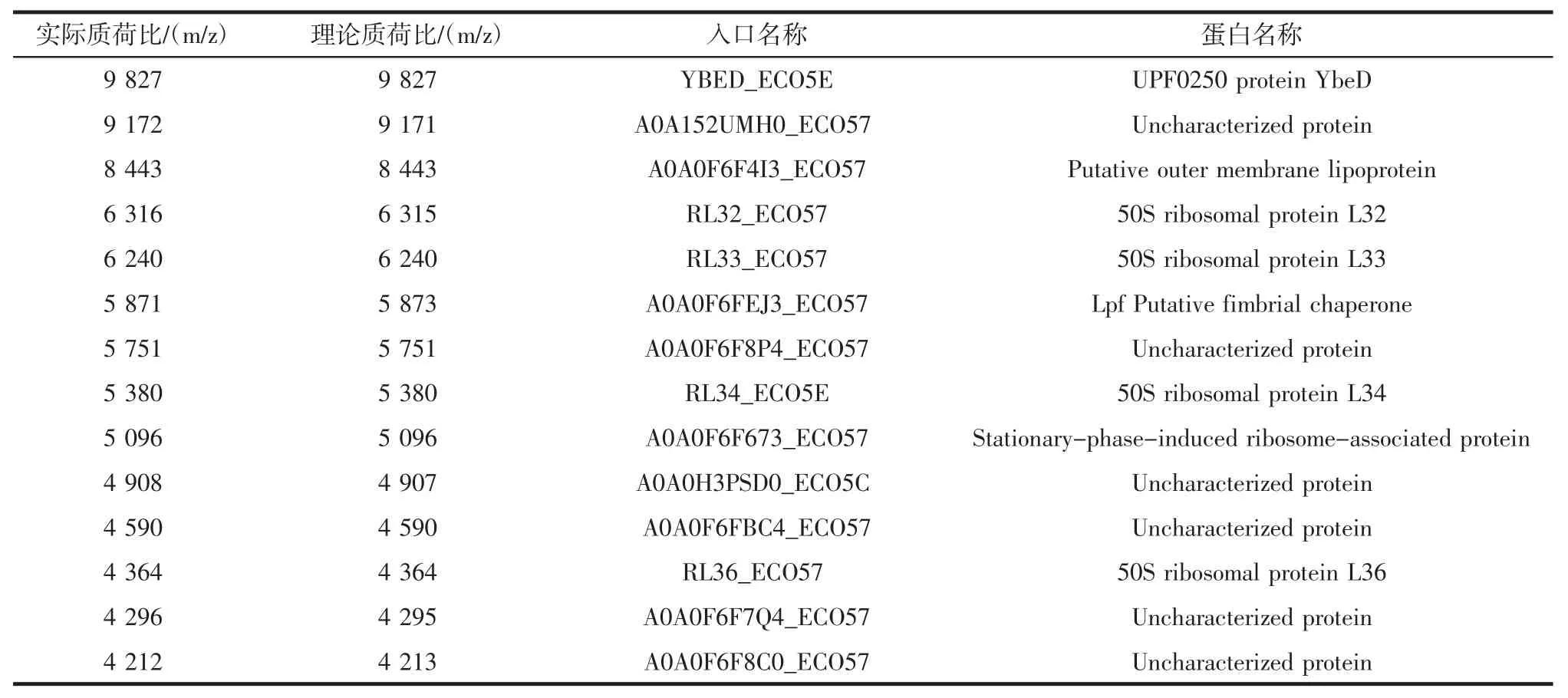
表1 大肠杆菌O157:H7蛋白Swiss-Prot/TrEMBL数据库搜索结果Table 1 Search results of Escherichia coli O157:H7 protein in Swiss-Prot/TrEMBL database
这其中共有4个核糖体蛋白被发现,分别是核糖体大亚基的L32、L33、L34、L36 4种蛋白,由于核糖体蛋白具有保守性,通过输入4种核糖体蛋白的质谱峰,搜索核糖体蛋白数据库可以对菌株进行鉴别,其鉴别结果为大肠杆菌O157:H7。
3 结论
本文合成了NH2-Fe3O4磁性颗粒,并利用扫描电镜、磁滞回线和红外光谱对其进行表征,表征结果证明NH2-Fe3O4磁性颗粒被成功合成,并具有很强的磁性。然后优化了NH2-Fe3O4磁性颗粒富集大肠杆菌O157:H7富集条件。并通过富集,得到MALDI/TOF MS对大肠杆菌O157:H7的检测限为3.5×103CFU/mL。最后,通过模拟实际样本对该方法进行验证,发现该方法对碳酸饮料中的大肠杆菌O157:H7的检测限为8.0×104CFU/mL,并利用蛋白数据库通过4种核糖体蛋白的搜索,证明该菌为大肠杆菌O157:H7。因此,试验数据证明该方法简单、快速、成本低,可以用于细菌的分析鉴别。
[1]Hotta Y,Sato J,Sato H,et al.Classification of the genus Bacillus based on MALDI-TOF MS analysis of ribosomal proteins coded in S10 and spc operons[J].Journal of agricultural and food chemistry,2011,59(10):5222-5230
[2]Rezzonico F,Vogel G,Duffy B,et al.Application of whole-cell matrix-assisted laser desorption ionization-time of flight mass spectrometry for rapid identification and clustering analysis of Pantoea species[J].Applied and environmental microbiology,2010,76(13):4497-4509
[3]Sandrin T R,Goldstein J E,Schumaker S.MALDI TOF MS profiling of bacteria at the strain level:a review[J].Mass spectrometry reviews,2013,32(3):188-217
[4]Arnold R J,Reilly J P.Fingerprint matching of E.coli strains with matrix-assisted laser desorption/ionization time-of-flight mass spectrometry of whole cells using a modified correlation approach[J].RapidCommunicationsinMassSpectrometry,1998,12(10):630-636
[5]Tanigawa K,Kawabata H,Watanabe K.Identification and typing of Lactococcus lactis by matrix-assisted laser desorption ionizationtime of flight mass spectrometry[J].Applied and environmental microbiology,2010,76(12):4055-4062
[6]Zhao X-J,Hilliard L R,Tan W-H,et al.A rapid bioassay for single bacterial cell quantitation using bioconjugated nanoparticles[J].Proc.Natl.Acad.Sci.U S A,2004,101:15027-15032
[7]Ryan S,Kell A J,Tanha J,et al.Single-domain antibody-nanoparticles:promising architectures for increased staphylococcus aureus detection specificity and sensitivity[J].Bioconjugate Chem,2009,20:1966-1974
[8]HoK-C,Tsai P-J,Lin Y-S,et al.Using biofunctionalized nanoparticles to probe pathogenic bacteria[J].Anal Chem,2004,76:7162-7168
[9]Torres-ChavollaE,Alocilja E C.Aptasensors for detection of microbialandviralpathogens[J].BiosensBioelectron,2009,24:3175-3182
[10]Liu J-C,Tsai P-J,LeeY C,et al.Affinity capture of uropathogenic escherichia coli using pigeon ovalbumin-bound Fe3O4@Al2O3magnetic nanoparticles[J].Anal Chem,2008,80:5425-5432
[11]El-Boubbou K,Gruden C,Huang X-F.Magnetic glyco-nanoparticles:a unique tool for rapid pathogen detection,decontamination,andstraindifferentiation[J].JAmChemSoc,2007,129:13392-13393
[12]Fan G,Ren Y,Jiang W,et al.Effective catalytic hydrodechlorination of 4-chlorophenol over a Rh immobilized on amine-functionalized magnetite nanoparticles in aqueous phase[J].Catalysis Communications,2014,52:22-25

