氰化物污染土壤微生物修复方法初步研究
房彬 ,张建 ,薛二军 ,王连杰 ,刘建阔 , 张慧
(1.天津大学环境科学与工程学院,天津300350;
2.天津创业环保集团股份有限公司,天津300381;3.山东创业环保科技发展有限公司,山东临沂276400)
伴随氰化物大规模应用而来的土壤氰化物污染问题,已成为当今重大社会关切。氰化物在土壤中自然降解速率大大慢于天然水体中的降解速率,超过土壤净化能力的氰化物在土壤中残留、蓄积和运移,成为环境的二次污染源,对水体、粮食生产及人类健康长期存在潜在危害,迫切需要修复治理。当前,对含氰废水的化学和生物方法处理已多有报道[1],含氰土壤的修复方法主要有植物修复和化学修复[2,3],而利用微生物手段修复氰化物污染土壤却鲜有报道。研究通过为氰化物污染土壤生物修复筛选菌种资源,评估修复效果,尝试为氰化物修复提供了经济有效的新思路,为优化氰化物污染微生物修复工艺提供理论依据。
1 材料与方法
1.1 氰化物污染土壤室内修复试验
供试土壤取自天津港某危化品仓库周边,取样深度为0~30 cm,把采集来的土样尽快混匀,避光风干,去除杂质,粉碎,研磨到全部过孔径18目筛。设置添加菌剂的修复处理和相应不添加菌剂的对照处理:修复处理加入氰化物污染土壤样品200 g,10%的比例接种混合降解菌,使用移液枪移取高纯水至土壤含水量达到20%,搅拌均匀,称重以便后期补水。对照处理不接种降解菌,含水量同样调节至20%。将装有污染土壤的培养烧杯在25℃人工气候箱内持续培养,根据失水量,每1 d补水并搅拌一次。
1.2 总氰化物测定
氰化物含量分析采用新鲜土样,分光光度法测定[4]。
1.3 氰化物降解菌群驯化,鉴定及菌液配置
本研究组前期从铁蓝涂料的生产废水中筛选驯化得到高效降氰菌群,具体步骤包括废水水样稀释;涂布法分离纯化耐氰菌种;不同浓度KCN培养基驯化耐氰细菌。根据形态特征和生理生化特点,利用分子生物技术分析其群落结构。根据试验用接种量将选择优化出的菌群进行放大培养,配制成菌液制剂。
2 结果与讨论
2.1 菌群对氰化物降解作用研究
将菌悬液按10%量接种到氰化物污染土壤,在试验的 0,1,2,3,8 d 分别在试验组和对照组取土壤测试。最初接种24 h内,降氰菌发挥降氰作用较为迅速,延滞期较短,氰化物降解率达到26.9%,之后降解率增加缓慢,并趋于稳定,第8 d累计降解率为33.3%(表1,图1)。生物修复效果取决于生理和代谢中有能力在受污染环境中降解污染物微生物的存在;一方面,营养物质对本研究降氰菌的生物降解产生了影响,另一方面,降氰菌群在培养条件下失去了竞争优势也是可能的原因。而对照区反映了没有添加任何物质土壤中氰化物含量变化,累计去除率在4%左右,说明在自然条件下土壤中氰化物降解是缓慢的,这和李社红等人[5]的研究结论相符。
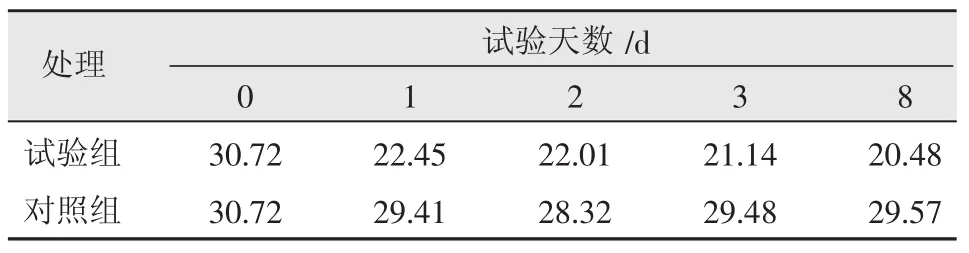
表1 不同处理土壤氰化物质量分数随时间变化 mg/kg

图1 不同处理土壤氰化物降解率随时间变化
2.2 降氰菌的筛选、驯化及生物学分类地位的确定
为进一步提升菌群对氰化物的去除效果,利用分子生物技术分析其群落结构。结果表明,该菌群包括2种酵母菌(图2a)和8种细菌(图2b),其中细菌为水谷鞘氨醇杆菌(Sphingobacterium mizutaii)、苍白杆菌属(Ochrobactrum sp.)、恶 臭假单胞菌(Pseudomonas putida)、产酸克雷伯菌(Klebsiella oxytoca)、产碱杆菌属(Alcaligenes sp.)、无色杆菌属(Achromobacter sp.)、类杆菌属(Bacteroides sp.)和沙雷氏菌属(Serratia sp.)。Sphingobacterium mizutaii所占比例最高,达 61%,为该菌群的优势菌种。另外,菌种Ochrobactrum sp.,Pseudomonas putida和Klebsiella oxytoca在菌群中所占比例为8%~10%,属于污水生物处理过程的中常见菌株,能够降解包括喹啉在内的多种芳香烃化合物。Alcaligenes sp.,Achromobacter sp.,Bacteroides sp. 和Serratia sp.在菌群中所占比例较低,仅为2%~3%,其中菌Alcaligenes sp.据报道可分泌中降氰酶[6],能够将氰化物降解为NH3,而Bacteroides sp.和Serratia sp.对铬、锰等重金属离子具有较强的耐受能力。此外该菌群中还包含两种真核生物酵母菌,其中毛孢子菌属(Trichosporon)在含氰废水处理过程有过相关的应用报道[7]。
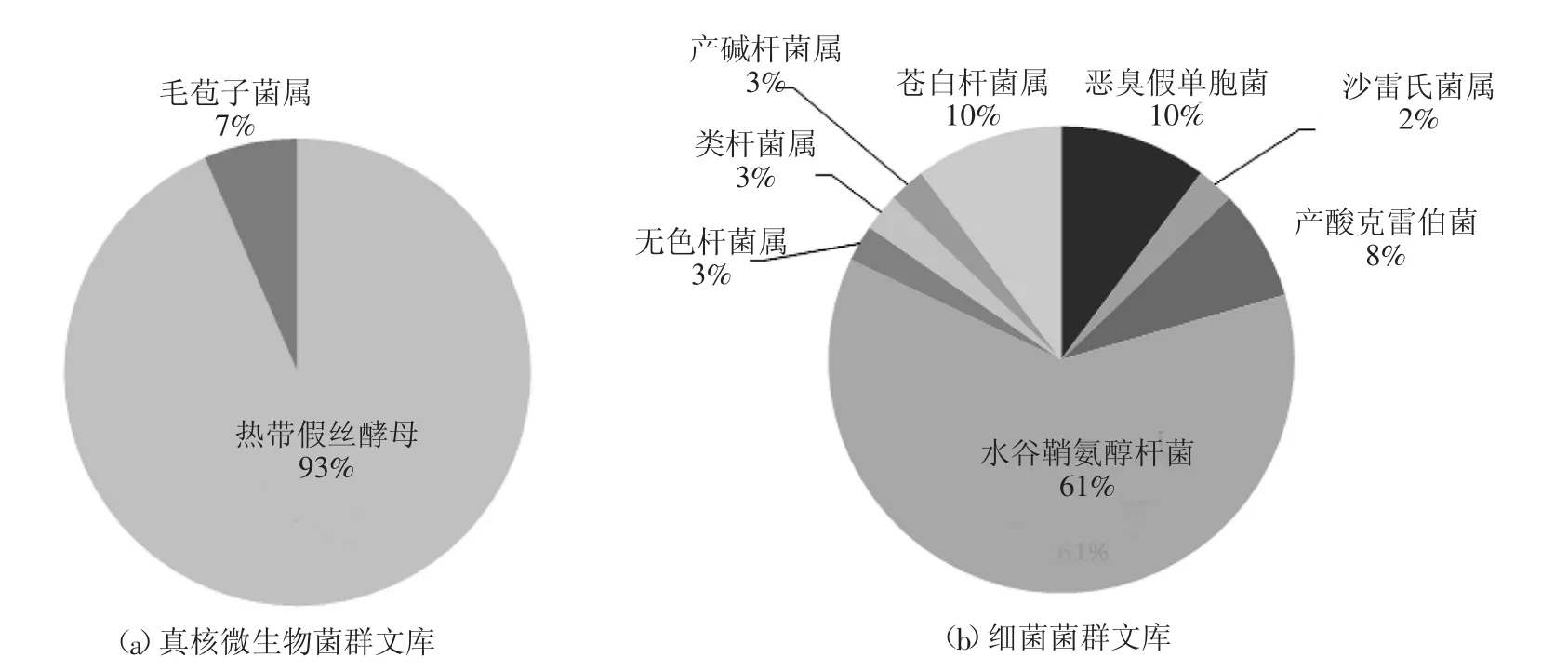
图2 氰降解菌群群落结构组成
3 结论
试验对铁蓝涂料的生产过程含氰废水进行菌群分离、驯化,最终确定细菌类的水谷鞘氨醇杆菌(Sphingobacterium mizutaii)、苍白杆菌属(Ochrobactrum sp.)、恶臭假单胞菌(Pseudomonas putida)和真菌类的毛孢子菌属(Trichosporon)、热带假丝酵母(Candida tropicalis)等菌群。对这些菌群进行放大培养,进行氰化物污染土壤修复试验研究。经过8 d微生物修复试验,土壤中的氰化物累计降解率达到33.3%,而对照区土壤中人为添加的氰化物含量变化不大,累计去除率在4%左右,说明在自然条件下土壤中氰化物降解是缓慢的。开展对土壤温度、水分、氧和营养物质等环境因素的调控作用研究,提高土壤氰化物降氰效率,是今后研究工作开展的重点。
[1] 张建,王万超,李玉庆,等.工业废水中氰化物的生物去除技术研究进展[J].安徽农业科学,2015,43(17):275-278.
[2] Kang D-H,Hong L Y,Schwab A P,et al.Removal of Prussian blue from contaminated soilin the rhizosphere of cyanogenic plants[J].Chemosphere,2007,69(9):1 492-1 498.
[3] 于晓章.氰化物污染的植物修复可行性研究[J].生态科学,2004,23(2):97-100.
[4]国家环境保护部.土壤氰化物和总氰化物的测定分光光度法:HJ745-2015[S].北京:中国环境科学出版社,2015.
[5] 李社红,郑宝山,朱建明,等.金矿尾矿渣及其污染土壤中氰化物的分布及自然降解[J].环境科学,2001,22(3):126-128.
[6]Dubey S,Holmes D.Biological cyanide destruction mediated by microorganisms[J].World Journal of Microbiology and Biotechnology,1995,11(3):257-265.
[7] 秦胜东,郭嘉 ,刘玉存,等.固定化微生物技术研究进展及其在水处理中的应用[J].水处理技术,2014(10):003.

