施氮量对间作小麦蚕豆根系分泌大豆异黄酮的影响*
刘英超, 肖靖秀, 汤 利, 郑 毅,2**
(1. 云南农业大学资源与环境学院 昆明 650201; 2. 云南省教育厅 昆明 650223)
植物根系作为植物体的吸收和代谢器官, 对于外界环境条件反应非常敏感[1]。大量研究表明, 植物根系及其分泌物质在植物营养和病害调控方面具有十分重要的作用[2-3]。因此, 根系分泌物的研究一直为人们关注的热点。
近年来, 关于根系分泌物在轮作、间作等种植体系中的作用, 国内外已有大量的研究和报道。而黄酮类根系分泌物质作为被根瘤菌感知的初始信号,在豆科作物结瘤过程中起关键作用[4]。关于豆科植物根系分泌的黄酮类物质的发现主要集中在单作大豆(Glycine max)、苜蓿(Medicagosativa)、豌豆(Pisum sativum)和木豆(Cajanus cajan)上, 并且在这些豆科作物根系分泌物中先后发现了柑桔素、圣草酚、芹菜素、毛地黄黄酮、槲皮黄酮等黄酮类物质[5-8]。大豆异黄酮作为植物根系分泌的一种普遍的黄酮类物质, 有报道称该物质具有抗溶血、抗氧化、诱导大豆结瘤、抗病原菌生长等生理活性, 在植物体内可作为保护性物质保护植物正常生长, 抵制病虫侵害[9]。另外, 有研究表明, 大豆异黄酮是大豆根瘤菌结瘤基因的诱导物质[10], 并且还是大豆组织对疫霉根腐病菌侵染的反应物质[11]。但这些发现均是在单作条件下的研究结果, 间作种植尤其不同施氮水平下对黄酮类物质分泌的影响并不清楚。
小麦(Tricum aestivum)蚕豆(Vicia faba)间作是云南乃至西南地区重要的间作种植模式, 具有显著的增产[12]、控病优势[13], 是农民增产增收的重要手段之一[14]。前人的研究已经明确了小麦蚕豆间作系统中养分的吸收利用规律[15-16]、病害发生规律[17]、根际微生物的动态变化特征[18]、根际有机酸酚酸等的分泌特点[19], 表明间作对产量增加、病害控制和根际微生物的变化有重要影响, 对根系分泌物的变化有明显调节作用。但是间作对这种影响作用是否受到不同施氮水平的调控并不清楚。本研究以小麦蚕豆间作为研究对象, 利用高效液相色谱(HPLC)分析技术, 结合前人的小麦蚕豆根系分泌物研究结果,探讨不同时期不同氮水平条件下, 间作小麦和蚕豆根系分泌大豆异黄酮的动态变化及累积特征, 为进一步探明间作增产和控病机制提供依据。
1 材料与方法
1.1 供试材料与作物品种
盆栽试验于2014年10月—2015年5月在云南农业大学植物营养系温室内完成, 试验种植土取自云南农业大学后山红壤, 基本理化性质为: 碱解氮68 mg·kg-1, 速效磷 16 mg·kg-1, 速效钾 137 mg·kg-1,pH 6.08, 有机质28.07 mg·kg-1。试验所用盆钵大小为238 mm×320 mm, 每盆装土10 kg。
水培试验培养液采用莫拉德配方表(mol·L-1):K2SO40.75×10-3、MgSO40.65×10-3、KCl 0.1×10-3、Ca(NO3)22.0×10-3、KH2PO40.25×10-3、H3BO31.0×10-5、MnSO41.0×10-6、CuSO41.0×10-7、ZnSO41.0×10-6、(NH4)6Mo7O245.0×10-6和 Fe-EDTA 1.0×10-4。试验所用容器为容积3 L的PVC桶, 桶大小为160 mm×240 mm。
供试小麦品种为‘云麦 42’, 蚕豆品种为‘玉溪大粒豆’, 种子均由云南省农业科学研究院粮食作物研究所提供。
1.2 试验设计
小麦蚕豆间作试验采用盆栽和水培两种模式完成。试验设计为两因素试验。A为种植方式, 设小麦蚕豆、小麦单作、蚕豆单作3种种植模式; B为氮肥施用水平, 设低氮、常规氮(推荐)和高氮3种氮素供应水平。其中, 所有试验低氮处理均为推荐施氮量的一半, 高氮处理为推荐施氮量的1.5倍。盆栽和水培试验均为9个处理, 每个处理3次重复, 采样4次, 共计108桶。水培试验每盆移栽的幼苗为间作4株蚕豆、8株小麦, 单作8株蚕豆、16株小麦; 土培试验为间作6株蚕豆、12株小麦, 单作12株蚕豆、24株小麦, 均分2行种植。
所用肥料: 盆栽试验所用氮肥为尿素, 正常氮肥施用量为 150 mg·kg-1, 低氮用量为 75 mg·kg-1, 高氮用量为225 mg·kg-1; 磷肥品种为过磷酸钙, 施用量为100 mg·kg-1; 钾肥为硫酸钾 100 mg·kg-1。磷钾肥全部作为基肥一次性施入; 氮肥 1/2为基肥, 1/2为追肥,并于拔节期追施。氮肥追施时仅施用于间作处理的小麦一侧, 蚕豆均不施用追肥。水培试验所用氮肥为Ca(NO)3溶液, 其供应浓度为 2.0×10-3mol·L-1。幼苗期常规氮处理添加Ca(NO)3溶液50 mL, 低氮处理添加25 mL, 高氮处理添加75 mL, 并随生育期变化调整用量。
管理方式: 整个生长过程中, 单、间作小麦、蚕豆采用统一的肥水管理措施。盆栽试验每7 d浇水一次, 使土壤水分达到田间持水量的 70%; 水培试验营养液每3 d更换一次, 且营养液内保持通气, pH控制在6.80~6.95范围内。
1.3 样品收集
分别于出苗后60 d、95 d和131 d(小麦分别处于拔节期、开花期和灌浆期, 蚕豆分别处于分枝期、开花期和结荚期)采集植株样品, 收取根系分泌物。根系分泌物收集方法: 将盆栽和水培植株分别从培养容器中小心取出, 先用自来水反复冲洗植株根,后用蒸馏水冲洗3次, 冲洗后放入5%浓度百里酚溶液中浸泡 3 min, 取出后放入装有 500 mL 0.005 mol·L-1CaCl2溶液的收集袋中, 将袋子放入原生长容器中, 每次采样10:00开始, 通气收集根系分泌物2 h, 收集后将植株取出, 收集液整理后存放在–20 ℃冰箱冷冻备用[19]。将成熟期植株样品收集后烘干称重, 测定作物产量。
1.4 样品处理与测定
将收集的根系分泌物解冻后用滤纸过滤, 分别用200 mL、100 mL、50 mL乙酸乙酯萃取过滤液3次, 将 3次萃取液混匀后倒入旋转蒸发仪中蒸发浓缩, 浓缩液用甲醇冲洗并定容至10 mL备用。将准备好的10 mL样品过0.45 μm滤膜后放入HPLC中测定大豆异黄酮含量。
试验所用色谱柱为 Synergi 4u Hydro-RP 80A(250 mm×4.6 mm ID), 测定流动相A为色谱纯甲醇, B为超纯水, 洗脱条件为: A 30%~40%(5 min)→40%~60%(10 min)→60%~90%(25 min)→90% (29 min)→90%~30%(34 min)→30%(37 min)→ 停 止 洗 脱(37 min)。液相色谱测定条件: 波长 270 nm、柱温30 ℃、流速0.9 mL·min-1, 在选定的色谱条件下, 得到大豆异黄酮(1 000 ng·mL-1)的混合标准品及待测样品的色谱图[20]。检测限为10 ng·mL-1, 根据保留时间来确定目标黄酮, 通过外标法计算出大豆异黄酮含量。
1.5 数据处理
数据采用Microsoft Excel 2010软件进行处理和绘图, 采用 SPSS 19.0统计分析软件对数据进行差异显著性检验(Duncan 法,α=0.05)。
2 结果与分析
2.1 施氮量对间作小麦蚕豆籽粒产量的影响
试验结果表明(表1), 随施氮量增加, 小麦蚕豆籽粒产量均明显增加。与低氮处理相比, 盆栽试验中, 常规氮和高氮小麦籽粒产量分别显著增加29.3%和 50.4%, 蚕豆籽粒产量分别显著增加 27.2%和 37.2%; 水培试验中, 常规氮和高氮小麦籽粒产量分别显著提高17.6%和29.0%, 蚕豆籽粒产量分别显著提高15.4%和21.0%。
试验结果还表明(表1), 相同氮水平下, 间作明显促进作物籽粒产量增加, 但增加量随施氮量增加而减少。盆栽试验中, 不同氮水平下(N/2、N、3N/2),间作小麦籽粒产量相对于单作分别增加 20.9%~43.4%, 间作蚕豆籽粒产量相对于单作分别增加13.5%~32.3%。水培试验中, 不同氮水平下(N/2、N、3N/2), 间作小麦籽粒产量相对于单作分别增加14.3%~17.3%, 间作蚕豆籽粒产量相对于单作分别增加6.7%~13.6%。
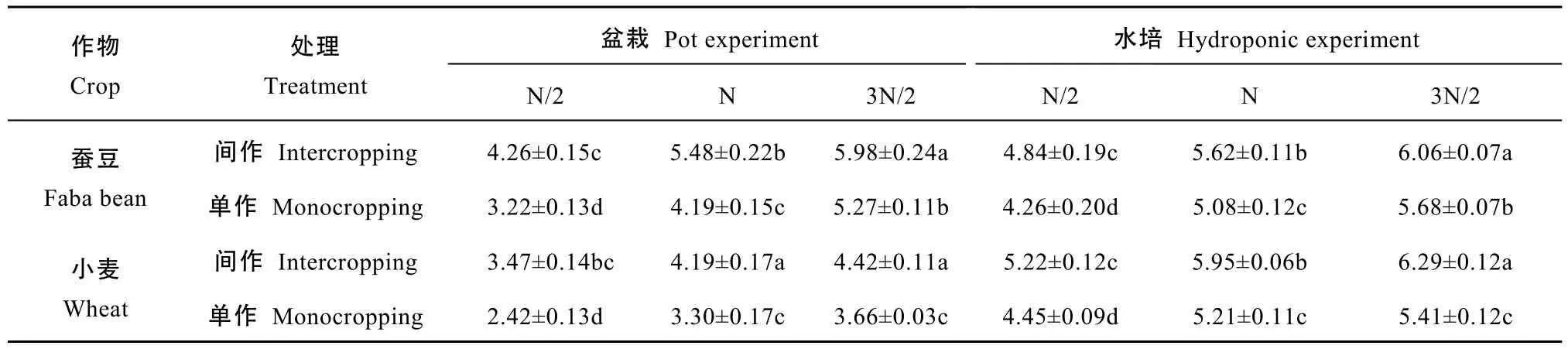
表1 不同施氮量对小麦蚕豆间作系统籽粒产量的影响Table 1 Grain yields of wheat and faba bean intercropping system under different nitrogen application rates g·plant-1
2.2 施氮量对间作小麦根系分泌大豆异黄酮的影响
由表2可以看出, 随着作物生育期的推移, 小麦根系分泌大豆异黄酮数量明显减少; 盆栽试验中,高氮条件下, 小麦灌浆期(出苗后131 d)根系分泌物中未检测出大豆异黄酮; 水培试验中, 常规氮于小麦灌浆期(出苗后131 d)、高氮于开花期(出苗后95 d)后根系分泌物中未检测出大豆异黄酮。
由表2还可以看出, 同一生育时期, 随施氮量增加, 小麦根系分泌大豆异黄酮数量减少。盆栽试验中,与常规和高氮处理相比, 小麦拔节期(出苗后60 d), 低氮条件下, 间作小麦大豆异黄酮分泌量分别增加36.6%和 104.8%, 单作小麦大豆异黄酮分泌量分别增加18.1%和49.6%; 小麦开花期(出苗后95 d), 低氮条件下, 间作小麦大豆异黄酮分泌量分别增加 43.4%和75.9%, 单作小麦大豆异黄酮分泌量分别增加13.1%和15.5%。水培试验中, 小麦拔节期(出苗后 60 d), 与常规和高氮处理相比, 低氮条件下, 间作小麦大豆异黄酮分泌量分别增加 1.3%和 139.4%, 单作小麦大豆异黄酮分泌量分别增加39.8%和95.7%。
由表2还可以看出, 同一生育期内, 相同氮水平条件下, 间作提高了小麦根系分泌大豆异黄酮的数量。尤其低氮和常规氮条件下, 小麦拔节期(出苗后60 d), 与单作相比, 盆栽试验间作小麦根系分泌大豆异黄酮的量分别增加29.6%和12.0%, 水培试验间作小麦根系分泌大豆异黄酮的量分别增加 15.3%和59.2%; 高氮条件下, 两试验单、间作小麦根系分泌大豆异黄酮量差异性均不显著。小麦开花期(出苗后95 d), 除盆栽试验中低氮条件下间作小麦根系大豆异黄酮分泌量比单作提高 71.4%外, 其他供氮水平下单、间作差异不明显。
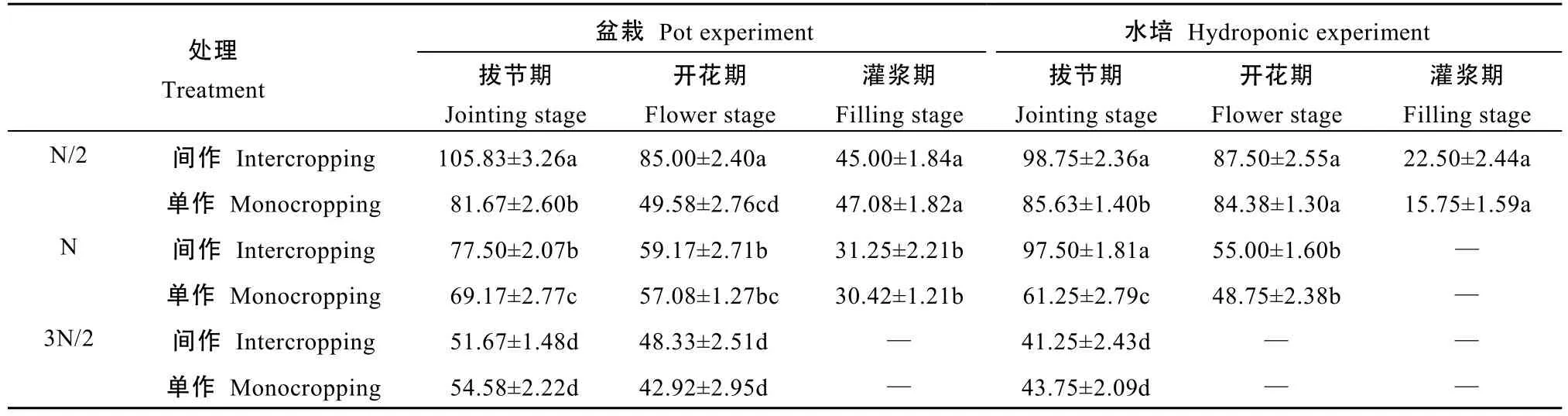
表2 不同施氮量对单、间作小麦不同生育期根系分泌大豆异黄酮的影响Table 2 Soy isoflavone secreted by mono- and inter-cropped wheat root under different N rates at different growth stages ng·plant-1·h-1
2.3 施氮量对间作蚕豆根系分泌大豆异黄酮的影响
PLS-EDA分析可以将抽象对象的集合分组成由性质相同的对象组成的多个类别, 可以更直观地显示各研究对象之间的远近关系。盆栽试验中,PLS-EDA分析表明(图1), 在PC1上, 单、间作蚕豆不同氮水平处理有很好地分离, 低氮处理单、间作蚕豆均分布在正方向上, 常规施肥和高氮处理单、间作蚕豆均分布在负方向上。在PC2上, 低氮处理单作蚕豆在负方向上, 而间作蚕豆在正方向上;常规施肥和高氮处理单、间作蚕豆差异不显著。说明相比于常规氮和高氮处理, 低氮条件蚕豆根系分泌物大豆异黄酮类物质更明显, 同时说明低氮条件下单、间作蚕豆分泌大豆异黄酮物质差异性显著。水培试验中, PLS-EDA分析表明(图1b),在 PC1上, 不同氮水平处理单、间作蚕豆也有很好分离, 低氮处理单作蚕豆在正方向上, 常规和高氮处理单作蚕豆在负方向上, 同时, 低氮和常规氮处理间作蚕豆也在正方向上, 高氮处理间作蚕豆在负方向上。说明无论是单作还是间作, 低氮处理与高氮均存在明显差异。PC2上, 低氮间作蚕豆在正方向上, 低氮单作蚕豆在负方向上。说明在 PC2方向上, 仅低氮条件下单、间作蚕豆处理存在差异。
进一步分析结果表明(图2), 随着生育期推移,蚕豆根系分泌大豆异黄酮数量先增加后减少, 蚕豆开花期(95 d)时, 两试验中分泌量均达到最大值; 不同的是, 盆栽试验中, 蚕豆分枝期(60 d)时, 分泌量最少, 水培试验中, 蚕豆结荚期(131 d)时, 分泌量最少。
图2结果还表明, 相同生育期内, 随施氮量的增加, 蚕豆根系大豆异黄酮的分泌量减少。盆栽试验中, 与常规和高氮处理相比, 蚕豆分枝期(60 d),低氮条件下间作蚕豆根系大豆异黄酮分泌量分别增加11%和40.7%, 单作蚕豆差异不明显; 蚕豆开花期(95 d), 低氮条件下间作蚕豆根系大豆异黄酮分泌量分别增加 39.5%和 154.4%, 单作蚕豆分别增加16.3%和 37.4%; 蚕豆结荚期(131 d), 常规氮量和高氮条件下间作蚕豆根系大豆异黄酮分泌量分别增加27.6%和 188.4%, 单作蚕豆分别增加 34.9%和56.8%。水培试验中, 与常规和高氮条件相比, 蚕豆分枝期(60 d), 低氮条件下间作蚕豆根系大豆异黄酮分泌量分别增加50.3%和66.3%, 单作蚕豆差异不明显; 蚕豆开花期(95 d), 常规氮量和高氮条件下间作蚕豆根系大豆异黄酮分泌量分别增加 37.4%和94.4%, 单作蚕豆分别增加 69.7%和 97.1%; 蚕豆结荚期(131 d), 常规氮量和高氮条件下间作蚕豆根系大豆异黄酮分泌量分别增加52.8%和58.5%, 单作蚕豆分别增加72.7%和94.5%。
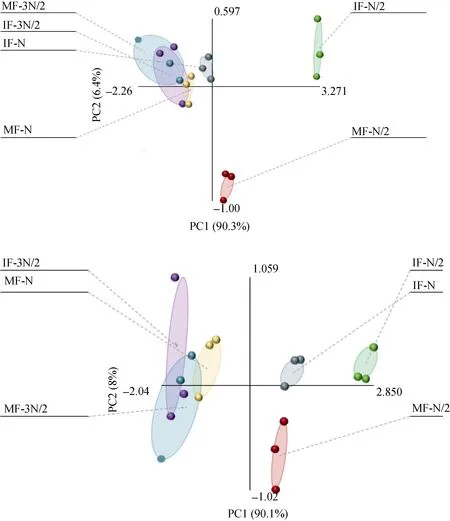
图1 盆栽(a)和水培(b)试验不同氮水平下单、间作蚕豆根系分泌大豆异黄酮PLS-EDA分析Fig. 1 PLS-EDA analysis of soy isoflavone secreted by mono- and inter-cropped faba bean root under different N rates in pot experiment (a) and hydroponic experiment (b)
图2结果还表明, 同一生育期内, 低氮和常规氮条件下, 间作蚕豆根系分泌大豆异黄酮数量明显高于单作。盆栽试验中, 与单作蚕豆相比, 蚕豆分枝期(60 d), 低氮和常规氮条件下, 间作蚕豆根系大豆异黄酮分泌量分别增加64.6%和11.4%, 蚕豆开花期(95 d), 低氮和常规氮条件下, 间作蚕豆根系大豆异黄酮分泌量分别增加 29.9%和 9.9%; 蚕豆结荚期(131 d),低氮条件下, 间作蚕豆根系大豆异黄酮分泌量增加18%。水培试验中, 与单作蚕豆相比, 低氮和常规氮条件下, 蚕豆分枝期(60 d), 间作蚕豆根系大豆异黄酮分泌量分别增加23.8%和14.1%, 开花期(95 d)分别增加 49.6%和 82%, 结荚期(131 d)分别增加 14%和-0.3%。试验中, 不同生育期内, 高氮条件下, 单、间作蚕豆根系大豆异黄酮分泌量差异不显著。
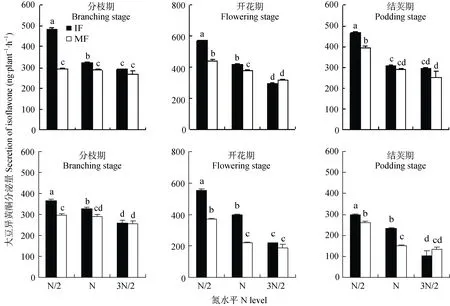
图2 盆栽(上)和水培(下)试验不同氮水平下单、间作蚕豆根系分泌大豆异黄酮的差异Fig. 2 Soy isoflavone secreted by mono- and inter-cropped faba bean root under different N rates in pot experiment (upper) andhydroponic experiment at different growth stages (lower)
3 讨论
已有研究表明, 不施氮肥或者氮肥施用量较低(50 kg·hm-2)时, ‘岷山红三叶’(Trifoliumpratense)不同生育期异黄酮含量均较高; 随着施肥量增加, 异黄酮含量降低[21-22]。本试验研究具有与之相类似结果。不同生育期, 随施氮量增加, 小麦、蚕豆根系大豆异黄酮分泌量均明显减少, 作物生长95 d和131 d时, 小麦高氮条件下未检测出大豆异黄酮。这可能是因为大豆异黄酮作为根瘤菌结瘤基因的诱导物质,低氮条件下, 为满足正常的生理和生长需要, 作物大量固定氮素, 根系大量分泌大豆异黄酮类诱导物质, 刺激根瘤菌结瘤固氮; 常规施肥和高氮条件下,氮素能满足作物的生长需求, 作为调节结瘤固氮的诱导物质, 大豆异黄酮的分泌量也较少。
卢国理等[23]研究表明, 与单作相比, 杂交稻‘合系-41’与‘黄壳糯’间作可以显著增加‘黄壳糯’叶片的类黄酮含量, 且增幅随生育期延迟而提高、随施氮量增加而降低。本试验结果表明, 间作可以显著提高作物大豆异黄酮的分泌量, 但这种间作优势仅在低氮和常规氮处理下明显, 高氮处理下, 单、间作小麦和蚕豆根系分泌大豆异黄酮数量差异不显著, 并且这种间作效应会随生育期的推移逐渐消失。
从本试验结果来看, 小麦根系分泌大豆异黄酮的最大量是拔节期(60 d), 并随生育期的推移逐渐减少, 小麦灌浆期(131 d)分泌量最少, 且高氮条件下,小麦根系未检测出大豆异黄酮的分泌; 与之不同的是, 随生育期的推移, 蚕豆根系大豆异黄酮的分泌先增加后减少, 蚕豆开花期(95 d)根系大豆异黄酮的分泌达到最大量。本试验结果可以部分解释间作小麦蚕豆根系大豆异黄酮分泌量的互补作用, 小麦分蘖至拔节期(60 d)时, 根系大量分泌大豆异黄酮等黄酮类物质, 但小麦为禾本科作物, 自身不具有结瘤固氮的功能, 与蚕豆互作后, 根系分泌物质移动并刺激相邻作物, 诱导蚕豆根系大豆异黄酮的分泌并结瘤固氮; 蚕豆开花期(95 d)时, 根系分泌的大豆异黄酮等黄酮类物质增加, 刺激蚕豆周围根瘤菌的活化[24], 进而促进蚕豆结瘤固氮, 而相邻的小麦根系大豆异黄酮的分泌量逐渐减少; 至蚕豆生长结荚鼓粒期(131 d)时, 结瘤固氮作用已经完成, 小麦蚕豆根系大豆异黄酮的分泌量均减少。
综上所述, 本研究中, 从研究方法来看, 土培和水培试验中, 作物根系分泌物的收集均采用取出植株样品后放入收集液中定时采集, 样品采集过程中会存在一定人为因素的影响, 故两个试验结果存在一定偏差。但目前尚无更为精准的根系分泌物收集方法, 在今后的根际研究中, 应采用更为准确的根系分泌物采样方法, 以便更好地进行根际研究。从本研究结果来看, 间作种植方式和氮肥施用量均影响小麦和蚕豆根系大豆异黄酮的分泌, 进而影响结瘤固氮, 最终影响产量的变化, 但其中相互影响机理及对蚕豆结瘤固氮的影响过程仍需进一步研究和探讨。
4 结论
小麦与蚕豆籽粒产量均随施氮量增加而增加,与单作相比, 间作提高了作物籽粒产量。间作种植方式和氮肥施用量均影响小麦和蚕豆根系分泌大豆异黄酮的数量。随施氮量增加, 小麦蚕豆大豆异黄酮的分泌量均减少; 试验中, 高氮条件下, 小麦生育后期(131 d)根系未检测出大豆异黄酮。低氮和常规氮条件下, 小麦拔节期(出苗后 60 d)和开花期(出苗后95 d), 间作根系分泌大豆异黄酮的量分别高于单作22.5%、35.6%和28.8%、7.9%; 蚕豆分枝期(出苗后60 d)、开花期(出苗后95 d)和结荚期(出苗后131 d), 间作根系大豆异黄酮分泌量分别增加 44.2%、12.8%, 39.8%、46.0%和16.0%、27.0%; 高氮条件下单、间作差异均不显著, 且这种间作效应随生育期推移逐渐不明显。
参考文献 References
[1]董艳, 董坤, 汤利, 等. 蚕豆根系分泌物中氨基酸含量与枯萎病的关系[J]. 土壤学报, 2015, 52(4): 919–925 DONG Y, DONG K, TANG L, et al. Relationship of free amino acids in root exudates with wilt disease (Fusarium oxysporum) of faba bean[J]. Acta Pedologica Sinica, 2015, 52(4):919–925
[2]FAN F L, ZHANG F S, SONG Y N, et al. Nitrogen fixation of faba bean (Vicia fabaL.) interacting with a non-legume in two contrasting intercropping systems[J]. Plant and Soil, 2006,283(1/2): 275–286
[3]刘晓燕, 何萍, 金继运. 氯化钾对玉米根系糖和酚酸分泌的影响及其与茎腐病菌生长的关系[J]. 植物营养与肥料学报, 2008, 14(5): 929–934 LIU X Y, HE P, JIN J Y. Effect of potassium chloride on the exudation of sugars and phenolic acids by maize root and its relation to growth of stalk rot pathogen[J]. Plant Nutrition and Fertilizer Science, 2008, 14(5): 929–934
[4]MAJ D, WIELBO J, MAREK-KOZACZUK M, et al. Response to flavonoids as a factor influencing competitiveness and symbiotic activity ofRhizobium leguminosarum[J]. Microbiological Research, 2010, 165(1): 50–60
[5]LI L, LI S M, SUN J H, et al. Diversity enhances agricultural productivity via rhizosphere phosphorus facilitation on phosphorus-deficient soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007,104(27): 11192–11196
[6]NOVÁK K, CHOVANEC P, ŠKRDLETA V, et al. Effect of exogenous flavonoids on nodulation of pea (Pisum sativumL.)[J].Journal of Experimental Botany, 2002, 53(375): 1735–1745
[7]LI B, KRUMBEIN A, NEUGART S, et al. Mixed cropping with maize combined with moderate UV-B radiations lead to enhanced flavonoid production and root growth in faba bean[J]. Journal of Plant Interactions, 2012, 7(4): 333–340
[8]NEUMANN G, RÖMHELD V. The release of root exudates as affected by the plant physiological status[M]//PINTON R,VARANINI Z, NANNIPIERI P. The Rhizosphere: Biochemistry and Organic Substances at the Soil-Plant Interface. 2nd ed. Boca Raton, FL, USA: CRC Press, 2007
[9]LANDINI S, GRAHAM M Y, GRAHAM T L. Lactofen induces isoflavone accumulation and glyceollin elicitation competency in soybean[J]. Phytochemistry, 2003, 62(6):865–874
[10]DELMONTE P, PERRY J, RADER J I. Determination of isoflavones in dietary supplements containing soy, red clover and kudzu: Extraction followed by basic or acid hydrolysis[J].Journal of Chromatography A, 2006, 1107(1/2): 59–69
[11]高荣海, 张春红, 赵秀红, 等. 大豆异黄酮研究进展[J]. 粮食与油脂, 2009, (5): 1–4 GAO R H, ZHANG C H, ZHAO X H, et al. Research progress on soybean isoflavone[J]. Cereals & Oils, 2009, (5): 1–4
[12]冯晓敏, 杨永, 任长忠, 等. 豆科-燕麦间作对作物光合特性及籽粒产量的影响[J]. 作物学报, 2015, 41(9): 1426–1434 FENG X M, YANG Y, REN C Z, et al. Effects of legumes intercropping with oat on photosynthesis characteristics of and grain yield[J]. Acta Agronomica Sinica, 2015, 41(9):1426–1434
[13]吴娜, 刘晓侠, 刘吉利, 等. 马铃薯/燕麦间作对马铃薯光合特性与产量的影响[J]. 草业学报, 2015, 24(8): 65–72 WU N, LIU X X, LIU J L, et al. Effect of intercropping potatoes with oats on the photosynthetic characteristics and yield of potato[J]. Acta Prataculturae Sinica, 2015, 24(8): 65–72
[14]张雷昌, 汤利, 郑毅. 根系互作对玉米大豆间作作物磷吸收的影响[J]. 植物营养与肥料学报, 2015, 21(5): 1142–1149 ZHANG L C, TANG L, ZHENG Y. Phosphorus absorption of crops affected by root interaction in maize and soybean intercropping system[J]. Journal of Plant Nutrition and Fertilizer,2015, 21(5): 1142–1149
[15]HAUGGAARD-NIELSEN H, GOODING M, AMBUS P, et al.Pea-barley intercropping for efficient symbiotic N2-fixation,soil N acquisition and use of other nutrients in European organic cropping systems[J]. Field Crops Research, 2009,113(1): 64–71
[16]LI X P, MU Y H, CHENG Y B, et al. Effects of intercropping sugarcane and soybean on growth, rhizosphere soil microbes,nitrogen and phosphorus availability[J]. Acta Physiologiae Plantarum, 2013, 35(4): 1113–1119
[17]WADDINGTON S R, MEKURIA M, SIZIBA S, et al.Long-term yield sustainability and financial returns from grain legume-maize intercrops on a sandy soil in subhumid North Central Zimbabwe[J]. Experimental Agriculture, 2007,43(4): 489–503
[18]WANG D, YANG S M, TANG F, et al. Symbiosis specificity in the legume-rhizobial mutualism[J]. Cellular Microbiology,2012, 14(3): 334–342
[19]肖靖秀, 郑毅, 汤利. 小麦–蚕豆间作对根系分泌低分子量有机酸的影响[J]. 应用生态学报, 2014, 25(6): 1739–1744 XIAO J X, ZHENG Y, TANG L. Effect of wheat and faba bean intercropping on root exudation of low molecular weight organic acids[J]. Chinese Journal of Applied Ecology, 2014,25(6): 1739–1744
[20]刘英超, 肖靖秀, 汤利, 等. 施氮对不同分隔方式间作蚕豆根系分泌柚皮素的影响[J]. 植物生理学报, 2017, 53(6):1097–1103 LIU Y C, XIAO J X, TANG L, et al. Effects of nitrogen application rate on the naringenin exudation from intercropped faba bean’s roots in different separation patterns[J]. Plant Physiology Journal, 2017, 53(6): 1097–1103
[21]刘晓玲, 杜文华, 宋超. 氮磷肥施用量对红三叶中异黄酮含量的影响[J]. 西北农业学报, 2010, 19(7): 159–163 LIU X L, DU W H, SONG C. Effects of nitrogen and phosphorus fertilization on isoflavone content in red clover[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2010, 19(7):159–163
[22]谷文英, 余飞, 陈莹, 等. 不同生长时期红三叶异黄酮含量变化的研究[J]. 草原与草坪, 2006, (3): 61–64 GU W Y, YU F, CHEN Y, et al. Study on the distribution of isoflavone inTrifolium pratenseat different growth stages[J].Grassland and Turf, 2006, (3): 61–64
[23]卢国理, 汤利, 楚轶欧, 等. 单/间作条件下氮肥水平对水稻总酚和类黄酮的影响[J]. 植物营养与肥料学报, 2008,14(6): 1064–1069 LU G L, TANG L, CHU Y O, et al. Effect of nitrogen levels on the changes of phenol and flavonoid contents under rice monocropping and intercropping system[J]. Plant Nutrition and Fertilizer Science, 2008, 14(6): 1064–1069
[24]LI B, LI Y Y, WU H M, et al. Root exudates drive interspecific facilitation by enhancing nodulation and N2fixation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(23): 6496–6501

