有色金属矿区植物根际耐镉菌的分离鉴定与镉吸附特性
汪婵娟, 熊治廷, 徐仲瑞, 刘荣相
(武汉大学资源与环境科学学院, 湖北 武汉 430079)
镉为动植物非必需元素,有一定的挥发性,可致畸,致癌,致突变,能通过空气和食物链在人类和动植物体内持续积累,直至产生严重危害[1-2]。土壤镉污染将直接影响国土安全和农产品安全。2014年环境保护部和国土资源部对全国土壤污染状况的调查公报[3]显示,全国土壤总的点位超标率达16.1%,值得注意的是,土壤镉的超标情况较其他几种重金属(铜、铅、铬、汞、镍等)严重,且南方土壤污染重于北方。面对我国严峻的土壤重金属污染形势,发展环保、经济的生物修复技术显得极为重要。
生物修复包括微生物修复和植物修复,微生物修复技术的机理则是利用微生物种类多、易培养、繁殖快和代谢能力强等优点,通过其吸附、吸收和代谢活动改变土壤或水体中重金属形态,固定重金属,实现对环境中重金属的削减和净化[4]。代淑娟等[5]发现枯草芽孢杆菌(Bacillussubtilis)对电镀废水中镉的去除率可达93%以上。BENMALEK等[6]分离的微球菌属(Micrococcussp.)2YB-25OH在可抵抗15种抗生素的同时,对包括铜、镉、铅、镍在内的7种重金属表现出较强的吸附能力,吸附率为38.0%~83.9%。因此,寻找对重金属有一定耐性、能帮助植物在根际固定钝化重金属、改善植物生长条件的优势菌株,对发展环境友好型微生物技术非常关键。
考虑到根际是镉在土壤-微生物-植物体系中迁移转化的重要界面,笔者从有色金属矿区植物根际土壤筛选耐镉菌株,结合现代分子生物学技术,对其进行菌属鉴定,并探讨温度、吸附时间和pH对菌株镉吸附特性的影响,为微生物技术在镉污染土壤修复领域的应用提供试验材料和理论依据。
1 材料与方法
1.1 样品采集与处理
样品采自湖南宝山有色金属矿山(25°44′ N,112°45′ E)。从该矿区采集优势植物及其根区土壤,每种植物至少采集3株,置于灭菌袋中带回。土壤经自然风干后,过筛,采用常用的王水消煮-火焰原子吸收法测定其全镉、全铜含量。将采回的植株分类,分别选取2~3株长势较好的植株在温室中培养,留作后续植物鉴定。其余植株则用三级水洗净,分为地上、地下部分,作杀青、烘干、粉碎处理,采用HNO3-HClO4(体积比为4∶1)法消解,用原子吸收法测定样品中镉、铜含量。
富集系数(BF)为植物体内重金属含量与土壤中该重金属含量的比值,BF越大,表明植物越易从土壤中吸收该元素;转运系数(TF)为植物地上部分重金属含量与植物地下部分重金属含量的比值,TF越大,表明重金属从根系向地上部分转运的能力越强。
1.2 耐镉菌株的分离鉴定
1.2.1培养基
LB固体培养基:ρ(胰蛋白胨)为10 g·L-1,ρ(酵母提取物)为5 g·L-1,ρ(NaCl)为10 g·L-1,ρ(琼脂)为15~20 g·L-1,dd H2O,pH值为7.2~7.4;用于分离细菌及吸附试验。液体培养基无需加琼脂。所有培养基均于1.012×105Pa、120 ℃条件下高压灭菌30 min,若要加重金属镉,则加入单独灭菌的CdCl2溶液,混合摇匀即可。
NA固体培养基:ρ(牛肉膏)为3 g·L-1,ρ(蛋白胨)为10 g·L-1,ρ(NaCl)为5 g·L-1,ρ(琼脂)为15~20 g·L-1,dd H2O,pH值为7.4~7.6;主要用作菌株活化、形态学观察和生长曲线的测定。
1.2.2耐镉菌株的分离筛选
取采集的新鲜植株,轻轻抖动根部以去除其周围多余土壤,取根表面2 mm左右的土壤作为根际土壤[7]。无菌操作条件下,称取5 g根际土壤加入装有45 mL无菌水的三角瓶中,于30 ℃、220 r·min-1条件下振荡10 min,分别制备10-2、10-4和10-6倍稀释的土壤悬液,涂布于ρ(Cd2+)为50 mg·L-1的LB固体平板上,30 ℃条件下培养。3 d后,挑取表型特征不同的单菌落在上述培养基上多次划线分离、纯化,最后转接斜面,4 ℃条件下保藏备用。
1.2.3耐镉菌株的形态学观察
将活化的菌株在NA培养基上培养2 d,对照《常见细菌系统鉴定手册》[8]对菌株进行形态学观察。
1.2.416S rDNA分子生物学鉴定
将冷藏菌种在NA培养基平板上活化,挑取单菌落到其液体培养基中振荡培养。采用CTAB/NaCl法[9]提取总DNA模板。通用引物为27F(5′-A ̄G ̄A ̄G ̄T ̄T ̄T ̄G ̄A ̄T ̄C ̄C ̄T ̄G ̄G ̄C ̄T ̄C ̄A ̄G-3′)和1492R(5′-G ̄G ̄T ̄T ̄A ̄C ̄C ̄T ̄T ̄G ̄T ̄T ̄A ̄C ̄G ̄A ̄C ̄T ̄T-3′)。PCR反应体系(30 μL):3 μL DNA模板,3 μL 10×LA Buffer(含Mg2+),27F和1492R各1.5 μL,2.4 μL dNTP Mixture(2.5 mmol·L-1),0.6 μL LA-TaqDNA聚合酶(5 U·μL-1),18 μL dd H2O。
PCR反应条件:94 ℃条件下预变性5 min;94 ℃ 条件下变性30 s,50 ℃条件下退火30 s,72 ℃条件下延伸1.5 min,35个循环,再在72 ℃条件下延伸7 min。扩增产物琼脂糖凝胶电泳后切胶回收目的片段。将目的片段链接pMD19-T载体(TaKaRa),转化大肠杆菌并送测序。将测序结果上传至NCBI数据库(https:∥blast.ncbi.nlm.nih.gov) 中获取GenBank登录号,并进行BLAST比对,与已知16S rDNA序列进行相似性分析,最后用MEGA 5.1软件构建系统进化树。
1.3 生长曲线及最低抑菌浓度的测定
筛选的耐镉菌株采用NA培养基。参照《微生物学实验手册》[10],以培养时间作为横坐标,以波长为600 nm时测得的光密度(D600)作为纵坐标,绘制不同菌株的生长曲线。最低抑菌浓度(minimal inhibitory concentration,MIC)的测定:挑取单菌落在含50 mg·L-1的LB培养基上划线,37 ℃条件下培养72 h。待长出菌落后,再重新挑取新鲜活化的单菌落在更高浓度镉的LB培养基上划线培养,每组均设3个平行,重复此操作,待菌株不再长出时培养基中镉浓度即为MIC。
1.4 菌株吸附试验
取对数期菌悬液,按20 mL·L-1接种量添加到初始ρ(Cd2+)为50 mg·L-1的LB液体培养基中,体系总体积为100 mL。初始条件设为温度30 ℃,pH值7.0,摇床转速180 r·min-1,实验过程中严格遵循单因素控制变量标准。(1)温度设为25、30、35、40和45 ℃;(2)pH值设为5.5、6.5和7.5;(3)吸附时间设为每隔10 h取样1次,每次取样1 mL。每组均设3个平行,以未加菌悬液但有重金属的培养基作为空白组。振荡培养36 h后,按相对离心力(RCF)10 000离心5 min,取上清液,过0.45 μm孔径水系滤膜,用火焰原子吸收光谱法(AAS)测定镉浓度。
最终不同菌株的吸附率(A,%)计算公式为A=(C0-Ct)/C0×100。其中,C0为培养基初始镉浓度,mg·L-1;Ct为各时间段培养基中镉浓度,mg·L-1。
1.5 数据处理
采用SPSS 17.0和Excel 2010软件对实验数据进行统计分析,用LSD法进行显著性检验(n=3);采用MEGA 5.1软件选择Neighbor-joining模型构建系统进化树(Bootstrap值为1 000)。
2 结果与分析
2.1 植物分类与样品重金属测定
采集的植物样品均是矿区长势良好、分布较多的植物,经长达7个月温室栽培,对其叶、茎、花和种子等进行观察,并将其与《中国植物志》(http:∥frps.eflora.cn/)作分析比对,经鉴定,4种优势植物分别为瞿麦(Dianthussuperbus)、兰香草(Caryopterisincanavar.incana)、野菊(Dendranthemaindicum)和败酱(Patriniavillosa)。
表1显示,不同植物的根区土壤镉、铜含量存在差异。根区土壤全镉含量最高的植物是野菊,达146.03 mg·kg-1。而根区土壤全铜含量最高的植物是瞿麦,达1 985.0 mg·kg-1,其次是败酱(1 102.5 mg·kg-1)。与GB 15618—1995《土壤环境质量标准》[11]三级标准限值〔w(镉)为1 mg·kg-1,w(铜)为400 mg·kg-1〕相比,4种植物根区土壤重金属含量超过临界值若干倍,属于严重超标。
表1植物和根区土壤中镉和铜含量
Table1Theconcentrationofcadmiumandcopperinplantsandrootzonesoils

mg·kg-1
数据为平均值±标准差。同列数据后英文小写字母不同表示不同植物间某指标差异显著(P<0.05)。
采用BF和TF来反映重金属元素在土壤和植物、植物根系和地上部分之间迁移的难易程度。4种植物对镉的富集能力由大到小依次为野菊、瞿麦、兰香草和败酱(表2)。野菊体内镉绝对含量最高,其BF最大(2.29);瞿麦对镉的BF为1.53,同时其体内铜绝对含量最高,能在高含量铜土壤中生长。值得注意的是,败酱虽对镉的BF值较小,但其对镉的TF值最高(接近1),表明败酱根系向地上部分转移镉的能力高于其他3种植物。4种植物对镉、铜的TF都小于1,表明这些植物体内储存的重金属绝大多数在根部,4种植物向地上部分转移重金属的能力较弱。
表2镉和铜在不同植物各部位的富集系数和转运系数
Table2ComparisonofbioconcentrationfactorsandtransferfactorsofCd,Cuindifferentplants
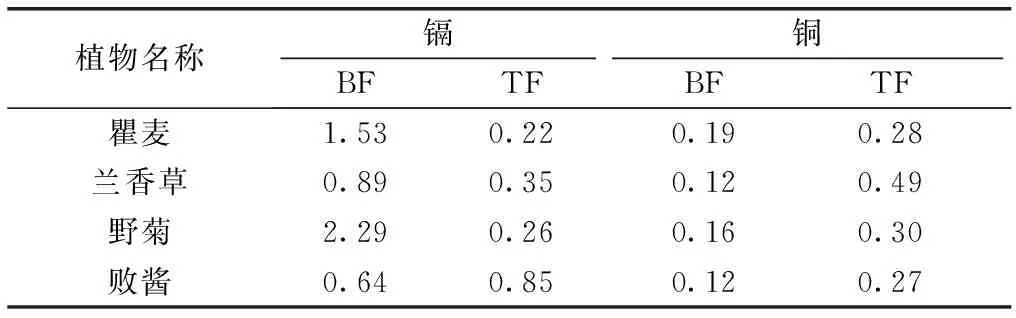
植物名称镉铜BFTF BFTF 瞿麦1.530.22 0.190.28 兰香草0.890.350.120.49 野菊2.290.260.160.30 败酱0.640.850.120.27
BF为富集系数,TF为转移系数。
2.2 耐镉菌株的鉴定
2.2.1植物与菌株的关系
对矿区优势植物的根际土壤进行耐性菌的筛选,得到BS1、BS2和BS3这3种耐镉菌株,植物与菌株的对应关系见表3。
表3耐镉菌株与植物的对应关系
Table3CorrespondencebetweenCd-resistantstrainsandplants
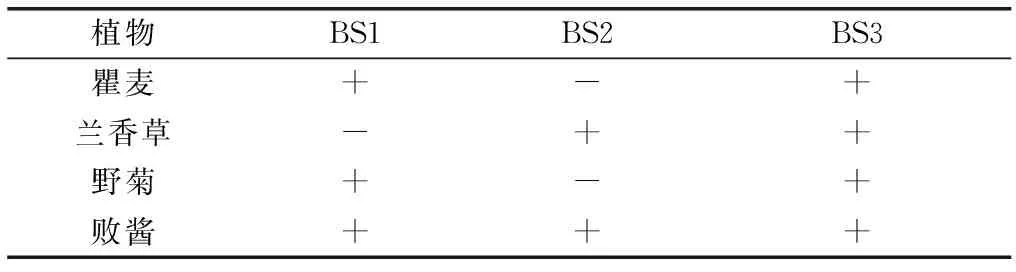
植物BS1BS2BS3 瞿麦+-+ 兰香草-++ 野菊+-+ 败酱+++
“+”表示在该植物根际发现此菌,“-”表示未发现此菌。
2.2.2形态学观察
由图1可见,生长2 d后,BS1菌落呈白色略带淡黄色,直径约为1~2 mm,低凸起,圆形不透明,表面光滑,有光泽,边缘较整齐,不易挑起,后期会分泌水溶性色素,使菌落周围的培养基变成暗黄色。BS2菌落呈圆形,乳白色,直径约为1~3 mm,表面扁平,不光滑,边缘整齐,质地较均匀,菌落分布较分散。BS3菌落中间呈不透明浅黄色,直径约为1~2 mm,边缘半透明,较整齐,表面较圆润,整体呈链状排列。
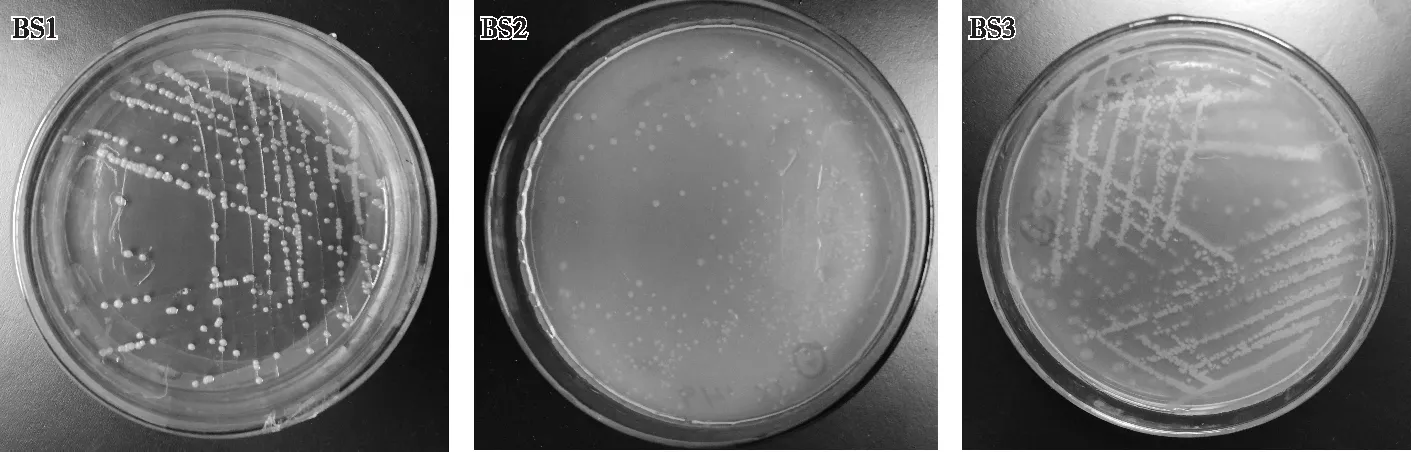
图1 3种耐镉细菌在固体培养基中的生长情况
2.2.316S rDNA序列分析结果
将3个耐镉菌株的16S rDNA序列上传至RDP-Ⅱ(S-ab score:1.000)数据库(http:∥rdp.cme.msu.edu/)中进行鉴定(表4),并从BLAST比对结果中挑选相似性较高的相关模式菌株的16S rDNA基因序列,利用MEGA 5.1软件构建系统发育树。在进化树中,BS1与SphingomonasechinoidesATCC 14820和SphingomonasglacialisC16y聚成一簇,与前者亲缘关系最近,自举值高达100%(图2)。虽然BS2与DuganellaradicisSac-41相似度最高,但与Massiliaflavastrain Y9聚成一簇,自举值为97%,在进化树中与DuganellaradicisSac-41进化距离较远(图3)。BS3与阿氏芽孢杆菌(Bacillusaryabhattai) B8W22、巨大芽孢杆菌(Bacillusmegaterium) IAM 13418和BacillusqingshengiiG19聚成一簇,尽管BS3与科氏芽孢杆菌(Bacilluscohnii) DSM 6307 T的相似性最高,但与阿氏芽孢杆菌B8W22表现出更近的亲缘关系,自举值为75%(图4)。
表43种耐镉菌株的鉴定结果及GenBank登录号
Table4IdentificationresultofthreeCd-resistantstrainsandtheiraccessionnumber

菌株(登录号)最大相似菌株(登录号) 相似度/% BS1(MG603650)Sphingomonas echinoides ATCC 14820(AB021370)99.79 BS2(MG603651)Massilia flava strain Y9(HM777013)98.79 BS3(MG603652)Bacillus aryabhattai B8W22(EF114313)99.80
BLAST比对结果也显示,BS1、BS2和BS3分别与鞘氨醇单胞菌(Sphingomonassp.)、Massiliasp.和芽孢杆菌(Bacillussp.)的同源性都为99%~100%。表4显示,3株细菌与相应的属内模式菌株最大相似度为98.79%~99.80%,确定BS1为S.echinoides,BS2为M.flava,BS3为阿氏芽孢杆菌(B.aryabhattai)。
2.3 生长曲线及耐镉性
3个菌株的生长趋势基本一致(图5)。0~10 h为适应期,10~20 h前后为对数期,20~28 h前后为稳定期,28 h之后呈现衰亡趋势。经测定,在NA固体培养基中BS1、BS2和BS3对Cd2+的MIC分别为300、100和80 mg·L-1。

图2 基于16S rDNA序列构建的菌株BS1的系统发育树
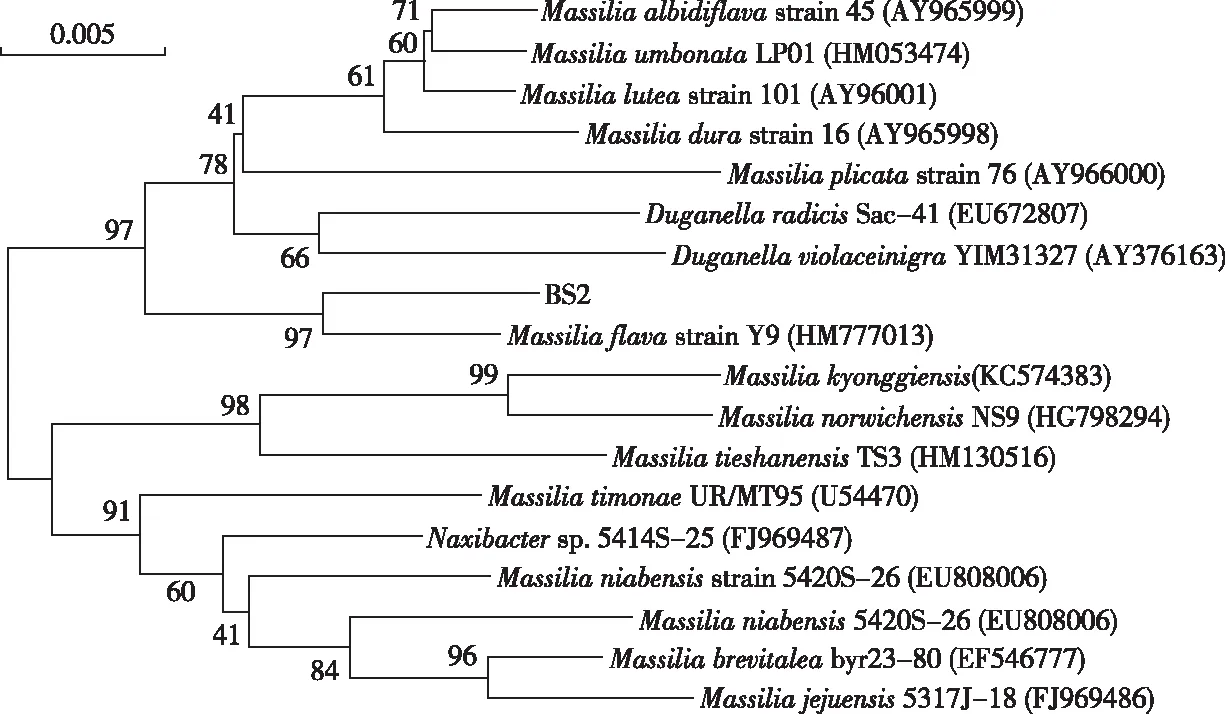
图3 基于16S rDNA序列构建的菌株BS2的系统发育树Fig.3 Phylogenetic tree of strain BS2 based on 16S rDNA sequences
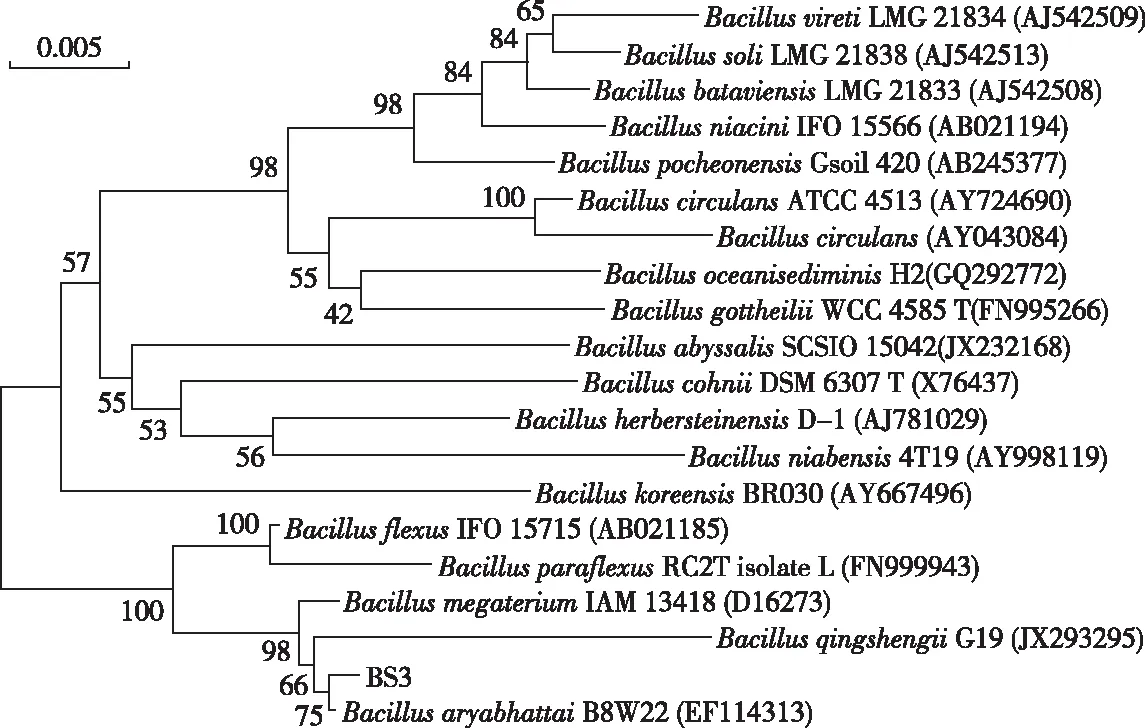
图4 基于16S rDNA序列构建的菌株BS3的系统发育树
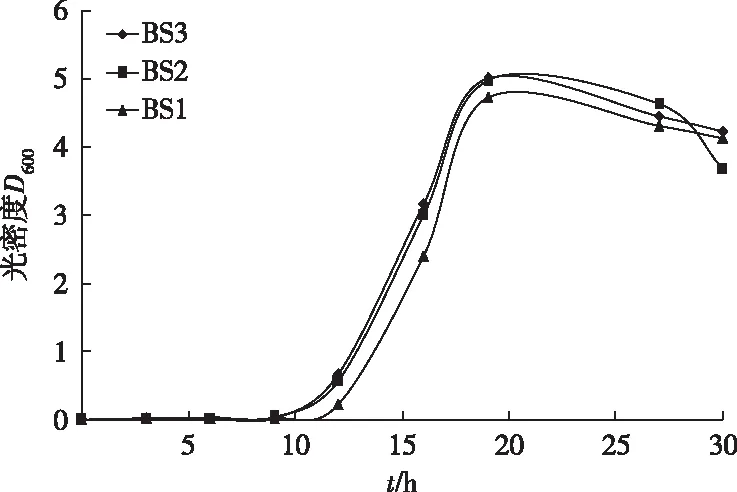
图5 耐镉菌株生长曲线
2.4 菌株对镉的吸附性能
2.4.1温度对镉吸附的影响
随着温度的升高,3种菌对重金属镉的吸附率在整体上都呈现先上升后下降趋势。当温度从25 ℃ 上升到30 ℃时,吸附率显著升高,在30 ℃时吸附率达最高,高于30 ℃时吸附率则缓慢降低(图6)。由此可见,在一定温度范围内提高温度可提高菌株对Cd2+的吸附率,温度偏高或偏低都不利于菌株对Cd2+的吸附。最终确定30 ℃为3种菌吸附Cd2+的最佳温度。
2.4.2时间对镉吸附的影响
由图7可见,温度为30 ℃时,3种菌前期吸附率都较小,10~30 h时逐渐上升,30 h后吸附基本达到饱和。3个菌株在Cd2+吸附过程中吸附率有波动,但总体呈现缓慢上升直至稳定的变化趋势。综合吸附时间对3种菌吸附Cd2+的影响,确定菌株对Cd2+吸附的平衡时间为30 h。
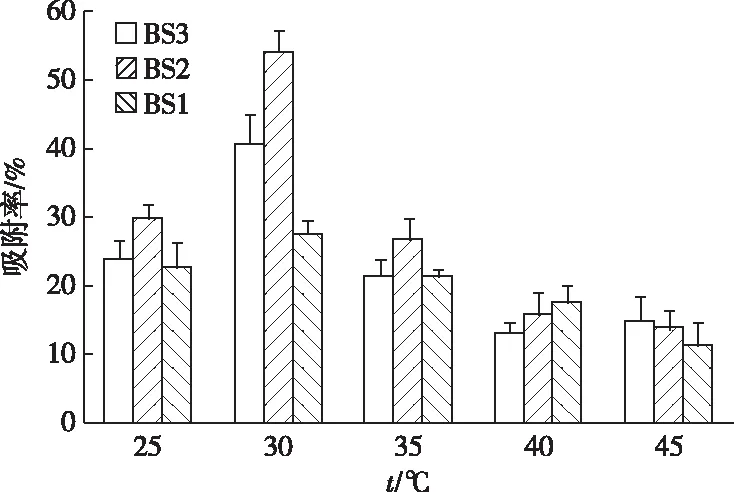
图6 温度对耐镉菌株吸附Cd2+的影响
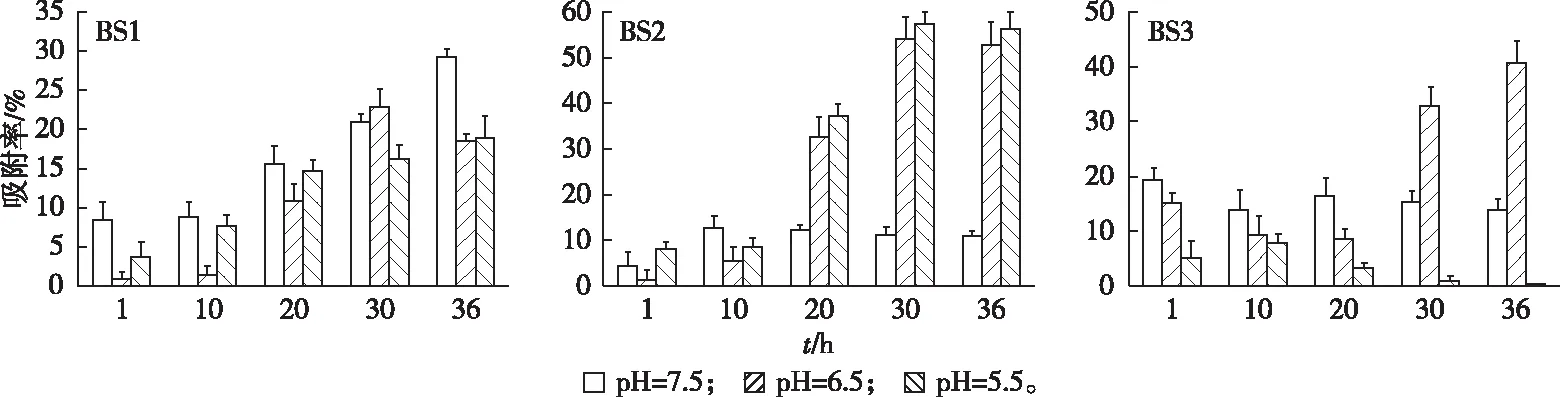
图7 pH和吸附时间对耐镉菌株吸附Cd2+的影响
2.4.3pH对镉吸附的影响
图7显示,当温度为30 ℃时,在pH值分别为5.5、6.5和7.5条件下,BS1对镉的最大吸附率为18.83%~29.14%。在偏酸(pH值为5.5、6.5)条件下,BS2对Cd2+的吸附率在10 h后开始迅速上升,最大吸附率分别达57.32%和54.15%,对镉的吸附效果最好;在偏碱条件下,BS2对Cd2+的吸附率基本上仅在11.01%~12.63%范围内波动,其原因可能是偏碱条件下Cd2+与—OH形成沉淀。对于BS3,pH值为6.5时吸附效果最好,最大吸附率可达40.66%;其他2种pH条件下吸附现象不明显。
3 讨论与结论
瞿麦、兰香草、野菊和败酱4种矿区植物对重金属的抗性比普通植物强,能适应矿区高含量重金属环境。从富集系数和转运系数来看,野菊和瞿麦对镉的吸收、转运能力强于兰香草和败酱,这与张频等[12]通过园林植物盆栽实验得出的瞿麦对镉污染土壤修复效果显著的结论一致。
从矿区优势植物根际筛选到的3个耐镉菌株BS1、BS2和BS3,经鉴定分别为S.echinoides、M.flava和B.aryabhattai。3者对镉均有较强的耐性,其中,BS1对镉的耐性最强(MIC为300 mg·L-1),BS2次之(100 mg·L-1),BS3最弱(80 mg·L-1)。关于细菌耐受高浓度重金属的原因,MARGESIN等[13]和JAFARZADE等[14]推测可能与它们独特的解毒机制有关,如细菌细胞对金属离子的累积和络合作用、细胞外金属离子的外排作用以及细胞表面的离子交换等。王慧萍等[15]发现鞘氨醇单胞菌可在高浓度锌胁迫下,在细胞表面形成沉淀而降低锌的毒性。
笔者实验结果表明,在其他条件相同的情况下,3个菌株对镉的吸附效果受到pH的显著影响。BS1在3个pH条件下吸附率较小且变化范围不大,表明其能适应一定范围内pH的变化,同时可耐受高含量镉,推测该菌株在矿区土壤环境的适应能力较强。BS2 在偏酸(pH值为5.5、6.5)条件下,对镉的吸附效果最好,最大吸附率分别达57.32%和54.15%,而pH值为7.5时吸附率很小,推测该菌株在弱酸性根际土壤中固定镉的能力较强。BS3仅在pH值为6.5时对镉的吸附效果显著。
综合MIC和吸附率结果,BS1对镉的耐性很强,但对镉的吸附率很低,推测该菌株抗镉的主要机制可能是通过细胞外排作用将大量镉离子滞留在细胞外,避免镉在细胞内不断累积并最终产生生物毒性。关于鞘氨醇单胞菌的抗重金属机制,王慧萍等[15]发现鞘氨醇单胞菌DX-T3-03是通过细胞壁表面的—OH、—NH、—COOH和—PO43-等化学基团吸附重金属离子,在细胞表面形成沉淀达到富集解毒的目的,笔者研究结论与之一致。目前,国内外学者对鞘氨醇单胞菌的研究主要是其可降解多种高分子有机污染物(多环芳烃、六氯环己烷和蒽醌等)[16]、促进植物生物量增长[17]等方面,关于该类菌在重金属环境中的研究报道还较少。笔者从有色金属矿区的优势植物瞿麦、野菊和败酱根部筛选到BS1菌株,表明该菌株也可以在重金属污染严重的环境中生存,且BS1菌株很可能对上述植物在矿区的生长起着正面作用。BS1可用于重金属污染农田中,吸附一定量的重金属,同时促进农作物生长,提高农作物产量。BS2对镉的吸附效果最好,但对镉的耐性不强,表明它能将大量镉累积到细胞内或细胞壁表面,外排作用不明显,呈现高含量Cd2+会抑制该菌株活性的现象。HRYNKIEWICZ等[18]认为离子交换是Cd2+进入Massiliasp.细胞内的主要机制,他发现在Cd胁迫条件下随着Cd2+浓度的升高,菌株对Cd的耐受能力增强,且细胞内Cd含量上升的同时,Ca、Mg含量显著降低。因此,推断BS2主要通过离子交换过程实现对胞外Cd2+的大量吸收和累积。由于BS2吸附率最高,推测其在根际环境中也能吸附大量镉,降低土壤中镉的流动性,起到钝化重金属的作用。笔者认为,矿区生长的植物很可能采取了这种根际微生物钝化的生存策略。关于Massiliasp.菌株富集重金属以及用作微生物钝化剂的研究国内外报道较少,因此,笔者研究为该类细菌在重金属污染治理方面的应用提供了基础数据,为微生物修复重金属污染土壤提供了理论支持。
与前2种菌株相比,BS3对镉的耐性最弱,且仅在pH=6.5时对Cd2+有较好的吸附效果,其他2个pH条件下吸附现象不明显,说明该类菌在吸附Cd2+过程中对pH的要求较高。已有学者发现阿氏芽孢杆菌可作为一种促生菌,分泌吲哚乙酸、赤霉素等植物生长激素,促进植物生长;同时,阿氏芽孢杆菌可促进植物根际无效磷的有效化,有效缓解矿区土壤营养贫乏的现状[19]。笔者在4种优势植物根际土壤中均分离得到耐镉菌株BS3,表明其在该矿区根际环境中分布较广泛。RAMESH等[20]发现接种阿氏芽孢杆菌菌株的大豆和小麦产量明显增加,各植物根际土壤pH也大大降低。通常,土壤pH降低会增强镉的流动性,促进植物对镉的吸收。这些特性表明BS3菌株有联合超富集植物修复重金属污染土壤的潜力。BS3菌株不仅可以促进超富集植物对重金属的吸收,还可以增加超富集植物生物量,而生物量偏小是超富集植物修复重金属污染土壤的一个非常重要的限制因素[21-22]。当然,目前关于阿氏芽孢杆菌与重金属的研究还较少,其在植物修复中的作用还需要进一步的实验验证。
综合来看,BS1菌株对镉有较强的耐受能力,对镉的吸附效果稳定,可适应一定范围内pH的变化,有作为微生物钝化剂的潜力,还可考虑将其作为固定化微生物技术的优势菌株处理废水中的重金属。此外,BS1可能有促进植物生长的特性,因此具有较高的应用价值。BS2是3个耐镉菌中对镉吸附能力最强的一个菌株,对Cd2+有很强的吸附能力,推测它在根际微环境中可以吸附大量镉,降低植物根系周围土壤中镉含量,从而降低镉对植物的毒害,可以作为微生物钝化剂使用。同时,由于BS2对镉有较高的吸附率,其可作为用微生物技术处理冶炼工厂废水的功能菌株。菌株BS3联合植物修复重金属污染土壤的潜力较大,能分泌植物激素促进植物生长,可以降低土壤pH值,促进植物对重金属的吸收。
[1] 高天然,周可新.镉胁迫下水生动物的生物标志物研究进展[J].生态与农村环境学报,2017,33(4):297-307.[GAO Tian-ran,ZHOU Ke-xin.Advancement of the Study on Biomarkers of Aquatic Animals Exposed to Cadmium Stress[J].Journal of Ecology and Rural Environment,2017,33(4):297-307.]
[2] ZHANG W L,DU Y,ZHAI M M,etal.Cadmium Exposure and Its Health Effects:A 19-Year Follow-Up Study of a Polluted Area in China[J].Science of the Total Environment,2014,470/471:224-228.
[3] 中华人民共和国环境保护部,中华人民共和国国土资源部.全国土壤污染状况调查公报[EB/OL].(2014-04-17)[2018-03-10].http:∥www.gov.cn/foot/site1/20140417/7 ̄8 ̄2 ̄b ̄c ̄b ̄8 ̄8 ̄8 ̄4 ̄0 ̄8 ̄1 ̄4 ̄b ̄a158d01.pdf.
[4] 钱春香,王明明,许燕波.土壤重金属污染现状及微生物修复技术研究进展[J].东南大学学报(自然科学版),2013,43(3):669-674.[QIAN Chun-xiang,WANG Ming-ming,XU Yan-bo.Current Situation of Soil Contamination by Heavy Metals and Research Progress in Bio-Remediation Technique[J].Journal of Southeast University (Natural Science Edition),2013,43(3):669-674.]
[5] 代淑娟,王玉娟,魏德洲,等.枯草芽孢杆菌对电镀废水中镉的吸附[J].有色金属,2010,62(3):156-159.[DAI Shu-juan,WANG Yu-juan,WEI De-zhou,etal.Biosorption of Cadmium From Cadmium-Containing Electroplating Wastewater byBacillussubtilis[J].Nonferrous Metals,2010,62(3):156-159.]
[6] BENMALEK Y,FARDEAU M L.Isolation and Characterization of Metal-Resistant Bacterial Strain From Wastewater and Evaluation of Its Capacity in Metal-Ions Removal Using Living and Dry Bacterial Cells[J].International Journal of Environmental Science and Technology,2017,13(9):2153-2162.
[7] KUFFNER M,PUSCHENREITER M,WIESHAMMER G,etal. Rhizosphere Bacteria Affect Growth and Metal Uptake of Heavy Metal Accumulating Willows[J].Plant and Soil,2008,304(1/2):35-44.
[8] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:162-167.
[9] UDDIN M S,SUN W L,HE X H,etal. An Improved Method to Extract DNA From MangoMangiferaindica[J].Biologia,2014,69(2):133-138.
[10] 周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:58-64.
[11] GB 15618—1995,土壤环境质量标准[S].[GB 15618-1995,Environmental Quality Standard for Soils[S].]
[12] 张频,连芳青,朱美英,等.抗污染园林植物的选择[J].江西农业大学学报,2004,26(6):941-943.[ZHANG Pin,LIAN Fang-qing,ZHU Mei-ying,etal.Choice of Pollution-Resistant Garden Plants[J].Acta Agriculturae Universitatis Jiangxiensis,2004,26(6):941-943.]
[13] MARGESIN R,SCHINNER F.Bacterial Heavy Metal-Tolerance:Extreme Resistance to Nickel inArthrobacterspp.Strains[J].Journal of Basic Microbiology,2010,36(4):269-282.
[14] JAFARZADE M,MOHAMAD S,USUP G,etal.Heavy-Metal Tolerance and Antibiotic Susceptibility of Red Pigmented Bacteria Isolated From Marine Environment[J].Natural Resources,2012,3:171-174.
[15] 王慧萍,谢学辉,柳建设.强抗锌鞘氨醇单胞菌的分离鉴定及其抗性机理[J].东华大学学报(自然科学版),2010,36(6):674-679.[WANG Hui-ping,XIE Xue-hui,LIU Jian-she.Isolation,Identification and Characteristics of a Zn-Resisting Bacterium,Sphingomonassp. DX-T3-03[J].Journal of Donghua University(Natural Science),2010,36(6):674-679.]
[17] KOLBAS A,KIDD P,GUINBERTEAU J,etal. Endophytic Bacteria Take the Challenge to Improve Cu Phytoextraction by Sunflower[J].Environmental Science and Pollution Research,2015,22(7):5370-5382.
[18] HRYNKIEWICZ K,ZLOCH M,KOWALKOWSKI T,etal.Strain-Specific Bioaccumulation and Intracellular Distribution of Cd2+,in Bacteria Isolated From the Rhizosphere,Ectomycorrhizae,and Fruitbodies of Ectomycorrhizal Fungi[J].Environmental Science and Pollution Research,2015,22(4):3055-3067.
[19] 王琰.解磷芽孢杆菌的筛选鉴定及其对玉米促生机理的研究[D].广州:华南农业大学,2016.[WANG Yan.Study on Isolation of Phosphate-Solubilizing Bacillus and Their Impact of Growth-Promoting for Maize[D].Guangzhou:South China Agricultural University,2016.]
[20] RAMESH A,SHARMA S K,SHARMA M P,etal. Inoculation of Zinc SolubilizingBacillusaryabhattai,Strains for Improved Growth,Mobilization and Biofortification of Zinc in Soybean and Wheat Cultivated in Vertisols of Central India[J].Applied Soil Ecology,2014,73:87-96.
[21] 李韵诗,冯冲凌,吴晓芙,等.重金属污染土壤植物修复中的微生物功能研究进展[J].生态学报,2015,35(20):6881-6890.[LI Yun-shi,FENG Chong-ling,WU Xiao-fu,etal. A Review on the Functions of Microorganisms in the Phytoremediation of Heavy Metal-Contaminated Soils[J].Acta Ecologica Sinica,2015,35(20):6881-6890.]
[22] 何琳燕,李娅,刘涛,等.龙葵根际和内生Cd抗性细菌的筛选及其生物学特性[J].生态与农村环境学报,2011,27(6):83-88.[HE Lin-yan,LI Ya,LIU Tao,etal.Isolation and Characteristics of Cadmium-Resistant Endophytic and Rhizobacteria FromSolanumnigrumin Orefield[J].Journal of Ecology and Rural Environment,2011,27(6):83-88.]
作者简介: 汪婵娟(1992—),女,湖北黄冈人,硕士,研究方向为环境生物学。E-mail: 2296429513@qq.com

