CTRP1在急性缺血性脑卒中患者中的表达及其对晚期神经功能缺损严重程度的预测
李素萍 谢彦 许飞 梁益 何保明 孙红斌
四川省医院科学院·四川省人民医院神经内科(成都 610073)
《中国心血管病报告2017》概要指出迄今我国心血管病患病人数达2.9亿,其中脑卒中1 300万人次,且每年约新增200万人次[1]。一项关于我国卒中疾病负担的横断面研究显示2013年我国大陆脑卒中发病率、患病率、病死率分别为246.8/10万、1 114.8/10万、114.8/10万,其中农村居民发病率(298.2/10万)显著高于城市居民(203.6/10万)。而急性缺血性脑卒中(acute ischemic stroke,AIS)是卒中的主要类型,约占60%~80%,据统计本病再次出现卒中的风险是普通人的10倍[2-3],5年累计复发率超过30%。研究证实炎症反应参与脑卒中的发生发展过程,并且与疾病的严重程度和预后具有相关性。补体C1q肿瘤坏死因子相关蛋白(C1q tumor necrosis factor related protein,CTRP1)是近年来新发现的脂肪细胞因子,参与机体炎症、血栓及氧化过程[4]。相关研究发现CTRP1可降低血糖、增加胰岛素敏感性、调节血脂、对抗动脉粥样硬化[5]。目前血清CTRP1在冠心病领域研究较多,尚缺乏CTRP1与AIS神经功能损伤严重程度和预后的相关性研究。本课题旨在探讨CTRP1与AIS患者中的表达及其对晚期神经功能缺损严重程度的预测价值。为早期识别AIS患者潜在风险提供新的依据。
1 对象与方法
1.1 研究对象本研究连续性纳入2014年2月至2017年2月由我院急诊收入接受治疗的首发AIS患者425例作为研究对象,进行前瞻性研究。选取同期在我院健康体检成人403例作为对照组。纳入标准:(1)参照《中国急性缺血性脑卒中诊治指南2010》,明确诊断首次发生AIS患者[6];(2)发病2周以内。排除标准:(1)已接受溶栓治疗患者;(2)凝血功能障碍、严重肝肾功能障碍、肿瘤、血液病患者;(3)合并脑出血患者;(4)免疫系统疾病患者;(5)年龄≤35岁。
1.2 方法
1.2.1 一般资料及实验室指标检测完善所有对象的一般临床资料,记录包括性别、年龄、个人史、既往病史等。研究对象空腹采集静脉血,采用全自动生化仪对超敏C反应蛋白(hypersensitivity C reactive protein,Hs-CRP)、总胆固醇(cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)进行检测。
所有对象血液凝固后进行高速离心,温度设置为4℃,转速3 500 r/min离心10 min提取上清液置入EP管中,保存于-80℃冰箱内。采用双抗体夹心酶联免疫法(ELISA)对血清CTRP1水平进行检测。试剂盒由AVISCERA BIOSCIENCE公司提供,所有步骤严格按说明书操作。
1.2.2 随访对研究对象出院后分别于1、3、6个月进行门诊随访,如未按时就诊,则采用电话随访。对出院后6个月患者采用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)进行评估,根据分值进行分组。1~4分为轻微中风,5~20分为中度中风,>20分为重度中风。
1.3 统计学方法采用SPSS 20.0统计软件进行统计学分析。计量资料用均数±标准差表示,两组间比较采用独立样本t检验;3组及3组以上的比较采用方差分析(正态分布)和秩和检验(非正态分布)。计数资料用百分率表示,组间比较采用χ2检验;相关性采用Pearson相关分析法分析CTRP1的相关因素;采用多元线性回归分析出院后6个月神经功能缺损程度独立影响因素。以P<0.05为差异具有统计学意义。
2 结果
2.1 4组基线情况比较AIS患者糖尿病、颈动脉粥样硬化、Hs-CRP、TC、TG、CTRP1水平均高于对照组,差异具有统计学意义(均P<0.05);对照组血清HDL-C水平高于AIS患者,差异具有统计学意义(P<0.05);其余指标差异无统计学意义。见表1。
表1 对照组和AIS组患者基线情况比较Tab.1 Comparison of baseline cases between the control group and the AIS group ±s
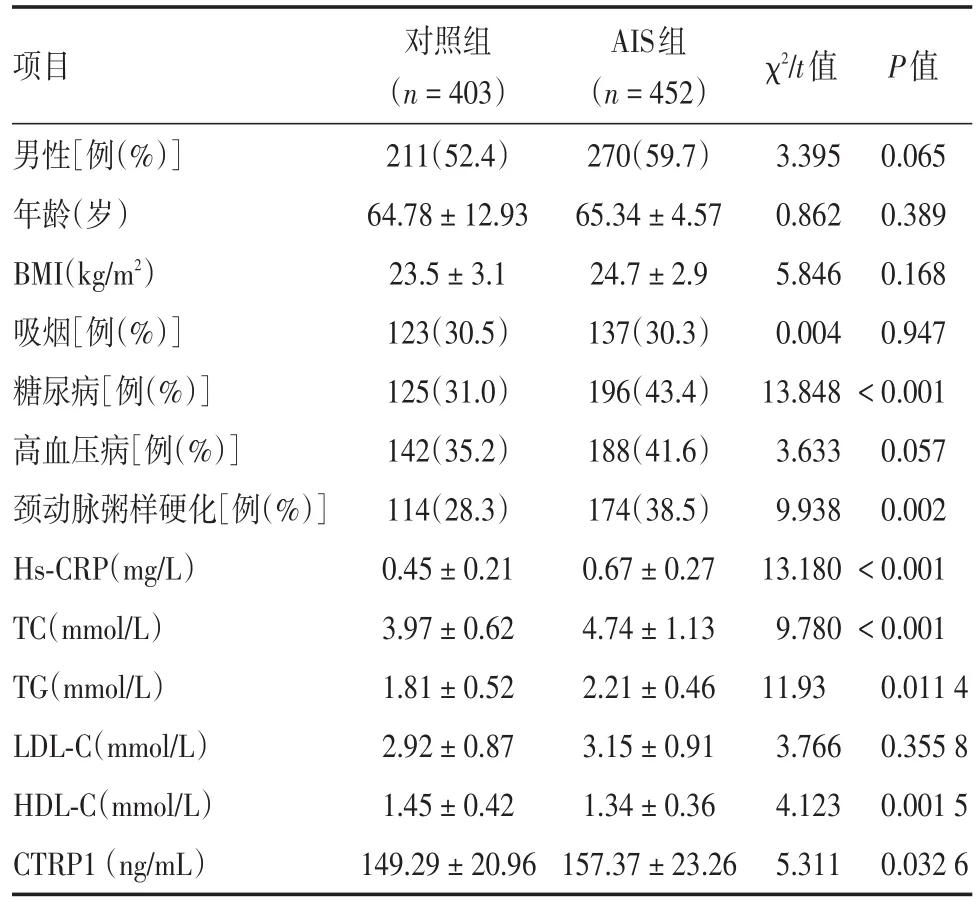
表1 对照组和AIS组患者基线情况比较Tab.1 Comparison of baseline cases between the control group and the AIS group ±s
项目χ2/t值P值男性[例(%)]年龄(岁)BMI(kg/m2)吸烟[例(%)]糖尿病[例(%)]高血压病[例(%)]颈动脉粥样硬化[例(%)]Hs-CRP(mg/L)TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)CTRP1(ng/mL)对照组(n=403)211(52.4)64.78±12.93 23.5±3.1 123(30.5)125(31.0)142(35.2)114(28.3)0.45±0.21 3.97±0.62 1.81±0.52 2.92±0.87 1.45±0.42 149.29±20.96 AIS组(n=452)270(59.7)65.34±4.57 24.7±2.9 137(30.3)196(43.4)188(41.6)174(38.5)0.67±0.27 4.74±1.13 2.21±0.46 3.15±0.91 1.34±0.36 157.37±23.26 3.395 0.862 5.846 0.004 13.848 3.633 9.938 13.180 9.780 11.93 3.766 4.123 5.311 0.065 0.389 0.168 0.947<0.001 0.057 0.002<0.001<0.001 0.011 4 0.355 8 0.001 5 0.032 6
2.2 不同亚型脑卒中患者CTRP1表达水平对照组[(119.53± 17.62)ng/mL,n=403]、不明原因及其他原因型脑卒中[(145.81±18.96)ng/mL,n=196]、大动脉粥样硬化型脑卒中[(153.17±19.21)ng/mL,n=76]、心源型脑卒中[(156.56±20.96)ng/mL,n=43]和小动脉闭塞型脑卒中[(169.23± 22.34)ng/mL,n=137]的CTRP1表达水平逐渐升高,并且差异具有统计学意义(F=216.9,P<0.001)。
2.3 不同神经功能缺损患者血清CTRP1水平比较对照组[(119.53±17.62)ng/mL]、神经功能缺损轻度组[(156.29±19.86)ng/mL]、中度组[(168.74±18.53)ng/mL]和重度组[(175.96±19.15)ng/mL]患者血清CTRP1水平逐渐上升,差异具有统计学意义(P<0.001)。
2.4 CTRP1相关性分析患者血清CTRP1与Hs-CRP、LDL-C呈正相关,与NIHSS评分呈负相关关系,与BMI、TC、TG、HDL-C无明显的相关性。见表2。
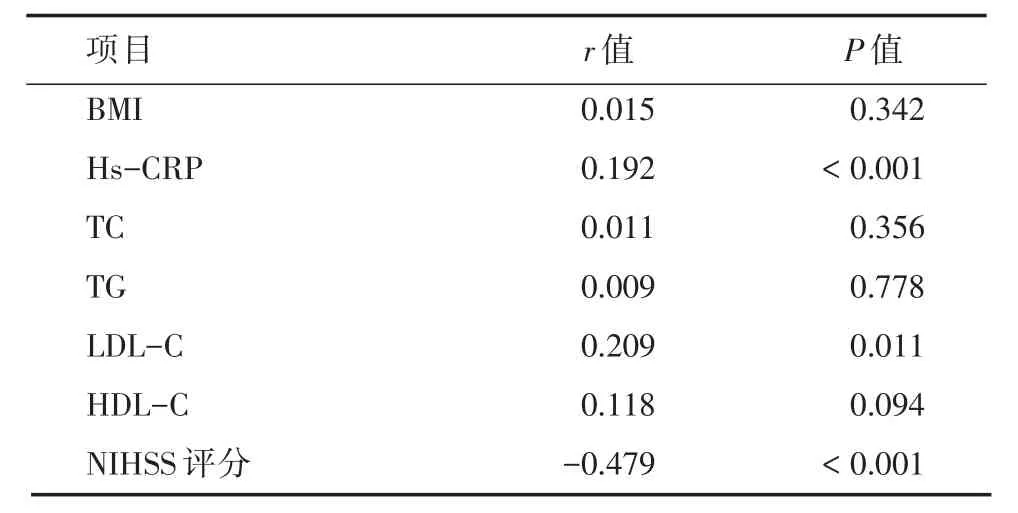
表2 血清CTRP1水平的相关性分析Tab.2 Correlation analysis of serum CTRP1 level in patients with AIS
2.5 AIS患者NIHSS评分的影响因素经多因素线性回归分析显示,CTRP1、年龄、糖尿病、Hs-CRP、LDL-C为NIHSS评分的独立影响因素。见表3。
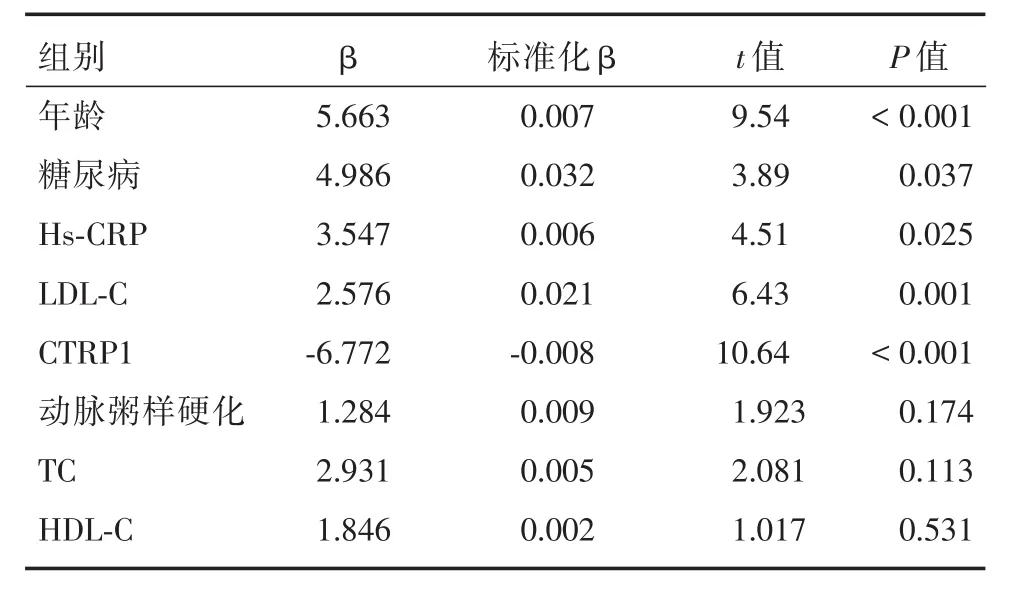
表3 多因素线性回归分析AIS患者NIHSS评分的影响独立因素Tab.3 Multiple factor linear regression analysis of the influence of independent factors on NIHSS score in patients with AIS
3 讨论
AIS是神经内科急危重症,具有较高的死亡率、复发率,且短期内常伴发多种并发症[7],据统计每年全球约600万人死于脑卒中[8],幸存者中约75%患者遗留有不同程度的肢体功能障碍。虽然诊疗技术不断提高,但由于脑组织对缺血缺氧异常敏感,且其在缺血缺氧状态下代偿能力较其他组织弱,血供中断5 min便会出现不可逆的损伤,因此尽早对疾病预后进行评估,对采用个体化治疗的患者尤为重要。
研究发现,炎症反应是缺血事件发生和发展过程中重要的病理生理过程[9-10]。脂肪细胞作为重要的内分泌器官,其分泌的脂联素参与机体的物质代谢及炎症反应[11],具有抗炎、拮抗动脉粥样硬化、降低血糖等作用。CTRP1是新近发现的细胞因子,其结构与脂联素相似,但两者缺乏高度同源的核苷酸和氨基酸序列。CTRP1 mRNA在心脏、肝脏、肾脏、卵巢中均有表达,其在脂肪组织中表达最高。研究发现代谢紊乱、慢性炎症等均是动脉粥样硬化的危险因素。动物实验发现敲除脂联素基因的小鼠血浆CTRP1水平明显高于空白对照组,且其血糖水平低于对照组[12],并且CTRP1的过度表达可以提高肥胖老鼠胰岛素的敏感性,同时重注射CTRP1组加强腺苷酸活化蛋白激酶(AMPK)信号转导从而增加脂肪酸氧化代谢[13]。CTRP1还通过P38分裂原激活蛋白激酶(MAPK)信号通路,诱导动脉粥样硬化斑块中黏附分子及巨噬细胞表达,在肿瘤坏死因子α的刺激下诱发更为严重的炎症反应。LU等[14]研究发现,apoE基因小鼠通过腹腔注射CTRP1可促进动脉粥样硬化的发生,而CTPR1/apoE小鼠其动脉粥样硬化发生的范围、严重程度及炎症反应均降低。CTRP1还可旁分泌和自分泌途径促进血管平滑肌增殖[11,15]以及 ERK1/2 通路的激活促进血管壁钙化[12,16]。目前尚无研究对CTRP1在脑卒中患者中的表达和神经功能预后进行研究。本研究中首次检测CTRP1在不同类型脑卒中患者血浆中的表达,发现和动脉粥样硬化相关脑卒中的表达水平明显低于其他类型脑卒中,说明CTRP1可能通过对动脉粥样硬化的作用参与脑卒中的发生发展,抑制动脉粥样硬化,抑制巨噬细胞炎症反应,从而实现脑保护。本研究中患者CTRP1和炎症标志物hs-CRP呈现负相关关系,说明该标志物可能在脑卒中患者中具有一定的抗炎作用,hs-CRP和脑卒中预后明显相关[17]。患者病情越严重,可能消耗CTRP1越多,血浆中CTRP1含量越少。所以本研究中神经功能缺损和CTRP1呈现负相关关系。
本课题存在以下不足:(1)本研究为单中心小样本研究,可能存在统计效能不足;(2)本研究患者随访时间较短,未对住院期间和出院后患者因为IS的不良事件进行具体统计;(3)本研究未对CTRP1时间动力曲线进行检测,未探究CTRP1在脑卒中患者随着病情进展患者血浆中表达的变化;(4)本研究未检测神经功能缺损相关的特异性标志物,无法探究CTRP1和该类标志物间的相关性;(5)本研究对照组和AIS组的患者基线资料不匹配,AIS组患者具有更多的心脑血管危险因素,可能造成对照组和AIS组患者CTRP之间差异更加显著。
综上所述,CTRP1水平与AIS患者晚期神经功能缺损严重程度密切相关,患者血清CTRP1表达水平愈高,其神经功能缺损愈严重。或许CTRP1可以作为生物标志物对AIS患者神经功能严重程度进行评估的有效指标,与其他危险因素共同参与评估AIS病变严重程度。并且有助于对疾病进行早期筛查,及时采用个性化治疗。
[1]陈伟伟,高润霖,刘力生,等.《中国心血管病报告2017》概要[J].中国循环杂志,2018,33(1):1-8.
[2]DEGUCHI I,HAYASHI T,FUKUOKA T,et al.Features of cardioembolic stroke with persistent and paroxysmal atrial fibrillation-a study with the Japan Stroke Registry[J].Eur J Neurol,2015,22(8):1215-1219.
[3]XU G L,LIU X F,WU W T,et al.Recurrence after ischemic stroke in chinese patients:impact of uncontrolled modifiable risk factors[J].Cerebrovasc Dis,2007,23(2-3):117-120.
[4]RODRIGUEZ S,LEI X,PETERSEN P S,et al.Loss of CTRP1 disrupts and lipid homeostasis[J].Am J Physiol Endocrinol Metab,2016,311(4):E678-E697.
[5]CHALUPOVA L,ZAKOVAKA A,ADAMOVA K.Development of a novel enzyme-linked immunosorbent assay(ELISA)for measurement of serum CTRP1:A pilot study:Measurement of serum CTRP1 in healthy donors and patients with metabolic syndrome[J].Clin Biochem,2013,46(1-2):73-78.
[6]中华医学会神经病学分会.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[7]李瑞英,陈会生.急性缺血性脑卒中早期神经功能恶化研究现状及进展[J].临床军医杂志,2017,45(2):136-139.
[8]LYTTON W W,ARLE J,BOBASHEV G,et al.Multiscale modeling in the clinic:diseases of the brain and nervous system[J].Brain Inform,2017,4(4):219-230.
[9]庄雪芬,林贵德.早期大剂量阿托伐他汀对缺血性脑卒中患者血脂、hs-CRP的影响[J].中国当代医药,2015,22(5):141-143.
[10]ZHANG J,FU B,ZHANG X,et al.Bicyclol upregulates transcription factor Nrf2,HO-1 expression and protects rat brains against focal ischemia[J].Brain Res Bull,2014,100:38-43.
[11]童国相,刘慧霞.脂肪因子在代谢综合征中的作用新进展[J].中国医师杂志,2014(4):562-565.
[12]WANG X Q,LIU Z H,XUE L,et al.C1q/TNF-related protein 1 links macrophage lipid metabolism to inflammation and atherosclerosis[J].Atherosclerosis,2016,250:38-45.
[13]PETERSON J M,AJA S,WEI Z,et al.CTRP1 protein enhances fatty acid oxidation via AMP-activated protein kinase(AMPK)activation and acetyl-CoA carboxylase(ACC)inhibition[J].J Biol Chem,2012,287(2):1576-1587.
[14]LU L,ZHANG R Y,WANG X Q,et al.C1q/TNF-related peotein-1:an adipokine marking and promoting atherosclerosis[J].Eur Heart J,2016,37(22):1762-1771.
[15]YUASA D,OHASHI K,SHIBATA R,et al.C1q/TNF-related protein-1 functions to protect against acute ischemic injury in the heart.[J].FASEB J,2016,30(3):1065-1075.
[16]AKIYAMA H,FURUKAWA S,WAKISAKA S,et al.Cartducin stimulates mesenchymal chondroprogenitor cell proliferation through both extracellular signal-regulated kinase and phosphatidylinositol 3-kinase/Akt pathways[J].FEBS J,2006,273(10):2257-2263.
[17]钟波,唐丙俭,柳霞.血浆超敏C-反应蛋白与急性缺血性脑卒中临床结局的相关性[J].实用医学杂志,2017,33(7):1050-1054.

