IL-17E和IL-17F及其受体在结直肠癌组织中的表达及其意义
杨学良,孙雪梅,赵晓晖,杨丽娟,沈维高,肖梓屾,郭 冲,刘艳波
(1.北华大学附属医院普外科,吉林 吉林132012; 2.北华大学基础医学院病理生理学教研室,吉林 吉林 132013;3. 吉林省东丰县中医院急诊科,吉林 东丰 136300;4.吉林医药学院附属医院外科,吉林 吉林 132011)
结直肠癌是最常见的消化系统恶性肿瘤,与年龄、性别、家族史和食用大量红肉等因素有关联[1-2],但其发生发展及转移机制尚不清楚。本课题组前期工作[3]证实:结直肠癌中白细胞介素17A(interleukin-17A,IL-17A)及白细胞介素17RA(interleukin-17RA,IL-17RA)表达水平明显升高,并呈正相关关系。
白细胞介素17E(interleukin-17E,IL-17E)(亦称IL-25)是IL-17家族成员的一个重要亚型,主要由Th2细胞、肥大细胞和巨噬细胞分泌。白细胞介素17RB(interleukin-17RB,IL-17RB)是IL-17E的主要受体,表达于淋巴细胞、肺成纤维细胞和气道平滑肌等组织[4]。IL-17E可与IL-17RB结合,通过系列信号转导过程,在气道炎症、过敏性疾病和自身免疫性疾病中发挥主要作用[5],但其与肿瘤关系,尤其是与直结肠癌的关系研究较少。白细胞介素17F(interleukin-17F,IL-17F)主要由Th17细胞、NK细胞、中性粒细胞和γ、δ、T细胞等分泌,IL-17F可与其受体白细胞介素17RC(interleukin-17RC,IL-17RC)(主要表达于脂肪细胞、成纤维细胞和上皮细胞等)或IL-17RA结合,在类风湿性关节炎、炎症性肠病和哮喘中发挥作用[6-7],但与肠癌的关系尚未见相关报道。
本研究通过对比IL-17E及其受体IL-17RB、IL-17F及其受体IL-17RC在肠炎、肠息肉和肠癌组织中表达的差异,分析其相关性及其与结直肠癌恶性度的关系,为直结肠癌的诊治提供一定的实验基础。
1 资料与方法
1.1 标本来源 本研究所用标本均来自北华大学附属医院和吉林省吉林市人民医院,所有操作均符合伦理学要求(经医院伦理委员会批准)。本研究收集肠炎患者标本15例(肠镜活检获得),其中男性11例,女性4例,平均年龄(50.0±10.3)岁;肠增生性息肉患者标本5例(肠镜活检或手术切除获得),其中男性4例,女性1例,平均年龄(55.0±13.4)岁;结直肠腺癌患者标本30例(肠镜活检或手术切除获得),其中男性21例,女性9例,平均年龄(60.0±14.5)岁。所有患者术前均未行放、化疗,术后经病理学专家均做出明确病理诊断。
1.2 主要试剂和仪器 兔抗IL-17E(1∶4 000)、兔抗IL-17RB(1∶200)、兔抗IL-17F(1∶1 000)和鼠抗IL-17RC(1∶50)均为美国Novus Biologicals公司产品,二抗通用型PV9000试剂盒为北京中杉金桥试剂公司产品,DAB显色液为北京中杉金桥试剂公司产品,其他试剂均为国产分析纯。显微镜(日本奥林巴斯公司),图像处理系统(美国Image pro plus公司),电子天平、磁力搅拌器、酸度计、移液器、电热鼓风干燥箱、灭菌锅和台式低速离心机等均为国产设备(常州市亿能实验仪器厂)。
1.3 免疫组织化学法观察肠炎、肠息肉和肠癌组织中IL-17E、IL-17RB、IL-17F和IL-17RC的表达 5 μm厚的组织标本以常规二甲苯脱蜡,梯度酒精脱水;PBS漂洗3次,每次3 min,蒸馏水冲洗2次后待用;利用高温高压法进行抗原修复(修复液为pH 6.0的0.01 mmol·L-1柠檬酸缓冲液),自然冷却至室温后PBS漂洗3次;1% H2O2溶液灭活内源性过氧化物酶;滴加特异性一抗溶液,常温孵育过夜,PBS漂洗3次,每次3 min;滴加辣根过氧化物酶标记的二抗,常温孵育30 min,PBS漂洗后DAB显色,自来水充分冲洗后,苏木素溶液轻度复染,常规梯度酒精脱水,二甲苯透明,干燥,中性树胶封片。
1.4 染色结果判定标准 当目标着色,且棕黄色颗粒高于本底色时定为阳性,每种抗体染色时间固定。在200倍显微镜下连续拍摄每一张组织切片,IL-17E、IL-17RB、IL-17F和IL-17RC阳性表达率计算方法:阳性表达率=阳性面积/整个染色切片面积×100%。
1.5 统计学分析 采用SPSS10.0 for Windows统计软件进行统计学分析。肠炎、肠息肉和肠癌组织中IL-17E、IL-17RB、IL-17F和IL-17RC阳性表达率比较采用Mann-Whitney U检验,IL-17E与其受体IL-17RB、IL-17F与其受体IL-17RC阳性表达率相关性分析采用Pearson相关分析法。以P<0.05为差异有统计学意义。
2 结 果
2.1 IL-17E在3种肠组织中的表达 IL-17E在上述3种组织中染色均呈阳性,染色阳性颗粒呈棕黄色,其主要分布在单核细胞、腺上皮细胞、血管内皮细胞、部分癌细胞的细胞质和细胞核。肠炎、肠息肉及肠癌组织中IL-17E阳性表达率分别为(9.17±1.36)%、(12.94±3.28)%和(7.66±2.46)%。与肠炎和肠息肉组织比较,IL-17E在肠癌组织中呈低表达(P<0.05)。IL-17E在3种肠组织中的表达见图1(插页四)。
2.2 IL-17E受体IL-17RB在3种肠组织中的表达 IL-17RB阳性颗粒亦呈棕黄色,主要表达于腺上皮细胞胞浆、间质内单核细胞、血管内皮细胞及部分癌细胞的胞浆中。肠炎、肠息肉及肠癌组织中IL-17RB阳性表达率分别为(7.63±1.51)%、(6.08±1.22)%和(4.08±1.35)%;与肠炎和肠息肉组织比较,肠癌组织中IL-17RB呈低表达(P<0.05),但肠炎与肠息肉组织中IL-17RB阳性表达率比较差异无统计学意义(P>0.05)。见图1(插页四)。
2.3 IL-17F在3种肠组织中的表达 IL-17F在肠炎、肠息肉和肠癌组织中染色均为阳性,阳性颗粒呈现棕黄色,主要分布在单核细胞、腺上皮细胞、血管内皮细胞及部分癌细胞的胞浆及胞核中。肠炎、肠息肉及肠癌组织中IL-17F阳性表达率分别为(4.26±1.36)%、(8.18±2.58)%和(6.72±1.98)%;与肠炎组织比较,肠癌和肠息肉组织中IL-17F阳性表达率明显升高(P<0.01)。见图2(封三)。
2.4 IL-17F受体IL-17RC在3种肠组织中的表达 IL-17F的相关受体IL-17RC阳性颗粒亦呈棕黄色,主要表达于腺上皮、间质内单核细胞、血管内皮细胞、部分癌细胞的胞浆及胞核中。肠炎、肠息肉及肠癌组织中IL-17RC阳性表达率分别为(3.23±1.55)%、(4.77±2.20)%和(7.88±1.34)%;与肠炎组织比较,肠癌组织中IL-17RC呈高表达(P<0.05)。见图2(封三)。
2.5 肠癌组织中IL-17F与其受体IL-17RC的相关性 将IL-17E与其受体IL-17RB、IL-17F与其受体IL-17RC蛋白阳性表达率分别行Pearson相关分析,结果显示:肠癌组织中IL-17F阳性表达率与IL-17RC阳性表达率呈正相关关系(r=0.667,P=0.001)。见图3。
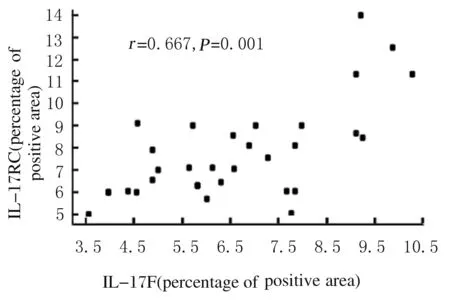
图3 肠癌组织中IL-17F与IL-17RC表达的相关性
Fig.3 Correlation between expressions of IL-17F and IL-17RC in colonrectal carcinoma tissue
2.6 不同临床病理参数患者肠癌组织中IL-17E和IL-17F阳性表达率 肠癌组织中IL-17E阳性表达率随疾病恶性度升高而降低(P<0.05),但IL-17F阳性表达率随疾病恶性度升高而升高(P<0.05)。见表1。
3 讨 论
细胞因子与消化道恶性肿瘤的关系是近年来研究的热点问题。由单个核细胞、血管内皮细胞和腺上皮细胞等分泌及表达的IL-17家族(包括配体及受体)与恶性肿瘤的关系研究[8]发展迅速。IL-17家族成员包括IL-17A、IL-17B、IL-17C、IL-17D、IL-17E和IL-17F 6种配体及IL-17RA、IL-17RB、IL-17RC、IL-17RD和IL-17RE 5种不同的受体[9]。IL-17家族成员在抗肿瘤免疫及促进血管生成方面具备双面性,一方面能通过激活自然杀伤细胞和细胞毒T细胞发挥抗肿瘤效应,另一方面通过上调血管内皮生长因子(vascular endothelial growth factor,VEGF)等表达增强恶性肿瘤血管生成发挥促瘤效应[10]。IL-17A具有明显促进恶性肿瘤发生发展作用。本课题组前期工作[3,11-12]表明:IL-17A具有促进结直肠癌、前列腺癌及膀胱癌发生发展的作用。IL-17F与IL-17A大约有50%结构同源,两者均可以通过其受体IL-17RC和(或)IL-17RA结合,激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、核因子kappa B (NF-κB) 以及CCAAT盒/增强子结合蛋白(CCAAT-enhancer binding protein,C/EBP)信号转导途径影响肿瘤的发生发展[13],因此有必要了解IL-17F与结直肠癌的关系。
表1 不同临床病理参数结直肠癌患者肠癌组织中IL-17E和IL-17F阳性表达率
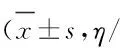
Tab.1 Positive expression rates of IL-17E and IL-17F in colorectal carinoma tissues of patients with clinicopathological parameters %)
为了进一步明确IL-17E、IL-17F及其受体IL-17RB和IL-17RC在不同肠组织中的表达差异,本研究采用免疫组织化学染色法检测上述4种IL-17家族成员在肠炎、增生性肠息肉和结直肠腺癌组织中表达差异的结果显示:IL-17F在肠炎、肠息肉和肠癌组织中均有表达,阳性染色见于单核细胞(主要是淋巴细胞)、血管内皮细胞和腺上皮细胞的胞浆或胞核中,部分肠癌细胞也有表达,表明IL-17F在肠组织内来源细胞较多,参与肠黏膜炎症、良性增生性息肉和结直肠癌发生发展。正常机体结肠中寄生大量微生物,参与结直肠内环境稳态的维持,一旦这种稳态遭到破坏,会导致肠道菌群失调,诱导大量的炎症细胞浸润,如中性粒细胞、淋巴细胞、巨噬细胞和肥大细胞等,这些炎症细胞分泌大量的细胞因子(如IL-17家族成员)和炎症介质,如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)和转化生长因子β(transforming growth factor-β,TGF-β)等),进而诱发结肠癌的发生。研究[14]表明:IL-17F可诱导肿瘤微环境中成纤维细胞、血管内皮细胞和腺上皮细胞产生和释放炎症因子如TNF、IL-6和粒细胞巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)等,IL-17F还可诱导趋化因子和基质金属蛋白酶的产生。虽然IL-6在恶性肿瘤早期具有抗肿瘤效应,但在晚期可通过IL-6-stat3途径发挥促瘤效应[15]。此外,IL-17F还可诱导上皮细胞产生细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM-1),ICAM-1具有促进恶性肿瘤的侵袭及淋巴转移效应[16]。
IL-17E亦称为IL-25,是IL-17家族成员另一个重要亚型,与IL-17A具有29%~50%同源性。在过敏性疾病、免疫性疾病和中枢神经系统疾病中研究较多,在消化道恶性肿瘤领域研究[17]较少。IL-17E通过结合IL-17RB与IL-17RA形成的异源二聚体,通过复杂的信号转导过程引起下游基因转录,产生生物学效应。本课题组前期工作[11-12]证实:IL-17E和IL-17RB在前列腺癌和膀胱癌组织中均呈阳性表达,为了验证其在结直肠癌发生发展中的作用,本实验采用免疫组织化学染色法检测IL-17E及其受体IL-17RB在肠炎、增生性肠息肉和结直肠腺癌组织中的表达差异,结果显示:IL-17E在肠炎和肠息肉组织中分泌量高于肠癌组织,从某一侧面反映IL-17E促进炎细胞浸润,进而增加炎症因子水平,促进炎症的发生发展;同时,由于炎症反应增强,导致肠黏膜上皮细胞反应性增生,导致息肉;研究[18]显示:IL-17E可能具有抑癌效应,其发生机制可能与中性粒细胞聚集有关,因为利用IL-17E特异性阻断剂,患有炎症性肠病的小鼠更易患直结肠癌。良性的乳腺上皮细胞释放IL-17E可诱导乳腺癌的凋亡。另外,本课题组前期工作[15]证实在良性前列腺增生、膀胱炎和膀胱息肉组织中IL-17E的表达水平亦升高,且伴有炎细胞的浸润,而前列腺癌及膀胱癌组织中IL-17E表达水平反而降低,在人源性移植瘤如黑色素瘤、乳腺癌和胰腺癌等肿瘤中,注射IL-17E具有抗肿瘤效应[19],根据以上研究结果本文作者推断:IL-17E在实体恶性肿瘤中可能发挥抗癌效应,可作为肿瘤治疗的新型靶点。但IL-17E对结直肠癌的抑制作用及其机制尚需进一步探讨。
本研究结果显示:IL-17F和IL-17RC在肠癌组织中的表达呈正相关关系,说明在肠黏膜细胞癌变后,其分泌的细胞因子IL-17F和IL-17RC均增加,通过IL-17F-IL-17RC信号转导途径对结直肠癌的发生发展发挥效应,但其具体机制尚需进一步研究。为进一步确定IL-17E和IL-17F在结直肠癌组织中的表达对癌症发生发展和转移的意义,本研究将IL-17E和IL-17F表达与结直肠腺癌病理分级及肿瘤浸润等临床病理参数进行统计学分析的结果提示:结直肠癌分化程度越差,IL-17E阳性表达率越低,而IL-17F阳性表达率越高;结直肠癌中IL-17E和IL-17F的表达与肿瘤TNM分期有密切关联,IL-17E阳性表达率随肿瘤组织浸润程度加深逐渐降低,而IL-17F阳性表达率呈逐渐升高趋势。肿瘤的病理分级和临床分期是临床评价患者预后的重要指标,因此结直肠癌组织中IL-17E和IL-17F的表达情况在一定程度反映了恶性肿瘤的进展程度。结直肠癌组织中IL-17E表达降低而IL-17F表达异常升高提示肿瘤浸润和恶性发展的概率可能更高,预后更差。
综上所述, IL-17E和IL-17F在肠相关疾病中的表达有差异,且与肠癌恶性度有关联。因此,检测IL-17E和IL-17F在结直肠癌组织中的表达对患者的诊断和预后评估有较高的参考价值,但其具体机制仍需进一步探讨。本研究的不足之处:一是由于标本来源限制,未能获得完全正常的肠黏膜组织,无法判断正常肠黏膜组织中IL-17E、IL-17RB、IL-17F和IL-17RC的表达情况;二是该结论来源于小样本,而且检测方法较单一,可能存在偏倚,因此还需要大样本观察及体内外的进一步实验进行论证。
[参考文献]
[1] 陈 琼,刘志才,程兰平,等.2003-2007年中国结直肠癌发病与死亡分析[J].中国肿瘤,2012,21(3):179-182.
[2] Jess T,Rungoe C,Peyrin-Biroulet L.Risk of colorectal cancer in patients with ulcerative colitis: a meta-analysis of population-based cohort studies [J].Clin Gastroenterol Hepatol,2012,10(6):639-645.
[3] 杨学良,孙雪梅,赵晓晖,等.白细胞介素-17A及其受体与巨噬细胞在肠癌、肠炎和肠息肉组织中表达及意义[J].中国老年学杂志,2018,38(1):1-3.
[4] Tang W,Smith SG,Salter B,et al.Allergen-induced increases in interleukin-25 and interleukin-25 receptor expression in mature eosinophils from atopic asthmatics[J].Int Arch Allergy Immunol,2016,170(4):234-242.
[5] Song X,Qian Y.IL-17 family cytokines mediated signaling in the pathogenesis of inflammatory diseases [J].Cell Signal,2013,25(12):2335-2347.
[6] Cua DJ,Tato CM.Innate IL-17-producing cells: the sentinels of the immune system[J].Nat Rev Immunol,2010,10(7):479-489.
[7] De Luca A,Pariano M,Cellini B,et al.The IL-17F/IL-17RC axis promotes respiratory allergy in the proximal airways [J].Cell Rep,2017,20(7):1667-1680.
[8] Qian X,Chen H,Wu X,et al.Interleukin-17 acts as double-edged sword in anti-tumor immunity and tumorigenesis [J].Cytokine,2017,89(1):34-44.
[9] Gaffen SL.Recent advances in the IL-17 cytokine family [J].Curr Opin Immunol,2011,23(5):613-619.
[10]Ibrahim S,Girault A,Ohresser M,et al.Monoclonal antibodies targeting the IL-17/IL-17RA axis: an opportunity to improve the efficiency of anti-VEGF therapy in fighting metastatic colorectal cancer ? [J].Clin Colorectal Cancer,2018,17(1):e109-e113.
[11]Liu Y,Zhao X,Sun X,et al.Expression of IL-17A,E,and F and their receptors in human prostatic cancer: Comparison with benign prostatic hyperplasia [J].Prostate,2015,75(16):1844-1856.
[12]Liu Y,Yang W,Zhao L,et al.Immune analysis of expression of IL-17 relative ligands and their receptors in bladder cancer: comparison with polyp and cystitis [J].BMC Immunol,2016,7(1):36.
[13]Wei L,Liu M,Xiong H,et al.Up-regulation of IL-23 expression in human dental pulp fibroblasts by IL-17 via activation of the NF-κB and MAPK pathways[J].Int Endod J,2017,6(10):1111.
[14]Iwakura Y,Ishigame H,Saijo S,et al.Functional specialization of interleukin-17 family members [J].Immunity,2011,34(2):149-162.
[15]Hu Z,Luo D,Wang D,et al.IL-17 activates the IL-6/STAT3 signal pathway in the proliferation of hepatitis B virus-related hepatocellular carcinoma[J].Cell Physiol Biochem,2017,43(6):2379-2390.
[16]Roland CL,Harken AH,Sarr MG,et al.ICAM-1 expression determines malignant potential of cancer [J].Surgery,2007,141(6):705-707.
[17]Xu M,Dong C.IL-25 in allergic inflammation [J].Immunol Rev,2017,278(1):185-191.
[18]Thelen TD,Green RM,Ziegler SF.Acute blockade of IL-25 in a colitis associated colon cancer model leads to increased tumor burden [J].Sci Rep,2016,6(5):25643.
[19]Gelaleti GB,Borin TF,Maschio-Signorini LB,et al.Efficacy of melatonin,IL-25 and siIL-17B in tumorigenesis-associated properties of breast cancer cell lines [J].Life Sci,2017,183(8):98-109.

