AIT生物包装调控蓝莓货架品质及抗氧化活性研究
吴 韬,袁 旭,王庆慧,李明元,吴胜勇,伍小宇,李伟丽,2,3*
(1.西华大学食品与生物工程学院,四川 成都 610039; 2.天津科技大学食品营养与安全重点实验室,天津 300457;3.天津捷盛东辉保鲜科技有限公司,天津 300300)
近年来,食品货架保鲜包装逐渐趋向于来源天然、抗菌防腐、环境友好型的绿色产品。前期研究[1]证实,将农业加工副产物甜菜皮渣与生物原料聚乳酸经热塑加工可得到热塑性膜基材(PLA/TSBP)。高纤维热塑粒子降低聚乳酸玻璃态转变温度,改善其单一聚乳酸膜的柔韧性能,生物膜基材PLA/TSBP可满足食品包装对机械性能和热化学性能的要求,作为保鲜基材使用。
异硫氰酸烯丙酯(ally isothiocyanate, AIT)提自十字花科植物,是硫葡萄糖苷酶和黑芥子硫苷酸钾水解产物。研究[2-3]报道,AIT熏蒸处理显著抑制梨果青霉菌,但因AIT的强刺激性和挥发性,直接使用往往对果皮组织造成不可逆转的伤害。理想途径是将AIT通过吸附载体作为抑菌涂层引入保鲜包装材料表面或与其内部分子结合,达到缓释效果,实现较长期抑菌保鲜功效[1-3]。AIT精油的载体广泛集中于多糖和多肽类化合物如玉米淀粉、大豆蛋白、壳聚糖等。研究[1]表明,AIT/壳聚糖涂层的聚乳酸-甜菜皮渣(PLA/TSBP)生物保鲜膜在液体培养基中对李斯特菌和沙门氏菌等病原性致病菌具有较强的抑制作用,但是对于鲜活果实货架期保鲜品质和抗氧化研究鲜见报道。
蓝莓果质温和细腻,富含对人体有益的花色苷、黄酮等生物活性成分,被誉为“浆果之王”,是国际粮农组织推荐的人类5大健康食品之一[10]。但蓝莓贮藏周期极短,常温仅5~7 d,因其皮嫩多汁,货架期极易受真菌危害、腐烂劣变、品质下降、生物活性锐减,严重限制了蓝莓产业发展。本试验旨在利用具有AIT/壳聚糖抑菌涂层的新型可降解生物膜PLA/TSBP,结合蓝莓货架保鲜缓释模拟设备,考察此生物膜作为生鲜食品包装对蓝莓货架期生物品质的调控作用,为环保型生物膜的发展及保鲜包装模式提供一定的参考。
1 材料与方法
1.1 活性包装抑制蓝莓真菌试验
1.1.1 菌种制备
青霉菌和灰霉菌从腐烂的蓝莓果实经过分离纯化获得。2种真菌保存在-20 ℃马铃薯葡萄糖琼脂培养基(PDA)。活化时,用接种环挑取菌丝培养于马铃薯葡萄糖液体培养基,室温振荡24 h。菌种孢子悬浮液经高速离心机10 000 r/min离心10 min。去除上清液,沉淀经30 mL 的0.1%蛋白胨水制备成悬浮液,使最终孢子数量达到104CFU/mL。
1.1.2 抑菌试验
1.1.2.1 生物保鲜膜制备
试验用生物膜制备参照文献[1],简要制备流程为:甜菜皮渣、甘油和水以质量比5 ∶1 ∶1不断混合至均匀,室温密封8 h。利用同步旋转双螺杆挤出机(Leistritz ZSE-18,美国)将甜菜皮-甘油混合物熔融挤出制得具有热塑性的甜菜皮(TSBP)。将聚乳酸/TSBP混合料(50/50;m/m)混匀,加入同型双螺旋挤出机熔融共挤得到生物膜基材。将载体壳聚糖和生物抑菌因子AIT(纯度>98%,美国Sigma公司)以1 ∶1(mg/mL)加入体积分数为1%的乙酸溶液混匀制备活性抑菌涂层,通过涂布和高压压膜将其固定于基材表面,制备好的包装膜AIT面密度为8.16 μL/cm2。活性生物膜(以下简称AIT包装)如图1所示。

图1 AIT涂层生物包装缓释保鲜装置
1.1.2.2 模拟缓释保鲜装置
挑选同批次色泽、大小一致的新鲜健康蓝莓果(超市自购)浸泡于0.1%次氯酸钠溶液中,2 min捞出,单层平铺在通风橱中晾30 min。将蓝莓果浸泡在1.1.1中真菌悬浊液3 min,取出自然放置至表面无多余水分。取浸泡接种真菌蓝莓,16个为1组摆放在无菌玻璃平板(4 cm×8 cm)上,将此平板放入平放的体积为1 L无菌玻璃罐内;用双面胶固定AIT活性包装(2×8 cm,初始AIT面密度8.16 μL/cm2)在玻璃罐内壁,有抑菌层的一面向外(如图1)。
AIT浸渍滤纸处理组(以下简称AIT精油):取包装膜同等尺寸滤纸,将精油和乙醇以体积比为1 ∶1溶液浸入滤纸,使其充分吸收的AIT与活性包装AIT面密度一致。 将AIT滤纸快速固定在玻璃内壁,玻璃罐内放相同菌液处理的蓝莓,与AIT生物包装做对比。将玻璃罐密封,罐盖顶部钻有小孔,用塑胶圈密封,以方便试验期间检测顶空AIT面密度。
以空白玻璃罐处理样品对空白对照。所有试验处理组重复3次,每次3组平行,取平均值计算。
1.1.2.3 蓝莓真菌抑制效果测试
样品玻璃罐置于室温,24 h后将玻璃罐打开取出样品,放入组织均质袋中并加入与蓝莓同等质量的0.2%蛋白胨水均质2 min,用蛋白胨水对均质袋过滤后的滤液进行梯度稀释。经过青霉菌和灰霉菌感染的蓝莓果肉组织滤液梯度稀释,分别取100 μL涂布在马铃薯葡萄糖培养基(含50 mg/L的链霉素),室温培养生长3 d,收集青霉和灰霉菌的分生孢子,在无菌水中进行梯度稀释,通过8层过滤纱布,调整菌悬液最后浓度为104个/mL。用普通光学显微镜辅助以DigitCamera显微摄像镜头和血球计数板测量,统计每组平行实验病原菌抱子萌发率和芽管伸长度。每组实验观察50个孢子,试验重复3次。
1.2 蓝莓货架期品质测定
1.2.1 果实腐烂率
蓝莓表面出现腐烂霉点的果实视为腐烂果。腐烂率=(腐烂果/果实总数)×100%。
1.2.2 果实硬度
使用TA-XT2i质构仪测定,采用直径为3 mm探针穿透果实赤道线中部10 mm,速率为10 mm/s。每组试验测定5次,重复3次。采用Texture Expert version 1.22软件处理数据,选取测量最大值表示蓝莓硬度。
1.2.3 果实糖类和有机酸含量
蓝莓果肉样品4 g加入20 mL咪唑缓冲液(20 mmol/L,pH7.0)均质混合。化合物提取、纯化、和水解方法参照Wang等[12]方法。糖类和有机酸的分离采用安捷伦6890N GC高效气相色谱仪分析测试,仪器配有离子火焰检测器和弹性石英毛细管柱(12 m×0.2 mm)。本文用样品出峰与对照品峰面积之比计算各物质的相对含量。
1.3 蓝莓生物活性含量测定
1.3.1 蓝莓样品前处理方法
取16个未经任何处理的蓝莓放入玻璃平板上,罐内壁固定AIT生物包装膜或固定AIT滤纸片或无任何处理。24 h后打开玻璃罐取出蓝莓,16个果实为1组放入塑料盒中(2.0 cm×15 cm×10 cm),在4 ℃下贮存15 d,定期取出蓝莓果实进行生物活性物质测定。每组试验平行重复3次,每次3组平行。
将各组样品的蓝莓果实用液氮研磨,冷冻干燥至恒重。取5.0 g冻干粉末样品,加入25 mL 乙酸甲醇提取液(V甲醇∶V水∶V乙酸=80 ∶19 ∶1),置于锥形瓶中,超声提取10 min,5 000 r/min离心15 min。上清液经0.45 μm 滤膜过滤,提取液保存在-80 ℃冰箱中备用。提取液用于总黄酮含量、总酚、总花青素含量以及抗氧化能力等检测。
1.3.2 总黄酮含量
总黄酮含量采用比色法测定[6]。以蒸馏水作为空白对照,在波长520 nm处读取吸光度值。结果表示每克干物质含有儿茶素当量的毫克量,mg catechin equivalent (CE)/g 干物质(DW)。
1.3.3 总酚含量
总酚含量(total phenolic content,TPC)采用斐林试剂法测定[5]。利用紫外-可见全光谱酶标仪测定波长765 nm的吸光度值,以甲醇溶液作为空白对照,以质量浓度为20~100 μg/mL的没食子酸做标准曲线,计算总酚含量,表示为每克干重中没食子酸当量的毫克量,即mg gallic acid equivalent (GAE) / 100 g (DW)。
1.3.4 花青素含量测定
果实花青素含量参照Wolfe等的方法[7]。利用pH差异法:样品分别溶于pH 1.0和pH 4.5的缓冲溶液,测得各自在510 nm和700 nm下的吸光值。吸光值用摩尔消减系数26 900和吸光值A=[(A510-A700)pH1.0-(A510-A700)pH4.5 ]转化为矢车菊素-3-葡萄糖苷毫克数。总花青素含量表示为:mg 转化为矢车菊素-3-葡萄糖苷/100g DW。
1.3.5 总抗氧化能力测定
本文以2,2-Di (4-tert-octylphenyl)-1-picrylhydrazyl (DPPH) 分析方法测定蓝莓果实的总抗氧化能力(参照文献中方法[8])。5 mL 0.1 mmol/L DPPH-甲醇溶液与10 mL的蓝莓果实提取液/甲醇混合。溶液室温下避光保存30 min,测得517 nm下吸光值减少量。对照组用甲醇代替甲醇提取物,空白组用甲醇代替DPPH溶液。
1.4 数据统计
采用SPSS 16.0 软件对数据进行整理统计分析,各项指标结果以“平均数(n=3)±标准误差”表示,Duncan氏多重比较差异显著性分析。
2 结果与分析
2.1 不同处理方法对蓝莓真菌抑制效果的影响
表1为3种不同处理方法(AIT包装、AIT精油、对照)对蓝莓真菌抑制效果。如表1所示,AIT包装和AIT精油均抑制青霉和灰霉菌孢子的生长。室温下培养3 d,对照组青霉发芽率为96%,芽管长度为98 μm,而AIT精油和AIT包装组的发芽率分别仅为5%和15%,两种样品均显著低于对照。AIT精油组青霉菌芽管长度是AIT包装组的1/15。抑制效果显著优于后者。灰霉菌的发芽率在3组果实中分别为92%(对照)、10%(AIT精油)和26%(AIT包装),三者芽管长度分别为93、15和65 μm。结果表明:AIT精油组对青霉和灰霉孢子繁殖抑制效果最佳;AIT包装膜通过缓释也达到了控制青霉和灰霉繁殖扩散的目的。
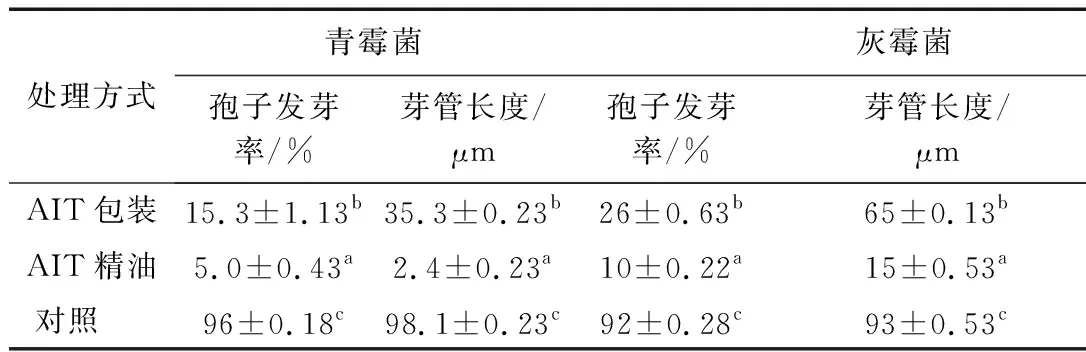
表1 不同处理方法对蓝莓青霉菌和灰霉菌孢子发芽率和芽管长度的影响
蓝莓果实表皮层稀薄软嫩,自带真菌孢子,采后预处理环节不及时,极易受到真菌的侵染,导致果实快速腐烂。青霉菌和灰霉菌是引起蓝莓腐烂最严重的致病真菌。研究表明,AIT具有广谱抑菌杀菌的能力,对果蔬真菌的控制起到积极的作用。Chanjirakul等[16]报道AIT熏蒸处理降低了草莓、树莓、黑莓等浆果的腐烂劣变程度,最小抑菌质量浓度分别为细菌34~110 ng/mL,酵母菌16~37 ng/mL,霉菌16 ~ 62 ng/mL。研究报道真菌所需最小AIT抑菌质量浓度为3.8~118 μg/mL。说明同一属的腐烂菌存在最小抑菌浓度差异[11]。本研究中AIT包装膜和AIT精油处理时初始面密度约为8.16 μL/cm2,两者对青霉菌抑制效果均优于灰霉菌。在货架期前3 d,不论是青霉还是灰霉菌,AIT精油都显著高于AIT包装效果,可能是活性包装中的抗菌因子AIT通过壳聚糖结合嵌入生物膜表面,达到缓慢释放、长效抑菌效果。
2.2 不同处理货架期果实品质
2.2.1 果实腐烂率
如图2所示,AIT包装和AIT精油处理显著抑制了冷藏蓝莓腐烂率。对照果实在第3天检出少量的腐烂果。AIT包装组在第6天发现腐烂果; AIT精油组在9 d内未发现果实腐烂。贮藏15 d,对照组果实腐烂率高达20%,AIT包装组腐烂率低于8%;AIT精油组蓝莓腐烂率仅4%,显著低于对照。蓝莓表面自带的腐烂菌数量一般低于104CFU/g,低浓度的AIT处理对果实表面微生物的繁殖起到显著抑制作用,利于后期贮藏加工。AIT被果皮表层细胞吸附,减少菌群扩张,但贮藏时间延长,有效成分损失殆尽,菌落复苏滋长,开始腐烂变质[12];因此,根据贮藏规模应及时调整AIT处理浓度和时间。
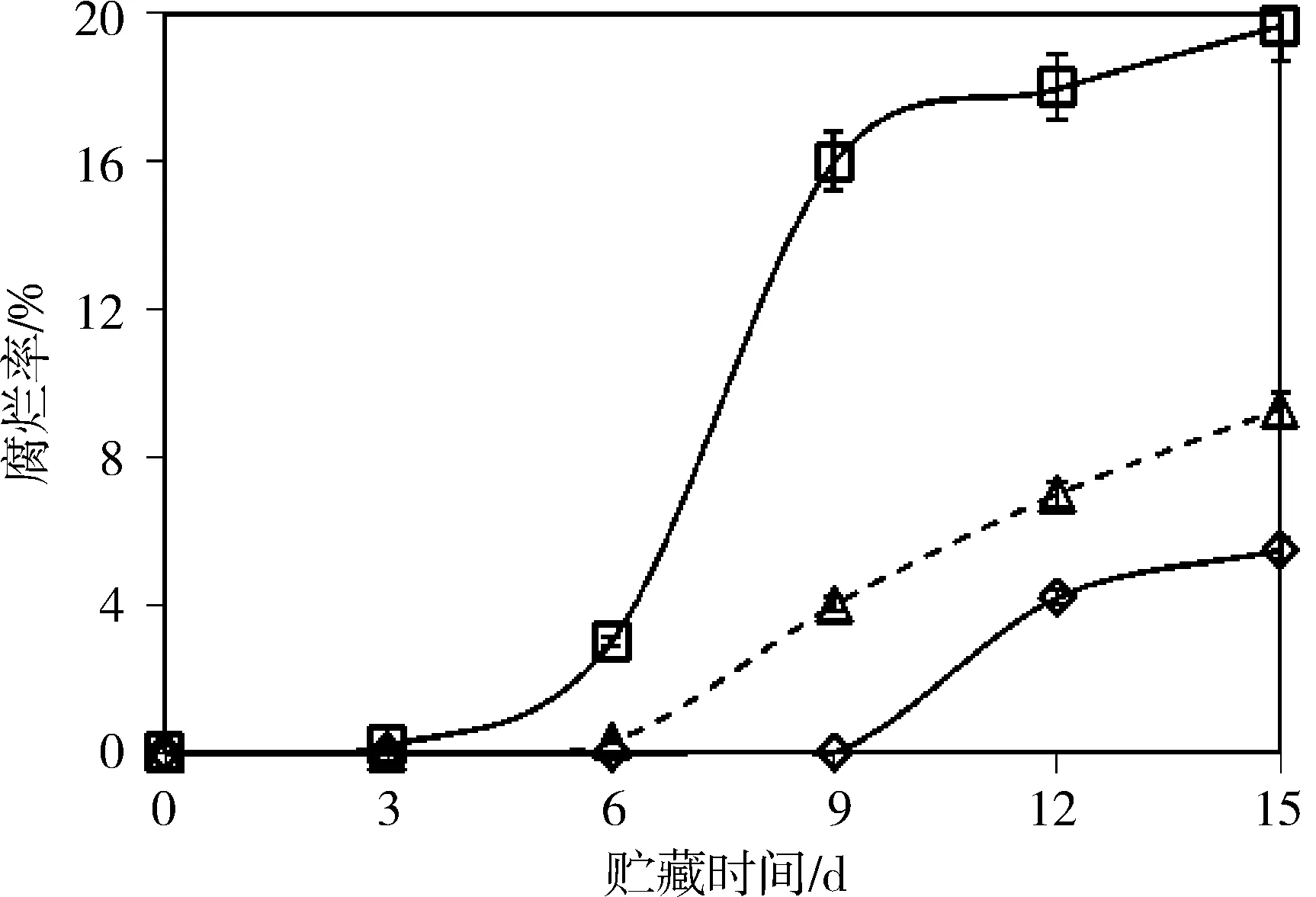
(□.空白对照;△.AIT包装;◇.AIT精油)
2.2.2 果实硬度、有机酸和糖类含量变化情况
如表2所示,AIT精油处理的蓝莓较对照果硬度显著降低,货架期结束,AIT精油组样品硬度较AIT活性包装组降低50%,果实松软、涣散。AIT包装处理对蓝莓硬度保持较好,在4 ℃货架期15 d为0.84 kg,较对照提高近1.5倍。研究[16-18]显示,精油不仅能够抑制多种细菌和霉菌,且含有多种酚类基团,能够提供抗氧化和清除自由基的因素,推迟果实氧化物质积累,维持果实硬度和光亮外表。
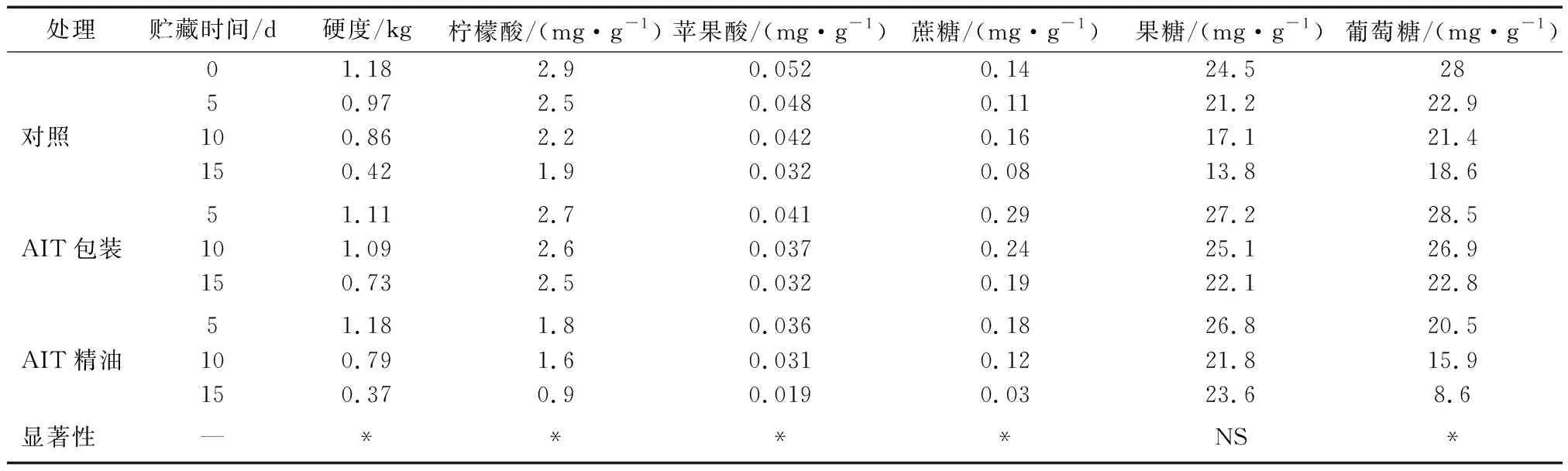
表2 不同处理方法对蓝莓果实硬度、有机酸和糖类含量的影响(4 ℃贮藏15 d)
由表2可知,柠檬酸是蓝莓果实含量最高的有机酸,为苹果酸的10倍之多。冷藏货架期间,2种酸的含量逐渐降低。其中苹果酸的降低幅度较明显,最多高达50%。AIT包装可够延缓2种有机酸的减少速度。AIT精油组有机酸含量损失较多,贮藏末期柠檬酸和苹果酸的含量均为对照的一半。AIT生物膜释放处理与对照的有机酸含量无显著差异。蓝莓果实主要糖类物质有3种,蔗糖、果糖和葡萄糖。果糖和葡萄糖所占比重较为接近,约为蔗糖含量的100倍以上。蓝莓处理后糖类物质略有减少,但降低程度很小。4 ℃贮藏15 d,与对照相比,AIT包装增加了蔗糖成分,对果糖和葡萄糖影响不大。AIT精油处理在贮藏前10 d糖类成分比较稳定,并且果糖成分维持较高,蔗糖和葡萄糖的含量只有对照的50%左右。
2.2.3 生物活性变化情况
蓝莓冷藏货架期间总黄酮含量如图3所示。AIT包装处理较好地维持了果实总黄酮含量,与对照相比略有减少。AIT精油处理蓝莓总黄酮水平损失最大,最低值仅2 mg CE/g DW,低于对照50%。原因可能是高浓度AIT对果实黄酮类物质代谢产生了负面效应,降低了生物活性物质的积累速度。浆果采后初期原花色苷和黄烷醇类生成积累,黄烷醇是果实成熟初期主要酚类物质,随着贮藏期延长含量降低,花色苷大量积累[13]。蓝莓花青素水平的升高与果实成熟后酚类与黄酮类水平降低相关。总黄酮含量在蓝莓果实贮藏过程中显著下降(P<0.05)。
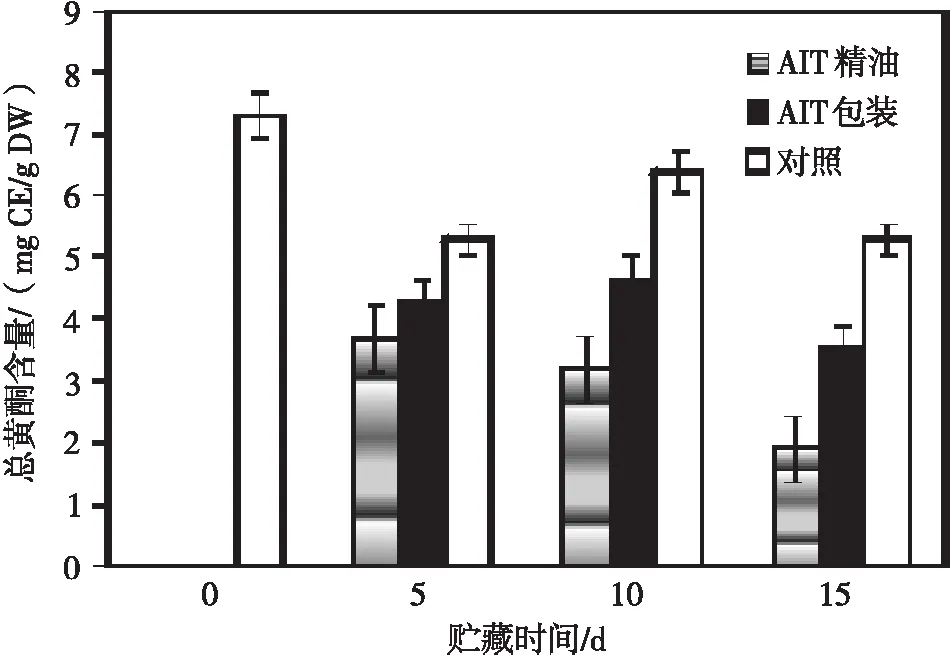
图3 不同处理方法对4 ℃下贮藏15 d蓝莓总黄酮含量的影响
如图4所示,蓝莓在贮藏前期总酚水平呈下降趋势,第10天含量增加,贮藏后期水平降低。与总黄酮类似,AIT生物膜有利于维持总酚物质的积累,但AIT精油处理破坏了果实酚类物质的代谢,影响了果实抗氧化体系的代谢功能。
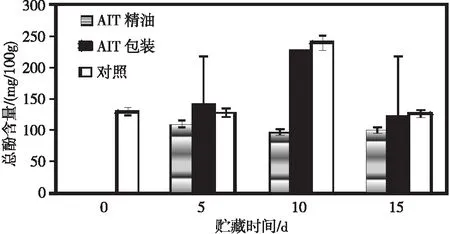
图 4 不同处理方法对4 ℃下贮藏15 d蓝莓总酚含量的影响
如图5所示,蓝莓果实在4 ℃贮藏15 d总花青素含量在第5天增加,之后维持平稳水平。AIT包装与对照果实比无显著差异(P>0.05)。AIT精油处理的蓝莓果实花青素水平显著降低(P<0.05),低于对照的1/3。蓝莓果实花青素在转色初期开始积累,含量不断上升。研究[14-16]表明,蓝莓和蔓越橘蓝莓在贮藏过程中总花青素含量和总酚水平会出现增加。小果形类果实如草莓、树莓和蓝莓等在0 ℃以上贮藏,经常出现生物活性成分(总黄酮、花色素、酚类)和抗氧化能力提高的现象。表明蓝莓采后继续合成了花青素和其他酚类物质。可溶性糖和有机酸的消耗可能为酚类物质合成提供了碳骨架。这些生物活性成分与果实总抗氧化能力密切相关。
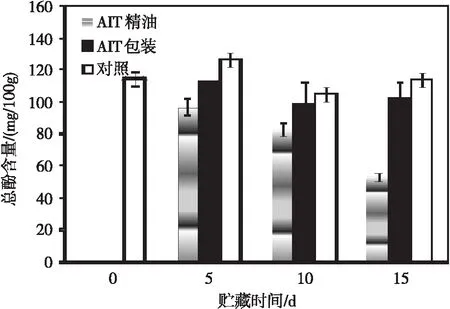
图5 不同处理方法对4 ℃下贮藏15 d蓝莓总花青素含量的影响
2.1.4 蓝莓果实总抗氧化能力变化情况
如图6所示,蓝莓果实4 ℃贮藏15 d DPPH不断下降。对照DPPH初始约为98 %,货架期结束含量降低了60%。AIT包装和AIT精油组果实成熟过程中DPPH显著下降,15 d分别达到30%和25 %,与对照比较,均有一定程度减少。花青素含量高的果实抗氧化能力最高峰出现在转色期。果实抗氧化能力与高抗氧化能力的咖啡酸等相关[19-20]。
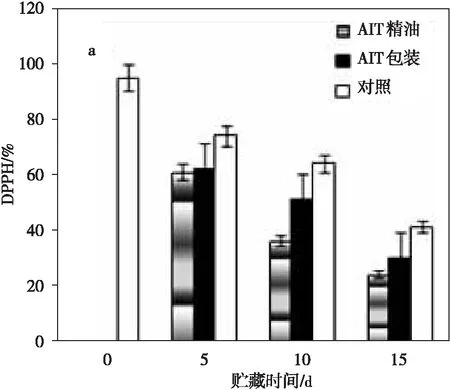
图6 不同处理方法对4 ℃下贮藏15 d蓝莓DPPH的影响
3 结论
本实验采用AIT涂层的聚乳酸/甜菜皮渣(PLA/TSBP)生物可降解包装膜,对蓝莓进行冷藏货架期保鲜研究。该生物包装膜可有效降低蓝莓真菌侵染,抑制青霉菌和灰霉菌等引发蓝莓果实腐烂的真菌病害扩展,进而降低果实腐烂率和延缓果实软化速度。与AIT精油处理对比,它能更有效维持蓝莓风味成分和营养物质,遏制果实中黄酮、多酚、花青素等生物活性组分的损失,保持了蓝莓货架期的优良品质。
参 考 文 献
[1]LI W L,COFFIN D R,JIN T Z,et al. Biodegradable composites from polyester and sugar beet pulp with antimicrobial coating for food packaging [J]. Journal of Applied Polymer Science,2012,126(1):362-373.
[2]LIM L T,TUNG M A. Vapor pressure of allyl isothiocyanate and its transport in PVDC/PVC copolymer packaging film [J]. Journal of Food Science,1997,62(5):1061-1062.
[3]CAO Xinang, HUANG Runze, Chen Haiqiang. Evaluation of pulsed light treatments on inactivation of Salmonella on blueberries and its impact on shelf-life and quality attributes [J]. International Journal of Food Microbiology, 2017,260: 17-26.
[4]HAN J H. Antimicrobial food packaging [M]. [S.l.]: Elsvier INC, 2003.
[5]TSAO R,YANG R,XIE S,et al. Which polyphenolic compounds contribute to the total antioxidant activities of apple [J]. Journal of Agricultural and Food Chemistry, 2005, 53(12):4989-4995.
[6]J ZHISHEN,T Mengcheng,W Jianming. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals [J]. Food Chemistry, 1999,64(4):555-559.
[7]WOLFE K,WU X Z,LIU R H. Antioxidant activity of apple peels[J]. Journal of Agricultural and Food Chemistry,2003,51(3):609-614.
[8]DIEGO Luna-vital, QIAN Li, LESLIE West, et al. Anthocyanin condensed forms do not affect color or chemical stability of purple corn pericarp extracts stored under different phs[J]. Food Chemistry 2017, 232:639-647.
[9]ROEVER D C.Microbiological safety evaluation and recommendations on fresh produce[J].Food Control,1998,9(6):321-347.
[10]CHANJIRAKUL K,WANG S Y,WANG C Y,et al. Effect of natural volatile compounds on antioxidant capacity and antioxidant enzymes in raspberries[J]. Postharvest Biology and Technology,2006,40(2):106-115.
[11]JUNQUEIRA-GONCALVES M P, ALARCON E, NIRANJAN K.Post-consumer recycled PET packaging for fresh berries: a comparative study between incorporating an antifungal agent superficially and into the main body of the packaging[M].[S.l.]: Springer US, 2014, 7 (9) :2610-2617.
[12]WANG S Y,CHEN C T,WANG C Y,et al. Resveratrol content in strawberry fruit is affected by preharvest conditions[J]. Journal of Agricultural and Food Chemistry, 2007,55(20):8269-8274.
[13]STEFANIA Cesa,SIMONE Carradori,GIUSEPPE Bellagamba,et al. Evaluation of processing effects on anthocyanin content and colour modifications of blueberry (Vaccinium spp.) extracts: Comparison between HPLC-DAD and CIELAB analyses [J]. Food Chemistry, 2017, 232:114-123.
[14]KALT W,RYAN D A J,DUY J C,et al. Interspecific variation in anthocyanins, phenolics, and antioxidant capacity among genotypes of highbush and lowbush blueberries (Vaccinium section cyanococcus spp.)[J]. Journal of Agricultural and Food Chemistry,2001,49(10):4761-4767.
[15]CONNOR A M,LUBY J J,HANCOCK J F,et al. Changes in fruit antioxidant activity among blueberry cultivars during coldtemperature storage[J]. Journal of Agricultural and Food Chemistry,2002,50(5):893-898.
[16]CHANJIRAKUL K,WANG S Y,WANG C Y,et al. Natural volatile treatments increase free radical scavenging capacity of strawberries and blackberries[J]. Journal of Science of Food and Agriculture,2007,87(2):1463-1472.
[17]CYRELYS Collazo, MARIBEL Abadías, PILAR Colás-Medà, et al. Effect ofPseudomonasgraminis strain CPA-7 on the ability of Listeria monocytogenes andSalmonellaenterica subsp. enterica to colonize Caco-2 cells after pre-incubation on fresh-cut pear[J]. Journal Article, 2017, 262:55-62.
[18]MARIA PaulaJunqueira-Goncalves, ERICA Alarcón, KESHAVAN Niranjan. The efficacy of potassium sorbate-coated packaging to control postharvest gray mold in raspberries, blackberries and blueberries [J]. Postharvest Biology and Technology,2016,111:205-208.
[19]ZENG K F,CAO J K,JIANG W B. Enhancing disease resistance in harvested mango (Mangifera indica L. cv. ‘Matisu’) fruit by salicylic acid[J]. Journal of the Science of Food and Agriculture,2006,86(5):694-698.
[20]LIU H X,JIANG W B,BI Y,et al. Postharvest BTH treatment induces resistance of peach (Prunus persica L. cv. Jiubao) fruit to infection by Penicillium expansum and enhances activity of fruit defense mechanisms[J]. Postharvest Biology and Technology,2005,35(3):263-269.

