玉米赤霉烯酮的表面等离子体共振芯片无标记快速测定
齐 攀 李仕萍 钟金钢 李 莹
(1.广东交通职业技术学院信息学院, 广州 510650; 2.暨南大学理工学院, 广州 510632;3.暨南大学光电信息与传感技术广东普通高校重点实验室, 广州 510632; 4.暨南大学预科部, 广州 510610)
0 引言
玉米赤霉烯酮(ZEN)又称F- 2毒素,是由多种镰刀菌产生的一种类雌激素样的真菌毒素,广泛存在于多种谷物中[1-2]。ZEN具有较强生殖毒性和致畸作用[3-5]。对食物中ZEN的检测与研究十分必要。传统的ZEN检测研究方法包括:薄层层析(Thin-layer chromatography,TLC)法、高效液相- 质谱联用色谱(High performance liquid chromatography- mass sepectrum,HPLC- MS)法、酶联免疫吸附(Enzyme linked immunosorbent assay,ELISA)检测技术以及胶体金免疫层析(Colloidal gold immunochromatographic assay,GICA)检测方法等[5-6]。传统的ZEN检测方法虽然具有高灵敏度的优点,但是存在仪器价格昂贵、样品处理步骤复杂(一般需要纯化和标记等,其中标记所用的荧光标记物会污染环境)、检测周期长、操作过程复杂等技术缺陷,难以满足现场快速检测研究的要求[7-9]。因此,亟需建立低成本、免标记、实时快速、特异、简便的ZEN检测方法。
表面等离子体共振(SPR)技术通过探测生物分子间相互作用引起的微小折射率变化,实现对生物效应中分子间相互作用的实时监测[10-14]。SPR技术对检测的生物样品不需要纯化,无需标记,可实现快速、无扰、动态检测,相对其他一些传感技术能提供更为丰富的信息,已广泛应用于生物医学研究、临床疾病诊断、药物筛选、环境监测以及食品安全监控等领域[15-18]。本文基于自行设计的角度扫描型便携式SPR传感器,制备可快速测定ZEN的生物芯片,建立无标记检测ZEN的方法,使其可用于现场快速检测。
1 表面等离子体共振生物传感原理及装置
表面等离子体共振(SPR)效应是利用P偏振光在玻璃与金属薄膜界面处发生全内反射时进入金属薄膜内的倏逝波,引发金属中的自由电子产生表面等离子体,当倏逝波的波矢与表面等离子体的波矢相匹配时,二者将发生共振,入射光的能量被表面等离子体吸收,反射光强急剧下降[14],如图1中SPR共振曲线A或B所示。如果将探针或配体固定于传感芯片(金属薄膜)表面,含待分析物的样品流经传感芯片表面,分子间发生特异性结合时引起传感芯片表面的折射率改变,通过检测SPR信号改变(如图1中曲线B的SPR共振角大于曲线A的共振角)可实现检测分子间相互作用的特异性、浓度、动力学、亲合性、协同作用、相互作用模式等。

图1 表面等离子体共振原理图Fig.1 Schematic diagram of SPR
本文建立的SPR生物传感器系统结构如图2所示,包括光路系统、流路系统、电路(信号探测与控制)系统、软件(数据分析)系统和传感芯片等部分。

图2 SPR系统结构示意图Fig.2 Structure diagram of SPR system1.激光器 2.扫描镜 3.反射镜 4.传感芯片
SPR生物芯片是检测系统的核心器件,本系统的传感芯片是以K9玻璃材质的圆柱形棱镜为光波耦合器件,基于Kretschmann模型,将厚度为50 nm的金膜镀在与圆柱形棱镜折射率相同的厚度为1 mm的盖玻片上,然后用折射率相近的匹配液(香柏油)将其粘合在棱镜底面。利用SPR生物芯片进行免疫反应实验时,传感芯片经过修饰后固定上生物探针(抗原或抗体),然后含待测物的样品通过流路系统进入芯片,芯片上分子间相互作用的情况可由SPR共振角的改变反映,并通过软件系统将整个反应过程显示和记录。
经测试,SPR系统对样品折射率的测量范围为1.241 5~1.376 2 RIU,样品的折射率测量分辨率可达10-5RIU。整套SPR系统成本不超过3万元人民币(远低于商用SPR仪的售价),通过自组装单层分子膜(Self-assembled monolayer,SAM)技术对金膜进行修饰自行制备生物芯片,每块芯片成本低于200元人民币;装置稳固便携,体积和质量与个人计算机的主机相当,生物芯片拆卸方便,有利于现场快速检测。
2 实验
2.1 实验样品
玉米赤霉烯酮(ZEN)毒素标准品(质量浓度为10 μg/mL,相对分子量为318.4)、玉米赤酶烯酮- 牛血清白蛋白(ZEN- BSA)偶联物(质量浓度为5.3 mg/mL)和玉米赤酶烯酮抗体(质量浓度为1.4 mg/mL)来自暨南大学分子免疫学与抗体工程研究中心;巯基十一酸、巯基己酸、乙醇胺、十二烷基硫酸钠(SDS)、N-羟基琥珀酰亚胺(EDC)购于美国Sigma公司;其它试剂购于北京化学试剂公司。免疫反应的缓冲液是PBS缓冲液(2 mmol/L NaH2PO4,2 mmol/L Na2HPO4,150 mmol/L NaCl,pH值7.4)。ZEN毒素标准品、ZEN- BSA、ZEN抗体由PBS缓冲液稀释为相应浓度的溶液。
2.2 玉米赤霉烯酮检测生物芯片的制备
生物芯片的制备包括修饰、活化、固定和灭活等过程,具体操作方法为:
(1)将金膜(直径20 mm、厚度1 mm的圆形玻璃片表面沉积50 nm厚的金)用香柏油(折射率为1.51~1.52)作为匹配液贴合在SPR仪的圆柱形棱镜(K9玻璃)上,用1 mmol/L的HS(CH2)10COOH(巯基十一酸)和HS(CH2)6OH(巯基己酸)的乙醇溶液,质量比为1∶9,对金膜表面进行自组装修饰4 h,修饰液中的巯基与金键合,形成羧基;安装流路系统,设置SPR扫描参数(扫描起点-1°,扫描范围2°,扫描步长0.01°);以1 000 μL/min的流速向芯片表面泵入PBS缓冲液(2 mmol/L NaH2PO4, 2 mmol/L Na2HPO4, 150 mmol/L NaCl, pH值7.4),开始记录SPR响应值,以此时PBS缓冲液的共振角作为基准(图3中阶段1)。
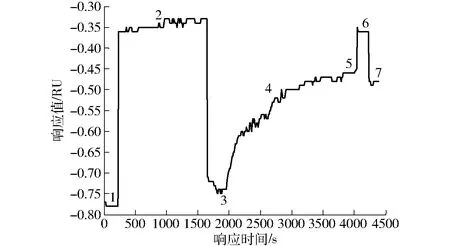
图3 生物芯片制备过程记录曲线Fig.3 Recording curve of biochip preparation process1、3、5、7.基线 2.活化 4.固定生物探针 6.灭活
(2)基线稳定后加入0.1 mol/L的NHS和0.1 mol/L的EDC混合液(体积比为1∶1),活化芯片表面20~25 min,将芯片表面的羧基活化成活泼酯,此时的SPR响应值升高(图3中阶段2),用PBS冲洗3~4 min,稳定后基线略有上升(图3中阶段3),活化后的芯片可固定蛋白质。
(3)直接检测法和抑制检测法,均在生物芯片表面固定质量浓度为100 mg/L的玉米赤酶烯酮- 牛血清白蛋白(ZEN- BSA)偶联物作为生物探针,此时SPR响应值明显升高(图3中阶段4),约30 min后通入PBS冲洗2~3 min,响应值只有小幅下降(图3中阶段5),说明生物探针固定效果较好。
(4)加入1 mol/L的乙醇胺(pH值8.5)5~7 min封闭灭活剩余的酯键(图3中阶段6),PBS冲洗后,生物芯片制备完成,可用于ZEN抗体直接免疫检测和ZEN毒素小分子抑制免疫检测。
2.3 直接检测法检测玉米赤霉烯酮抗体
将生物芯片用于ZEN抗体的直接免疫检测,可进行抗体筛选和免疫反应动力学基础研究。将ZEN抗体用PBS缓冲液调配成不同浓度的抗体样品,依次加入到制备好的生物芯片表面,样品中的抗体与芯片表面的抗原特异性结合,一个样品的免疫反应过程检测完,通入PBS缓冲液2 min,然后通入SDS- HCl,使抗原- 抗体结合物解离,SPR响应值降回基线,可继续检测下一个样品。图4为直接法检测一组样品的动力学曲线。芯片表面固定了ZEN- BSA,样品中ZEN抗体的质量浓度分别为10、20、30、40、50 μg/mL。随着样品中ZEN抗体质量浓度升高,免疫反应速度增快。单个样品检测约400 s,随着免疫反应的进行,生物芯片表面抗原- 抗体结合物增多,SPR响应值增大。检测每个样品时,免疫反应先快后慢,逐步趋于饱和,反应过程呈近似对数函数关系,符合免疫反应规律。图5为这一组样品SPR检测的共振曲线(样品加入50 s后测得),随样品中ZEN抗体质量浓度的增大,在相同反应时间下,生物芯片表面的抗原- 抗体结合物质量增加(折射率升高),共振角增大,反映在SPR曲线上即为光强吸收峰向右位移。
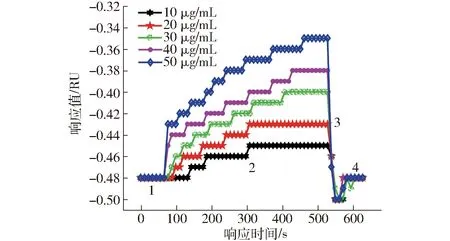
图4 直接法检测不同质量浓度ZEN抗体的动力学曲线Fig.4 Kinetic curves of ZEN antibody with different mass concentrations detected by direct method1、4.基线 2.结合 3.解离

图5 直接法检测不同质量浓度ZEN抗体的SPR曲线Fig.5 SPR curves of ZEN antibody with different concentrations detected by direct method
图6是直接法检测ZEN抗体的标准曲线,室温(20±1)℃,以通入样品免疫反应350 s(免疫反应趋于饱和)时的相对响应值为纵坐标,样品中ZEN抗体的质量浓度为横坐标,可见10~50 μg/mL质量浓度的样品SPR响应值与质量浓度基本呈线性关系,标准曲线方程为f(x)=0.002 5x-0.477 0,R2=0.995 2,均方根误差为0.003 2。经测试,固定了生物探针的生物芯片至少可连续检测50组样品,超过50组样品SPR响应值开始下降。用固定了质量浓度为100 mg/L的ZEN- BSA生物芯片连续检测质量浓度为50 μg/mL的ZEN抗体,单次免疫反应350 s时SPR响应值(相对于基线的变化量)如图7所示,说明检测超过50次后生物芯片表面固定的探针受损,这时芯片表面通入0.1 mol/L的HCl可实现芯片再生,重新自组装并固定生物探针,传感芯片可继续使用。该方法适用于ZEN抗体的定量检测及筛选、抗体亲和力和免疫反应动力学基础研究。

图6 直接法检测ZEN抗体的标准曲线Fig.6 Standard curves of ZEN antibody detected by direct method

图7 连续检测样品的稳定性测试Fig.7 Stability test of continuous detection of samples
2.4 抑制检测法检测痕量玉米赤霉烯酮毒素小分子
由于ZEN的分子量较小(318.4),其虽可与固定在芯片表面的抗原结合,但对芯片表面附近的折射率影响小,引起表面等离子体共振的共振角变化小,直接检测的检测限较高。为了对ZEN痕量小分子物质检测,本文提出抑制免疫型生物芯片法,可放大响应值,降低检出限。生物芯片制备过程同2.2节所述,将ZEN的衍生物(ZEN- BSA)固定在生物芯片表面作为生物探针,不同质量浓度的ZEN毒素小分子与ZEN抗体混合后通入芯片表面,分析动力学过程。样品中的ZEN小分子和芯片表面的ZEN衍生物都可以与样品中的抗体结合,是竞争的关系,样品中ZEN小分子抑制了抗体与芯片表面的生物探针(ZEN- BSA)结合,样品中ZEN小分子的质量浓度与响应值的变化成反比。如果样品中ZEN小分子浓度低,则更多的抗体与芯片表面生物探针结合,SPR响应值(共振角)的变化大。
用PBS缓冲液将ZEN抗体稀释为5 μg/mL的工作质量浓度,ZEN毒素标准品小分子的终质量浓度为0、2、8、16、32 ng/mL,抗体与ZEN标准品小分子混合5 min后,将混合溶液依次加到芯片表面,记录SPR的动态变化。免疫反应6 min后通入SDS- HCl溶液洗脱抗原抗体结合物,2 min后,通入PBS缓冲液清洗,SPR响应值可回到初始的基线,然后加入下一浓度的样品,继续检测。图8是这组样品通入芯片表面,抑制法检测ZEN小分子时的动力学曲线,当样品中ZEN质量浓度大时,可与芯片表面生物探针结合的ZEN抗体数量少,免疫反应速度慢,SPR响应值低,ZEN小分子质量浓度与SPR响应值成反比。
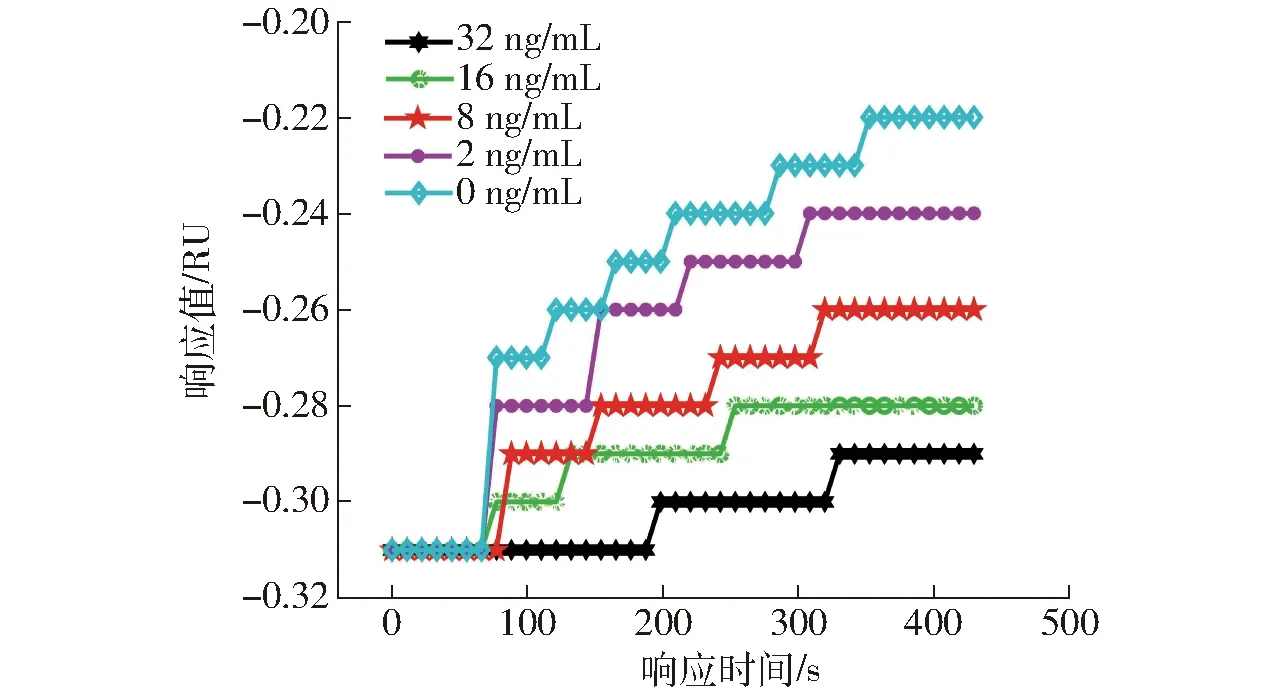
图8 抑制法检测不同质量浓度ZEN小分子的动力学曲线Fig.8 Kinetic curves of ZEN small molecules with different mass concentrations detected by inhibition method
以通入样品免疫反应350 s时的相对响应值为纵坐标,样品中抗体质量浓度(ng/mL)对数值为横坐标,绘制ZEN抑制免疫检测的标准曲线如图9所示,标准曲线方程为f(x)=-0.001 0x3+0.005 9x2-0.028 7x-0.220 8,R2=0.989 6,均方根误差为0.005 8。对每一个质量浓度进行反复测试(5次)的标准差小于8%,检出限小于2 ng/mL(通过计算5组标准曲线零浓度点SPR响应值的平均值和标准差, 以平均值减去3倍标准差所得的响应值从标准曲线中找到对应质量浓度即为检出限[19]),低于美国商用SPRimager II芯片分析系统的检出限8.2 ng/mL[20],略高于ELISA的检出限1 ng/mL[7]。生物芯片制备完成后,完成单一样品的检测耗时仅需约6 min,在实际应用过程中,根据单次测量的SPR响应值,由标准曲线检出限可得到ZEN毒素的质量浓度。相比于ELISA等传统检测法,设备简单、成本低、高特异性,样品无需标记、非破坏性、无环境污染与快速定量是其最大的优势,可满足现场快速检测的需求。因此,该方法有望用于食品质量监控和现场实时检测。

图9 抑制法检测ZEN小分子的标准曲线Fig.9 Standard curve of ZEN small molecules directed by inhibition method
免疫反应检测时间应根据抗原- 抗体响应值的大小,结合实际检测要求进行设定。免疫反应时间越长,反应越充分,可降低检测限。ZEN抗原- 抗体的反应在350 s内没有达到饱和状态,如果延长反应时间可降低检出限。本研究采用的抗体工作质量浓度是5 μg/mL,如果降低抗体工作浓度,也可以降低ZEN毒素小分子样品的检出限。
取有代表性的玉米样品,研磨成颗粒,称取5 g磨碎的试样,在试样中加入提取液(乙腈与水溶液体积比9∶1)20 mL,高速搅拌提取2 min。吸取10 μL提取液用氮气吹干,加入40 μL PBS混匀,室温10 000 r/min离心10 min,取全部上清液用于 SPR 检测。由表面等离子体共振生物芯片检测玉米提取物,样品中ZEN质量浓度为2.75 ng/mL,抑制法工作抗体质量浓度为5 μg/mL,检测玉米中提取ZEN样品的SPR响应值(免疫反应约350 s时SPR共振角相对于基线的变化量)为0.11 RU(检测3次的平均值),空白对照的响应值为0.13 RU(检测3次的平均值)。可见,含有ZEN的样品与对照组SPR响应值有明显区别,SPR生物芯片能够在实际检测中应用。
3 结束语
基于自行设计的角度扫描型便携式SPR传感器,制备了用于ZEN检测研究的生物芯片。提出了ZEN直接检测法和抑制检测法,建立了10~50 μg/mL质量浓度范围的ZEN直接检测标准曲线;抑制法检测ZEN毒素小分子检测限小于2 ng/mL,生物芯片制备完成后,完成单一毒素样品检测仅需6 min。与传统生化分析方法相比,SPR生物芯片检测研究ZEN具有免标记、对环境无污染、高特异性、快速定量、研究反应动力学等一系列优点。该装置和方法可用于大量样品的现场快速检测。
1 KORDIC B, PRIBICEVIC S, MUNTANOLA-CVETKOVIC M, et al. Experimental study of the effects of known quantities of Zearalenone on swine reproduction[J]. Journal of Environmental Pathology Toxicology & Oncology Official Organ of the International Society for Environmental Toxicology & Cancer, 1992, 11(2):53-55.
2 HART L P, WEJR B, STEBBINS T C. Production of Zearalenone and deoxynivalenol in commercial sweet corn [J]. Plant Disease, 1983, 66(1):1133-1135.
3 AYED-BOUSSEMA I, OUANES Z, BACHA H, et al. Toxicities induced in cultured cells exposed to Zearalenone: apoptosis or mutagenesis? [J] Journal of Biochemical & Molecular Toxicology, 2007, 21(3):136-144.
4 贾彦琼, 黄建芳, 向军俭, 等. 玉米赤霉烯酮抗独特型单抗的制备及特异性分析[J]. 中国生物制品学杂志, 2013, 26(5):726-730.
JIA Y Q, HUANG J F, XIANG J J, et al. Preparation and characterization of monoclonal anti-idiotype antibody to Zearalenone [J]. Chinese Journal of Biologicals, 2013, 26(5):726-730. (in Chinese)
5 骆敏儿, 唐勇, 向军俭, 等. 玉米赤霉烯酮单克隆抗体的制备及胶体金免疫层析法的建立[J]. 细胞与分子免疫学杂志, 2013, 29(7):729-733.
LUO M E, TANG Y, XIANG J J, et al. Preparation of anti-zearalenone monoclonal antibody and preliminary establishment of colloidal gold immunochromatographic assay for Zearalenone [J]. Chinese Journal of Cellular & Molecular Immunology, 2013, 29(7):729-733. (in Chinese)
6 HE Q H, XU Y, HUANG Y H, et al. Phage-displayed peptides that mimic Zearalenone and its application in immunoassay [J]. Food Chemistry, 2011, 126(3):1312-1315.
7 王玉平, 计融, 江涛, 等. 玉米赤霉烯酮ELISA定量检测试剂盒研制[J]. 卫生研究, 2006, 35(2):221-224.
WANG Y P, JI R, JIANG T, et al. Development of ELISA-kit of quantitative analysis for Zearalenone [J]. Journal of Hygiene Research, 2006, 35(2):221-224. (in Chinese)
8 OK H E, CHOI S W, KIM M, et al. HPLC and UPLC methods for the determination of Zearalenone in noodles, cereal snacks and infant formula [J]. Food Chemistry, 2014, 163(20):252-257.
9 NIWA T, KOBAYASHI T, SUN P, et al. An enzyme-linked immunometric assay for cortisol based on idiotype-anti-idiotype reactions [J]. Analytica Chimica Acta, 2009, 638(1):94-100.
10 ESPIRITU R A, MURATA M, NISHIMURA S, et al. Interaction between the marine sponge cyclic peptide theonellamide A and sterols in lipid bilayers as viewed by surface plasmon resonance and solid state 2h NMR [J]. Biochemistry, 2013, 52(14):2410-2418.
11 HOMOLA J, LU H B, YEE S S. Dual-channel surface plasmon resonance sensor with spectral discrimination of sensing channels using dielectric overlayer [J]. Electronics Letters, 1999, 35(13):1105-1106.
12 NELSON B P, GRIMSRUD T E, LILES M R, et al. Surface plasmon resonance imaging measurements of DNA and RNA hybridization adsorption onto DNA microarrays [J]. Analytical Chemistry, 2001, 73(1):1-7.
13 YUK J S, KIM H S, JUNG J W, et al. Analysis of protein interactions on protein arrays by a novel spectral surface plasmon resonance imaging [J]. Biosensors & Bioelectronics, 2006, 21(8):1521-1528.
14 SCHASFOORT R B M, TUDOS A J. Handbook of surface plasmon resonance [M]. Cambridge: Royal Society of Chemistry, 2008.
15 SHALABNEY A, ABDULHALIM I. Sensitivity-enhancement methods for surface plasmon sensors [J]. Laser & Photonics Reviews, 2011, 5(4):571-606.
16 CHOULIER L, NOMINE Y, ZEDERLUTZ G, et al. Chemical library screening using a SPR-based inhibition in solution assay: simulations and experimental validation [J]. Analytical Chemistry, 2013, 85(18):8787-8795.
17 OLARU A, BALA C, JAFFREZIC-RENAULT N, et al. Surface plasmon resonance (SPR) biosensors in pharmaceutical analysis [J]. Critical Reviews in Analytical Chemistry, 2015, 45(2):97-105.
18 ZHAO S S, BUKAR N, TOULOUSE J L, et al. Miniature multi-channel SPR instrument for methotrexate monitoring in clinical samples [J]. Biosensors & Bioelectronics, 2015, 64:664-670.
19 DENIS D, WILLEM H, FRANSSEN M C R, et al. Imaging surface plasmon resonance for multiplex microassay sensing of mycotoxins [J]. Analytical & Bioanalytical Chemistry, 2011, 400(9):3005-3011.
20 赵芳, 涂晓波, 黄欣迪, 等. 表面等离子共振技术快速检测食品中的玉米赤霉烯酮毒素[J]. 食品安全质量检测学报, 2016, 7(12):4849-4852.
ZHAO F, TU X B, HUANG X D, et al. Rapid detection of Zearalenone in food by surface plasmon resonance technology[J]. Journal of Food Safety and Quality, 2016, 7(12):4849-4852. (in Chinese)

