高效液相色谱串联质谱法测定豆芽中4种药物残留
(宁夏回族自治区食品检测中心,宁夏银川750001)
豆芽是深受广大消费者欢迎的食品,具有较高的营养价值。近年来,市场上曝光市场豆芽存在质量安全隐患[1-3],同时在执法检查中发现部分豆芽生产者为缩短生产周期、增加产量、改善豆芽外观,在生产黄豆芽、绿豆芽、豆苗的过程中非法添加“AB粉”、“无根豆芽素”等化学物质的现象,滥用的植物生长调节剂会给健康带来风险,已成为目前食品安全领域的一个重大问题[4]。国家食品药品监督管理总局、农业部、国家卫生和计划生育委员会2015年11号公告明确规定在豆芽生产过程中不得使用4-氯苯氧乙酸钠、6-苄基腺嘌呤、2,4-滴、赤霉素等物质。
目前,国内外有关4-氯苯氧乙酸钠、6-苄基腺嘌呤、2,4-滴、赤霉素等物质检测方法主要以气相色谱法[5]、液相色谱法[6]和色谱-质谱联用法[7-9]为主。不同的检测方法具有其特定的优缺点:运用气相色谱法(gas chromatography,GC)和气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)时通常要进行衍生化的复杂操作,且存在定性不足和灵敏度低等问题;液相色谱法不需要衍生处理,但同样存在选择性差、灵敏度低、易受复杂样品基质干扰且难以实现确证分析等问题。高效液相色谱-串联质谱法(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)具有高特异性和高灵敏度,是目前广泛应用的检测方法。本试验通过优化质谱参数和色谱条件,考察流动相、提取方法和基质效应等因素,建立HPLC-MS/MS法结合分散萃取技术同时测定豆芽中4种药物残留,该方法准确可靠,回收率稳定,能满足日常豆芽药物残留的检测要求。为严厉打击豆芽违法添加禁限用物质的行为,实现对豆芽生产及市场的有效监管提供技术支撑。
1 材料与方法
1.1 材料与仪器
豆芽:市售。
赤霉素(gibberellic acid,GA3)、6-苄基腺嘌呤(6-benzylaminopurine,6-AB)、4-氯 苯 氧 乙 酸 (4-chlorophenoxyacetic acid,4-CPA)、2,4- 滴 (2,4-dichlorophenoxyacetic acid,2,4-D):德国 Dr.Ehrenstorfer公司,纯度均大于98%;甲醇、乙腈(色谱纯):赛默飞世尔科技有限公司;C18、硫酸镁:适用于QuEChERS方法的填料,美国安捷伦公司;甲酸(色谱纯)、乙酸铵(优级纯)、冰乙酸(优级纯):德国SIGMA公司;氯化钠(优级纯):国药集团化学试剂有限公司;所有用水均为超纯水。
Aglient6460三重四级杆质谱:配Aglient 1260高效液相色谱仪,美国安捷伦公司;IKA T25数显型分散机:德国IKA公司;BUCHI V-850旋转蒸发仪:瑞士步琦实验室公司;BS224电子天平:赛多利斯科学仪器公司;HGC-24方形干式加热氮吹仪:北京恒奥德仪器仪表有限公司;3-15高速离心机:德国Sigma公司。
1.2 标准溶液的配制
分别准确称取适量赤霉素、6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-滴标准品,用甲醇配制成1.0 mg/mL的标准储备液;分别移取标准储备溶液适量用甲醇稀释成10.0 μg/mL的混合标准中间溶液;准确移取混合标准中间溶液适量用空白基质提取液稀释成浓度为1.0、5.0、10.0、20.0、50.0、100.0、200.0 μg/L 系列标准工作溶液。
1.3 样品前处理
1.3.1 试样制备
取200 g左右样品加入等质量的去离子水,经均质机均质并混合均匀后,应立即测定。
1.3.2 试样溶液的制备
称取混合均匀的豆芽样品10 g(精确至0.01 g)于100 mL离心管中,加入15 mL 5%乙酸乙腈,涡旋混匀,10 000 r/min匀浆提取1 min,加入2 g氯化钠,再匀浆1 min。在4℃条件下8 000 r/min冷冻离心5 min,上清液备用。
1.3.3 净化
准确称取0.15 gC18和0.90 g硫酸镁于15 mL离心管中,涡旋混匀。加入5.0 mL上清液,涡旋1 min,去除杂质,在4℃条件下8 000 r/min冷冻离心5 min。取出后放置室温,再取上清液1.0 mL于50℃下氮吹至干,准确加入1.0 mL流动相溶解,过0.22 μm滤膜后供高效液相色谱-串联质谱仪分析测定。
1.4 仪器条件
1.4.1 液相色谱条件
色谱柱:ZORBAX Eclipse Plus C18,2.1(内径)mm 100 mm,粒径 3.5 μm;进样量:10 μL;柱温:30.0 ℃;流速:0.30 mL/min;流动相:A为5 mmol/L乙酸铵-0.05%甲酸水溶液,B为乙腈。梯度洗脱条件见表1。
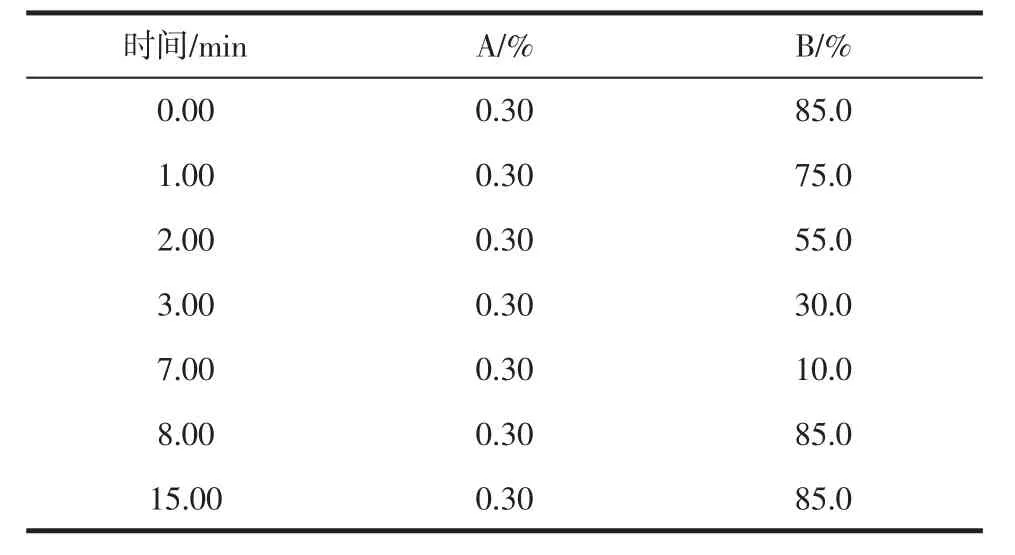
表1 流动相梯度洗脱程序Table 1 Mobile phase composition for linear gradient elution
1.4.2 质谱条件
离子源:AJS ESI源;扫描方式;负模式;检测方式:多反应监测(multiple reactions monitoring,MRM);雾化气压力:3.1 bar;喷嘴电压:500 V;干燥气温度与流速:325℃,7 L/min;鞘气温度与流速:375℃,11 L/min;毛细管电压:3 000 V。豆芽中4种药物残留的定量和定性离子、碰撞能量和碎裂电压等参数见表2。
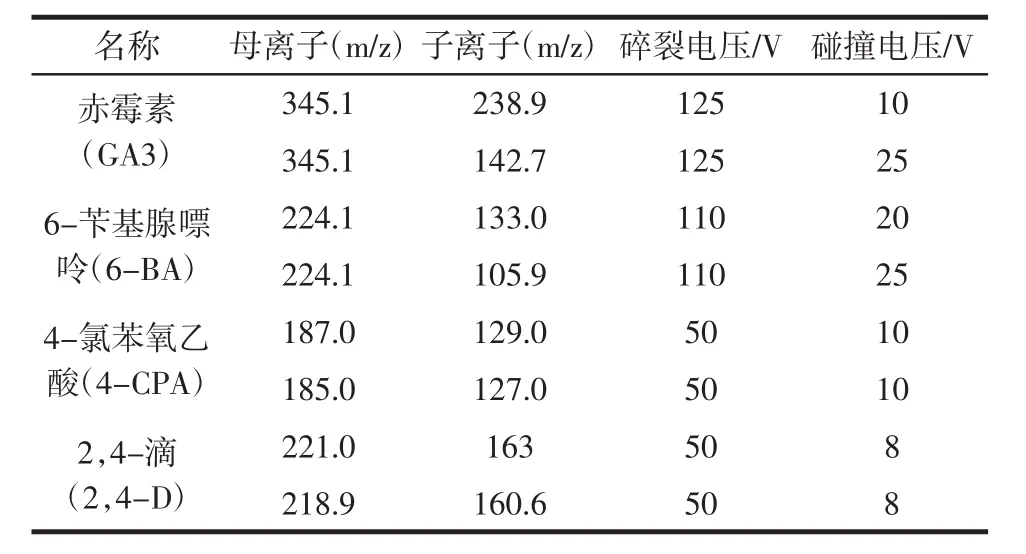
表2 豆芽中4种添加物的质谱分析参数Table 2 MS/MS parameters for four additives in bean sprouts
2 结果与分析
2.1 质谱条件优化
由于4-氯苯氧乙酸、2,4-二氯苯氧乙酸和赤霉素的分子结构中均含有羧基;6-苄氨基嘌呤可产生[M+H]+离子,也可以形成稳定的[M+H]-离子。因此采用负离子方式对4种添加物进行电离。分别对浓度为1.0 μg/mL的目标化合物进行单针进样,优化其质谱条件。当目标化合物进入一级质谱后,可产生稳定的[M+H]离子[10]。确定母离子后,在SIM模式下优化各目标化合物的碎裂电压。母离子进入二级质谱,产生不同的离子碎片。在子离子扫描模式下,优化碰撞能量,得到相应的离子碎片。4种添加物的二级离子质谱图见图1,MRM色谱图见图2。

图1 豆芽中4种添加物的二级离子质谱图Fig.1 MS/MS spectra for four additives in bean sprouts
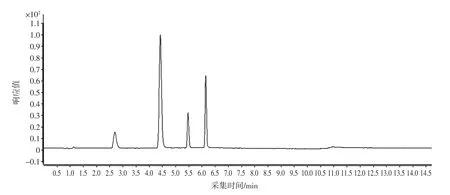
图2 豆芽中4种添加物的MRM色谱图Fig.2 MRM chromatograms for four additives in bean sprouts
2.2 色谱条件优化
赤霉素、6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-滴在不同的流动相中分离程度不同,对比3种流动相甲酸水溶液、乙酸铵水溶液、乙酸铵-甲酸水溶液。通过试验,各待测物在乙酸铵-甲酸水溶液流动相中的分离程度及峰形较好。因此选择5 mmol/L乙酸铵-0.05%甲酸水溶液和乙腈为流动相;在ZORBAX Eclipse Plus C18色谱柱通过梯度洗脱对4种添加物进行分离,目标化合物的保留时间为2 min~7 min之间。
2.3 样品前处理条件的确定
2.3.1 提取溶剂的选择
对比乙腈、含2%乙酸乙腈、含5%乙酸乙腈3种溶液作为提取溶剂时,各待测物的回收率。其中含5%乙酸乙腈溶液做为提取溶剂时,回收率最高。
2.3.2 净化条件的优化
分别在 MgSO4+C18、C18+PSA、MgSO4+C18+Carbon 3种净化条件下进行试验,不同净化材料可以选择性地保留基质干扰成分,达到净化效果。但使用PSA和Carbon时对目标物也有一定的吸附,回收率偏低。最终采用MgSO4+C18作为净化剂时,各待测物的回收率较高。
2.4 基质效应
基质效应是在提取基质中的目标物时,基质中的干扰物影响目标化合物的离子化,使得目标化合物在仪器上的响应发生了增强或者抑制的现象[11],影响分析结果的准确性。考察4种化合物在豆芽中均为基质抑制效应.为提高目标化合物测定的准确度,本方法使用空白基质提取液配制标准曲线,降低基质干扰的影响。
2.5 方法的线性范围和检出限
将 1.0、5.0、10.0、20.0、50.0、100.0、200.0 μg/L 系列基质标准工作溶液分别进行测定。以质量浓度为横坐标,定量离子峰面积为纵坐标,绘制标准曲线。结果表明,赤霉素、6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-滴在1.0 μg/L~200.0 μg/L的范围内,其浓度与各待测物的峰面积呈良好的线性关系。4种添加物的线性回归方程、相关系数、线性范围及检出限(信噪比S/N≥3)见表3。

表3 豆芽中4种添加物的线性回归方程、相关系数、线性范围及检出限Table 3 Linear equation,coefficient correlation,linear range,LODs of four additives in bean sprouts
2.6 方法的准确度和精密度
由宁夏食品检测中心自制3种不含目标化合物的豆芽(黄豆芽、绿豆芽、扁豆芽)作为空白样品进行加标回收率试验,添加水平分别为0.045、0.090、0.15 mg/kg进行测定,其中赤霉素的回收率范围为68.9%~115.2%;6-苄基腺嘌呤的回收率范围为68.1%~105.8%;4-氯苯氧乙酸的回收率范围为75.3%~119.0%、2,4-滴的回收率范围为63.8%~102.6%。其相对标准偏差范围为1.94%~12.34%,其精密度符合方法学的要求。赤霉素、6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-滴添加浓度及回收率的数据见表4。

表4 赤霉素、6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-滴的回收率及精密度试验Table 4 The recovery and precision experiment for four additives in bean sprouts
2.7 样品测定
本方法对市售豆芽进行测定。随机采购市售黄豆芽、绿豆芽、扁豆芽各10个批次,其中9个批次未检出,一个批次黄豆芽中检出4-氯苯氧乙酸。样品图谱见图3。

图3 黄豆芽样品色谱图Fig.3 MS/MS spectra for four additives in Soybean sprouts
3 结论
建立高效液相色谱-串联质谱法结合分散固相萃取技术,同时测定豆芽中赤霉素、6-苄基腺嘌呤、4-氯苯氧乙酸、2,4-滴残留的分析方法。该方法前处理操作简单,净化效果好,灵敏度高,能够满足豆芽中4种药物残留的定性和定量分析。
[1]余露.豆芽生产禁用农药、化学添加剂[J].农药市场信息,2013(3):12
[2]王卫明.从豆芽案件看食品安全监管立法的缺陷[J].上海政法学院学报:法治论丛,2013(3):1-5
[3]陈梦茜,李清雅,单晓云,等.江苏省四市消费者无根豆芽认知、态度、行为调查[J].中国食物与营养,2013(5):75-77
[4]王一茜,张广华,何洪巨.蔬菜中主要生长调节剂残留检测方法的研究进展[J].现代仪器,2012,18(2):6-10
[5]周艳明,付婷,胡睿.气相色谱法测定蔬菜中三碘苯甲酸残留量[J].食品科学,2010,31(12):178-181
[6]贾建,王晓云,杨天祝.气相色谱法检测花生中丁酰肼残留[J].化学工程师,2004,18(7):35-38
[7]宋莹,张耀海,黄霞,等.气相色谱-串联质谱法快速检测水果中的多效唑残留[J].分析化学,2011,39(8):1270-1273
[8]徐宜宏,蒋施,付海滨,等.苹果、番茄、玉米中7种植物生长调节剂的气相色谱-串联质谱检测方法[J].农药,2014,53(2):113-115
[9]赵永信,宋国良,张晶,等.气相色谱/质谱法测定粮食中矮壮素残留[J].中国卫生检验杂志,2008,18(6):1064-1066
[10]黄何何,张缙,徐敦明,等.QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量[J].色谱,2014,32(7):707-716
[11]黄宝勇,肖志勇,陈丹,等.农药残留检测方法中关于基质效应补偿的相关问题探讨[J].农药科学与管理,2010,31(3):39-43

