鲭鱼罐头蒸煮液酶解制备抗氧化肽的工艺研究
毕丹丹,林娟,郭耀湘,叶秀云
(福州大学福建省海洋酶工程重点实验室,福建福州350116)
随着我国水产品总体产量的不断提高[1],水产品加工下脚料大量累积,据统计每年我国鱼类加工中有近百万吨蒸煮液亟待开发。由于缺乏有效的技术手段,目前企业对富含蛋白质的水产品加工蒸煮液利用很少,多数采用直接排放,这不仅造成资源的浪费,同时也对海洋和陆地环境造成污染[2-3]。因此对水产品加工废弃液进行综合开发利用,变废为宝,生产出各种农业、医药、食品等行业所需的新产品,将大大降低主导产品的成本,产生较高的经济、生态和社会效益[4-6]。
鱼罐头加工蒸煮液中蛋白的回收和加工能给企业带来很高的直接经济收益。研究表明,金枪鱼蒸煮液中蛋白含量达4%,每年台湾省光金枪鱼罐头加工所产生的蒸煮液中就至少含有400 t优质蛋白[7-10]。鱼类加工蒸煮液中的蛋白是生物活性肽的优质来源,水产蛋白源生物活性肽具有多种生理功能。因此回收蒸煮液蛋白,酶解蛋白制备生物活性肽,有助于鱼类加工企业实现废弃液的环保化、高值化开发,延长鱼类加工企业产业链,提升企业的竞争力,促进产业升级,为低碳经济发展作贡献[11-13]。
1 材料与方法
1.1 原料
鲭鱼罐头蒸煮液由福州百洋海味食品有限公司提供。
1.2 主要试剂
风味蛋白酶(26 806 U/g,60℃,pH6)、胰蛋白酶(125 305 U/g,45 ℃,pH7)、碱性蛋白酶(121 847 U/g,50 ℃,pH9)、中性蛋白酶(52 043 U/g,45 ℃,pH7):南宁庞博生物科技有限公司;BSA牛血清蛋白:Sigma公司;其余常用试剂均为分析纯。
1.3 溶液配制
硼酸吸收液:将0.1 g甲基红溶于100 mL无水乙醇,将0.1 g溴甲酚绿溶于100 mL无水乙醇。将二者以7∶10比例(体积比)混匀后,取出8.5 mL与500 mL 2%硼酸溶液混匀。
Lowry法试剂:
a试剂甲:取10 g碳酸钠,2 g氢氧化钠和0.25 g酒石酸钾钠,溶解于500 mL蒸馏水中,即为A液;取0.5 g硫酸铜溶解于100mL蒸馏水中,即为B液。每次使用前,将A液与B液按50∶1(体积比)混合,即为试剂甲。
b试剂乙:市售Folin-酚试剂,使用时稀释3倍;
1.4 主要仪器设备
KDN-103F型全自动凯氏定氮仪、HYP-3型高温加热炉:上海纤检仪器有限公司;AE-6111型垂直电泳槽、AE-8150型电泳仪:日本ATTO公司;TP-114型分析天平:Denver instrument公司;MSC-300型中空纤维柱:上海摩速科学器材公司;CF16RXⅡ型高速冷冻离心机:日本HITACHI公司;T6新世纪紫外可见分光光度计:北京普析通用仪器有限公司。
1.5 方法
1.5.1 鲭鱼罐头蒸煮液的浓缩处理
将鲭鱼罐头蒸煮液采用10 kDa中空纤维膜进行超滤浓缩,蛋白浓缩倍数为2.5倍。
1.5.2 鲭鱼罐头蒸煮浓缩液基本成分的测定
1.5.2.1 水分和灰分的测定
水分和灰分的测定采用恒温干燥法[14]。
1.5.2.2 总蛋白质的测定
总蛋白质的测定采用凯氏定氮法[15]。
1.5.2.3 可溶性蛋白含量测定
可溶性蛋白含量测定采用Lowry法(Folin-酚)。
1)Folin-酚标准曲线的绘制
往各试管中分别加入 0、0.1、0.2、0.4、0.6、0.8、1.0 mL250 μg/mL的标准蛋白质溶液,用蒸馏水补足1.0 mL;然后每支试管加入5 mL试剂甲,迅速混合,室温放置10 min后逐管加入0.5 mL试剂乙(folin-酚试剂),迅速混匀(快速混合,以免造成试验结果不准确);室温放置30 min,以未加入蛋白质溶液的试管为空白对照,在700 nm处测定各管中的吸光值OD700。以BSA浓度为横坐标,以OD700为纵坐标,绘制标准曲线如图1所示。
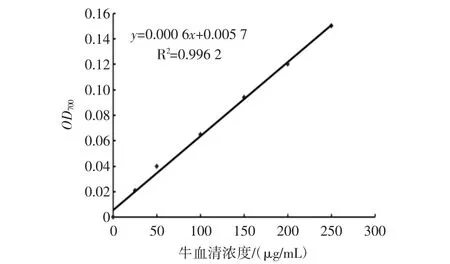
图1 牛血清蛋白标准曲线Fig.1 The standard curve of BSA
2)样品测定
将样品溶液适当稀释后,在相同条件下按照上述标准曲线制作步骤测定OD700,根据标准曲线计算样品溶液中的可溶性蛋白含量。
1.5.2.4 脂肪的测定
脂肪的测定采用索式抽提法。
1.5.3 羟自由基清除能力的测定
羟自由基清除能力的测定参考李春美等[16]的方法,略有修改。
在试管中,依次加入0.5 mL不同浓度的样品,2.0 mmol/L FeSO41.5 mL,6 mmol/L H2O21.5 mL 和6.0 mmol/L水杨酸1.5 mL,摇匀。于37℃反应30 min后取出,流水冷却,于波长510 nm下测定吸光值,以蒸馏水为空白对照,同时以抗坏血酸(VC)为阳性对照,所有试验设置3组平行。其对羟自由基清除率按以下公式计算:
羟自由基清除率/%=[1-(H1-H2)/H0]×100
式中:H0为未加清除剂的吸光值;H1为加入清除剂的吸光值;H2为试剂空白的吸光值。
1.5.4 各蛋白酶水解效果比较
由于不同蛋白酶水解作用的位点不同,其水解产物的抗氧化活性也不同。在相同的蛋白酶添加量5 000 U/g下,在酶各自的最适作用条件下反应,以羟自由基清除率为指标,比较不同蛋白酶的水解效果,选择出用于酶解蒸煮液的蛋白酶。
1.5.5 蛋白酶对蒸煮液的酶解条件单因素试验
以羟自由基清除率为指标,对选择的两种蛋白酶进行添加量、反应温度、反应pH值、反应时间进行单因素试验,优化酶解条件。
1.5.6 蒸煮液酶解条件响应面试验
以单因素试验的结果为基础,设计酶添加量、反应温度、反应pH值的响应面试验,以羟自由基清除率为指标,分析各因素的显著性,并建立数学模型,预测选择的两种蛋白酶酶解蒸煮液的最优条件。
1.5.7 复合蛋白酶酶解工艺比较
由于蛋白酶对肽键作用具有专一性,不同酶的酶切位点不同,可以互补,进而有效增大底物的水解程度,同时暴露出更多的活性氨基酸残基[8]。根据选择的两种蛋白酶酶解蒸煮液的最优条件,分别根据复配酶解(即把两种需要的蛋白酶以一定配比混合在一起进行酶解)和分段酶解(即把两种需要的蛋白酶以分段形式按时间先后添加进行酶解)设计4种复合蛋白酶酶解方案。以羟自由基清除率为指标,比较各方案的水解效果,获得最优的复合酶解工艺。
2 结果与讨论
2.1 鲭鱼罐头蒸煮液蛋白分子量分布及浓缩液基本成分测定
利用SDS-PAGE分析鲭鱼罐头蒸煮液中蛋白质分子量分布,结果如图2所示。
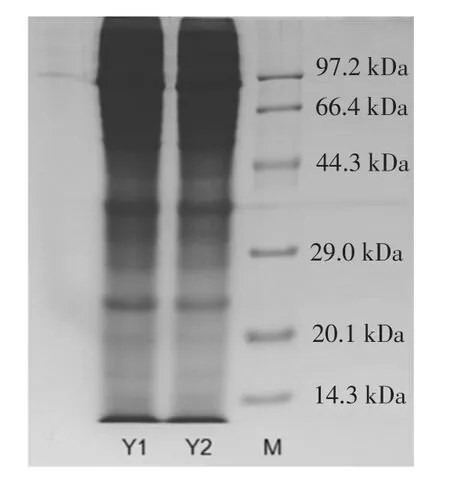
图2 鲭鱼罐头蒸煮液蛋白SDS-PAGE电泳图Fig.2 SDS-Page of the cooking liquid of canned of mackerel
可以看出,鲭鱼罐头蒸煮液中蛋白质分子量主要分布在20.1 kDa以上,因此可以采用10 kDa中空纤维膜进行蒸煮液蛋白的浓缩制备。
对浓缩后的蒸煮液进行成分分析,结果如下:水分含量91%,粗蛋白质含量0.16%,脂肪含量0.16%,灰分1.17%。
2.2 蛋白酶的选择
各蛋白酶酶解蒸煮液产物的羟自由基清除率如图3所示。
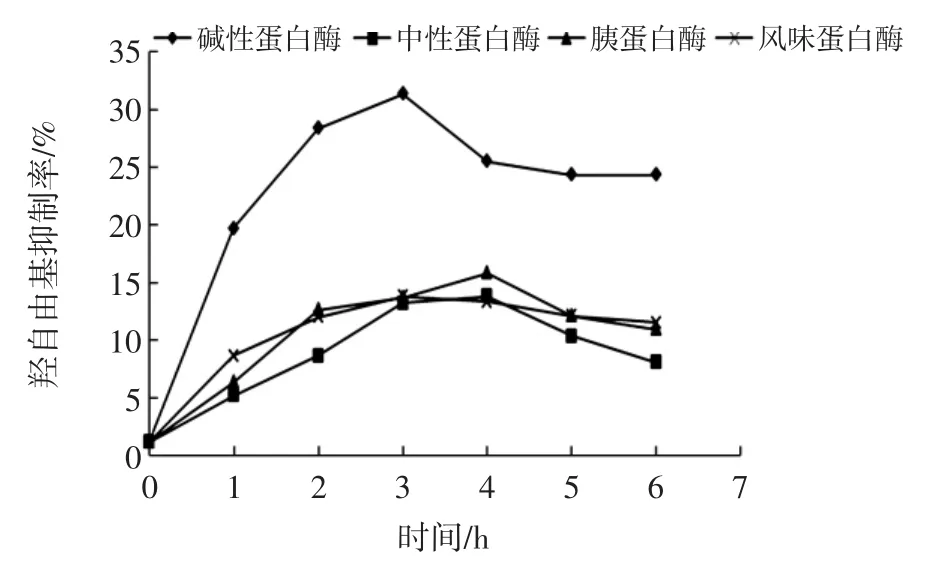
图3 4种蛋白酶的羟自由基清除率随反应时间的变化曲线Fig.3 Curves of hydroxyl radical scavenging activity of different reaction time by four proteases
可以看出,碱性蛋白酶酶解产物的羟自由基清除效果最好,反应3 h后产物的羟自由基清除率可达31%;胰蛋白酶次之,反应时间4 h后产物的羟自由基清除率为16%。所以后续选择碱性蛋白酶和胰蛋白酶的酶解工艺进行深入研究。
2.3 酶解蒸煮液条件的单因素分析
2.3.1 碱性蛋白酶酶解蒸煮液条件
在反应温度为50℃,反应pH值为9,反应时间为3 h的条件下,酶添加量对于酶解产物的羟自由基清除率影响如图4所示。
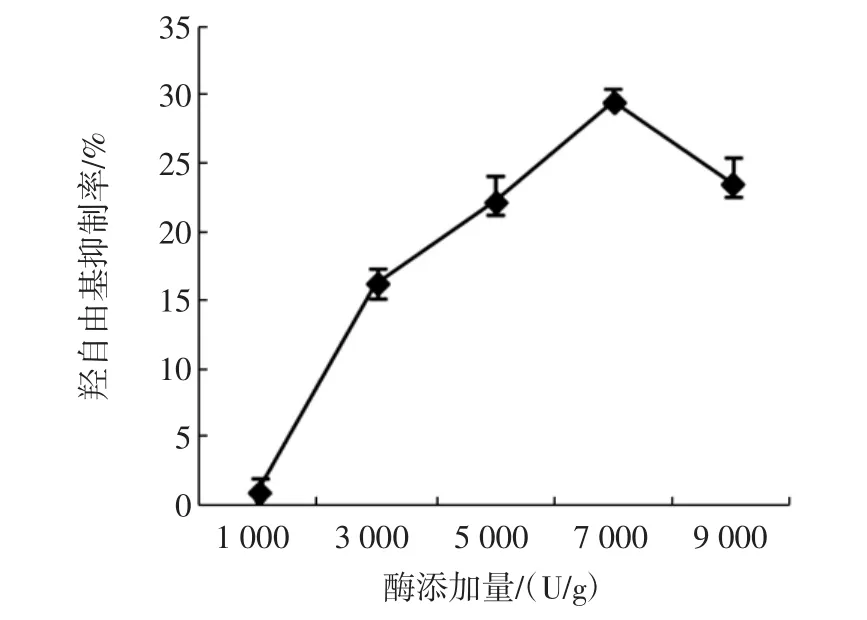
图4 碱性蛋白酶添加量对羟自由基清除率的影响Fig.4 Effects of alcalase addition on hydroxyl radical scavenging activity
可以看出,随着酶添加量的增加,羟自由基清除率先增加后减小。羟自由基清除率在酶添加量为7 000 U/g时达到最大。
在酶添加量为7 000 U/g,反应pH值为9,反应时间为3 h的条件下,反应温度对于酶解产物的羟自由基清除率影响如图5所示。
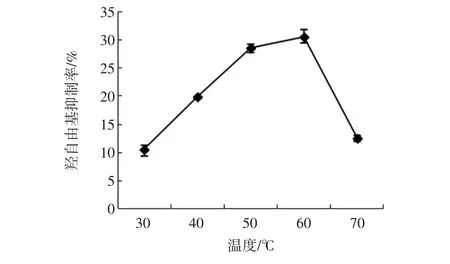
图5 反应温度对羟自由基清除率的影响Fig.5 Effects of reaction temperature on hydroxyl radical scavenging activity
可以看出,在一定的范围内,随着温度的增加,酶解液的羟自由基清除率呈现增长的趋势,在60℃达到最大值。
在酶添加量为7 000 U/g,反应温度为60℃,反应时间为3 h的条件下,不同反应pH值对酶解产物羟自由基清除率的影响如图6所示。
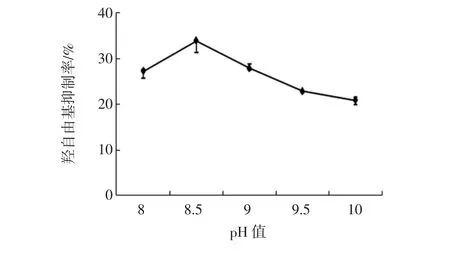
图6 反应pH值对羟自由基清除率的影响Fig.6 Effects of reaction pH on hydroxyl radical scavenging activity
可以看出,羟自由基清除率随着反应pH值的增大呈现先增后减的趋势,在pH 8.5时达到最大值。
在酶添加量为7 000 U/g,反应温度为50℃,反应pH值为8.5,不同反应时间对酶解产物羟自由基清除率的影响如图7所示。
可以看出,随着反应时间的延长,羟自由基清除率呈现出一个缓慢的增长再下降的趋势。在反应3 h,对应水解液羟自由基清除率达到最高,与图3测定的结果一致,所以取3 h为碱性蛋白酶酶解反应时间。
2.3.2 胰蛋白酶酶解蒸煮液条件
在反应温度为45℃,反应pH值为7,反应时间为4 h条件下,不同酶添加量对酶解产物羟自由基清除率的影响如图8所示。
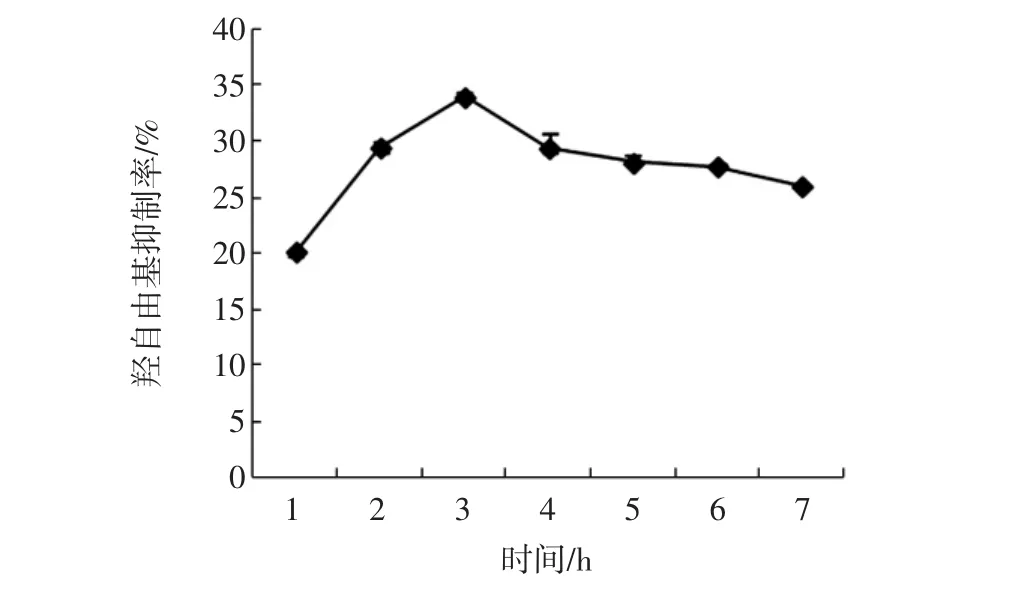
图7 反应时间对羟自由基清除率的影响Fig.7 Effects of reaction time on hydroxyl radical scavenging activity
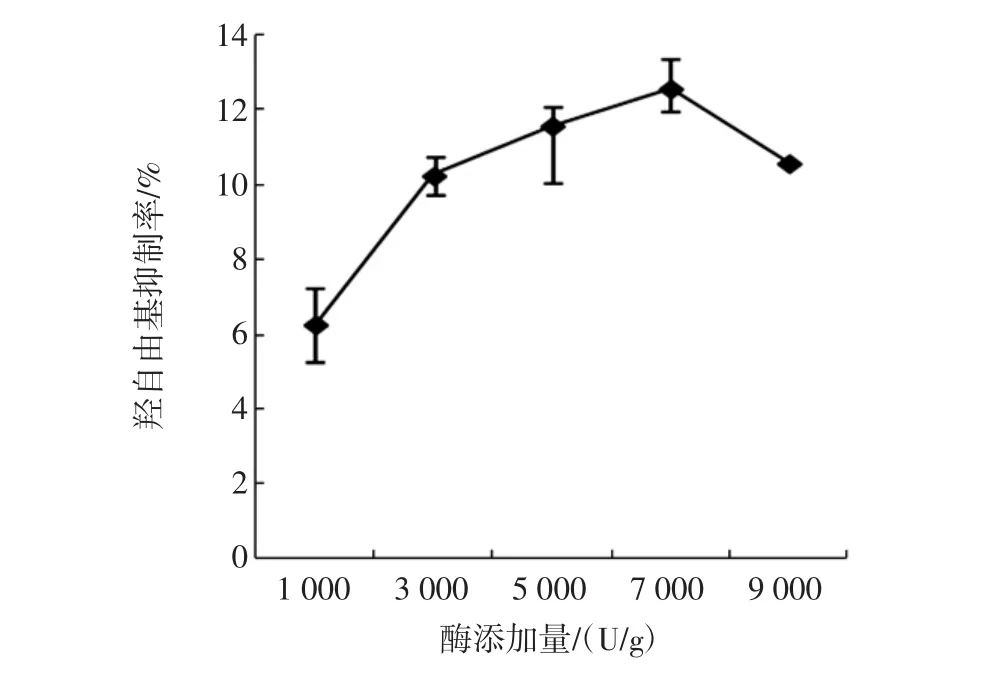
图8 胰蛋白酶酶添加量对羟自由基清除率的影响Fig.8 Effects of trypsin addition on hydroxyl radical scavenging activity
可以看出,羟自由基清除率先随着酶添加量的增加而增大,在酶添加量为7 000 U/g时达到最大。
在酶添加量为7 000 U/g,反应pH值为7,反应时间为4 h条件下,不同反应温度对酶解产物羟自由基清除率的影响如图9所示。
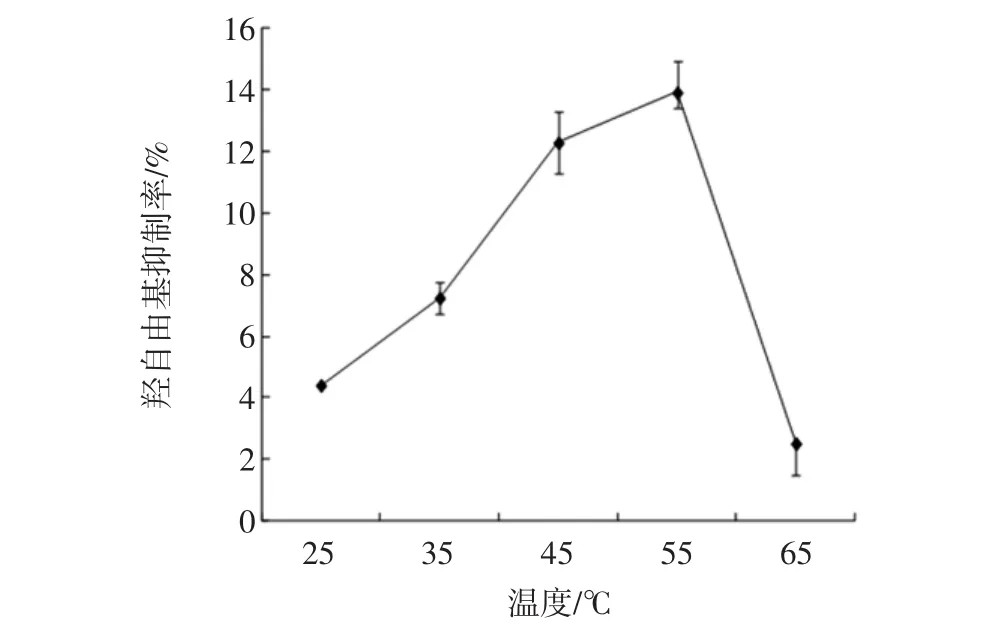
图9 反应温度对羟自由基清除率的影响Fig.9 Effects of reaction temperature on hydroxyl radical scavenging activity
可以看出,羟自由基清除率随着温度的增加先增大后减小,在55℃时达到了最大。
在酶添加量为7 000 U/g,反应温度为45℃,反应时间为4 h条件下,不同反应pH值对酶解产物羟自由基清除率的影响如图10所示。

图10 反应pH值对羟自由基清除率的影响Fig.10 Effects of reaction pH on hydroxyl radical scavenging activity
可以看出,羟自由基清除率随着反应pH值的增加而增大,在pH7.0时达到最大值,而后缓慢下降。
在酶添加量为7 000 U/g,反应温度为45℃,反应pH值为7,不同反应时间对酶解产物羟自由基清除率的影响如图11所示。
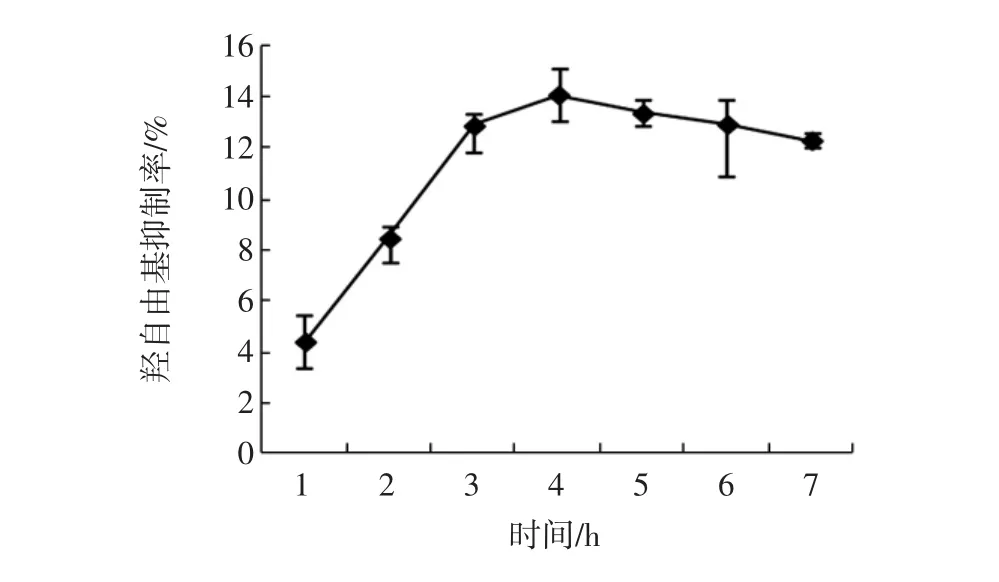
图11 反应时间对羟自由基清除率的影响Fig.11 Effects of reaction time on hydroxyl radical scavenging activity
可以看出,当反应时间为4 h时,羟自由基清除率达到最大值,与图3测定结果一致,所以选取4 h为胰蛋白酶酶解反应时间。
2.4 酶解蒸煮液条件的响应曲面分析
2.4.1 碱性蛋白酶
在单因素试验结果(酶添加量7 000 U/g,反应温度50℃,反应pH 8.5,反应时间3 h)的基础上,通过响应曲面法设计试验,对碱性蛋白酶酶解条件进一步优化。响应曲面试验各因素水平及编码见表1。
设计及结果如表2所示。
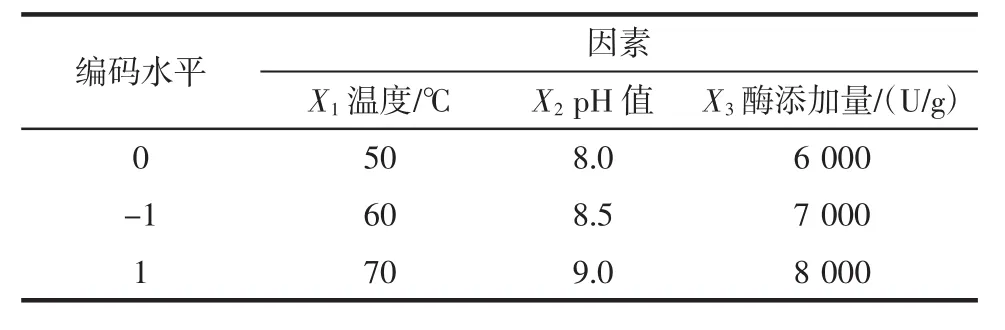
表1 响应曲面试验设计试验因素水平表Table 1 Factors and levels of RSM experiments
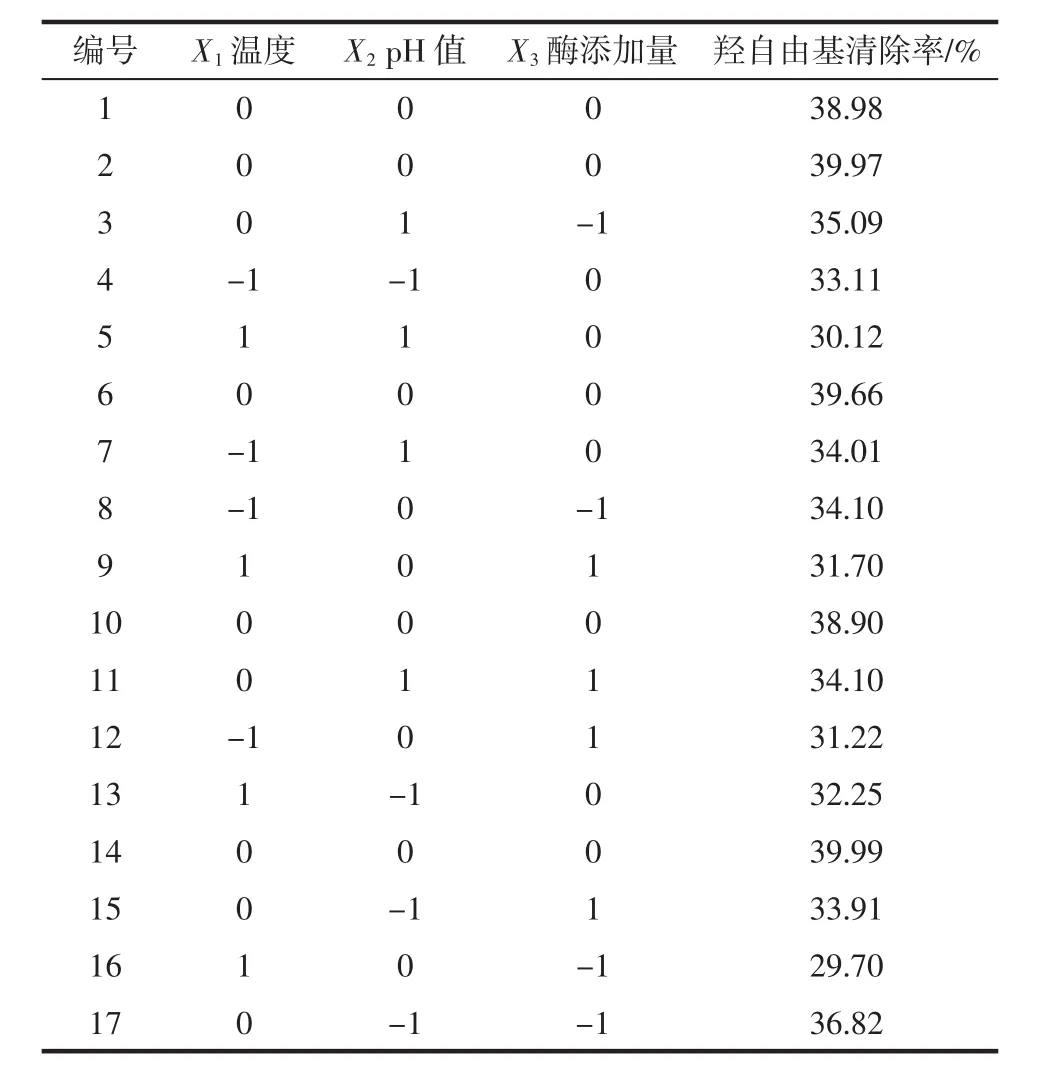
表2 响应曲面试验方案及结果Table 2 Design matrix and the corresponding results of RSM experiments
利用Design-Expert 8.0软件对试验数据进行二次多项回归拟合,得到二次多项式回归方程:
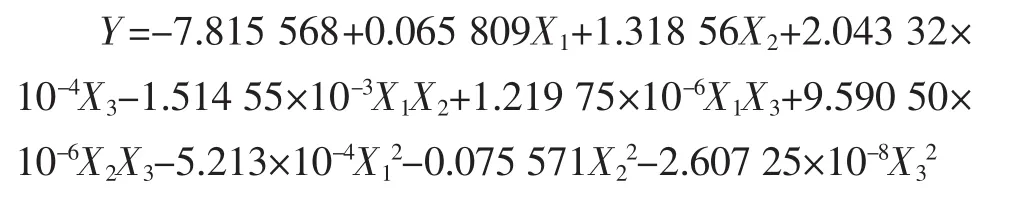
对模型进行方差分析,如表3所示。

表3 方差分析表Table 3 Analysis of variance table
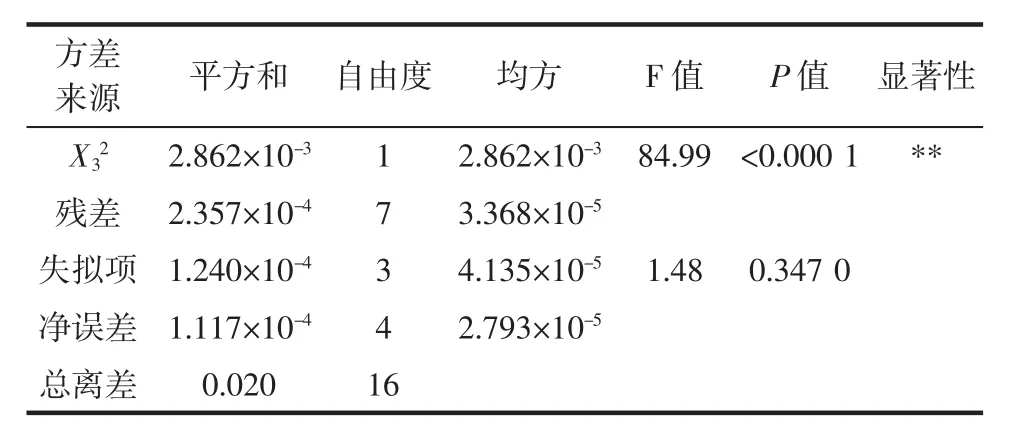
续表3 方差分析表Continue table 3 Analysis of variance table
模型P值小于0.000 1,说明模型效应显著;失拟项P=0.347 0大于0.05,表明方程对实验的拟合程度比较好。其中 X1,X3,X1X2,X1X3,X12,X22和 X32项对羟自由基抑制率有显著影响;X2项(即pH值)对回归方程的影响不显著,而其对应的平方项影响显著,说明实验选取的pH值水平已经较好地接近于最优解附近的曲面中心区域。由各项的F值可知,各个因素对羟自由基清除率的影响程度依次为:反应温度>酶添加量>pH值。
为验证模型预测的可靠性,在最优条件下进行反应,进行3次平行试验,得到羟自由基清除率平均值为39.53%,与预期值(39.59%)的相对误差很小,说明了优化试验结果的可靠性。
利用已建立的数学模型对反应温度、pH值、酶添加量等条件进行优化,得出:反应温度58.59℃,反应pH8.45,酶添加量为6 752.46 U/g,在此条件下,羟自由基清除率为39.59%。
2.4.2 胰蛋白酶
在单因素试验结果(酶添加量7 000 U/g,反应温度45℃,反应pH 7,反应时间4 h)的基础上通过响应曲面法设计试验,对胰蛋白酶酶解条件进一步优化。响应曲面试验各因素水平及编码见表4。
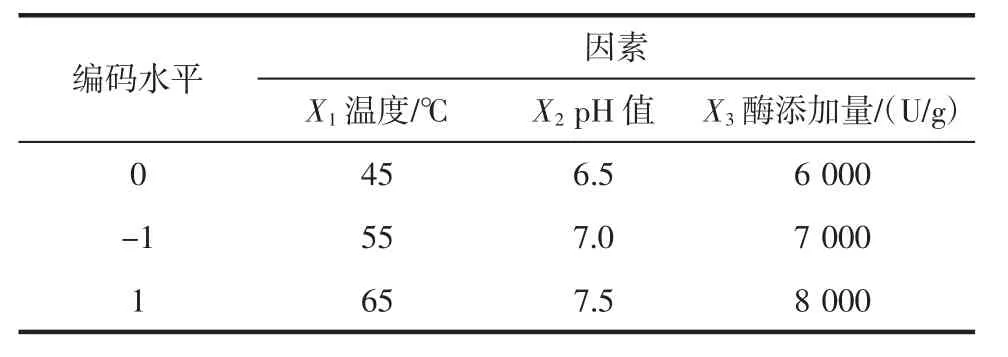
表4 响应曲面试验设计试验因素水平表Table 4 Factors and levels of RSM experiments
响应曲面试验设计及结果如表5所示。
利用Design-Expert 8.0软件对试验数据进行二次多项回归拟合,得到二次多项式回归方程:

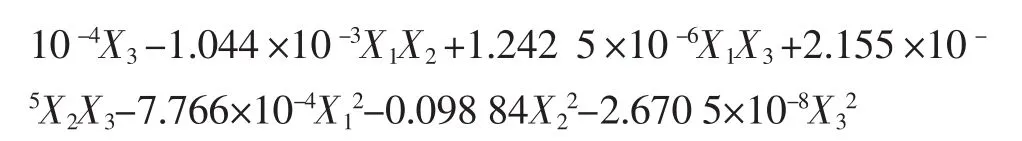
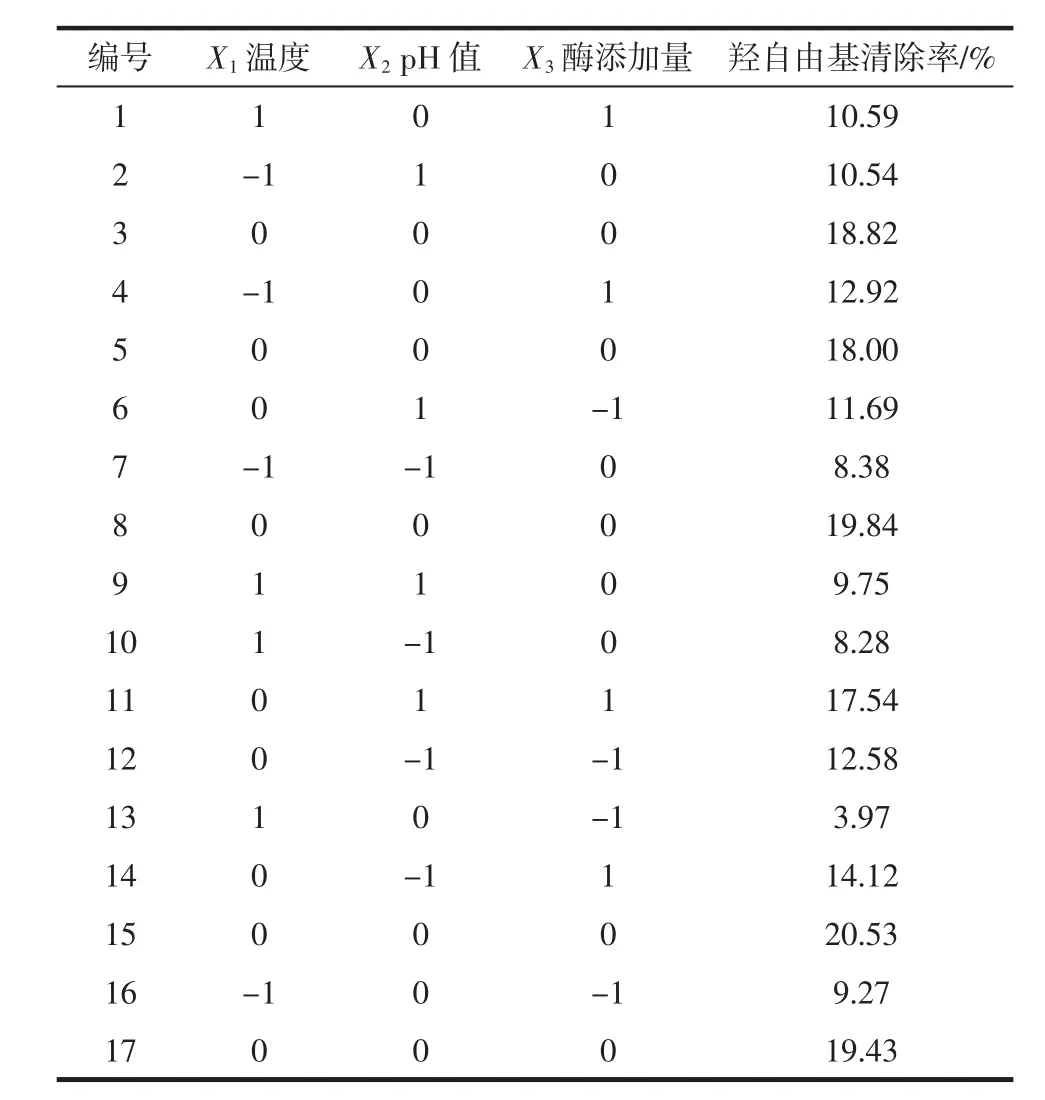
表5 响应曲面试验方案以及结果Table 5 Design matrix and corresponding results of RSM experiments
对模型进行方差分析如下表6所示。
模型P值小于0.000 1,模型效应显著;失拟项P=0.203 6大于0.05,表明方程对试验的拟合程度比较好。其中 X1,X3,X12,X22,X32对羟自由基抑制率有显著影响;一次项X2即为pH值对回归方程的影响不显著,但是其对应的平方项则影响显著,说明该因素所取的试验水平,整体已经较好地接近最优解附近的曲面中心区域。根据各项的F值可知,单因素影响程度分别是:酶添加量>反应温度>pH值。
为验证模型预测的可靠性,在最优条件下进行反应,进行了3次平行试验,得到的羟自由基清除率平均值为19.83%;与预期值(19.94%)的相对误差很小,说明了优化试验结果的可靠性。
利用已建立的数学模型对反应温度、pH值、酶添加量等条件进行优化,得出:反应温度为54.48℃,反应pH7.12,酶添加量为7 450.54 U/g,在此条件下,羟自由基清除率为19.94%。
2.5 复合蛋白酶酶解工艺研究
根据上述两个单酶的响应曲面试验可以确定,无论是碱性蛋白酶还是胰蛋白酶,在单酶酶解过程中影响作用都是反应温度>反应pH值;所以在设计复合酶酶解试验时,统一反应pH值,而在不同的反应阶段,改变两种蛋白酶的酶解反应温度。
根据单酶响应曲面的优化结果,碱性蛋白酶的反应温度设为59℃,而胰蛋白酶的反应温度设为55℃,反应pH值统一设定为pH 8。
根据获得碱性蛋白酶和胰蛋白酶解蒸煮液的最有条件,设计的4种复合酶反应体系如表7所示。酶解产物的羟自由基清除率如图12所示。

表7 不同复合酶酶解反应体系Table 7 Experiments for different kinds of compound proteases

图12 复合酶组合反应对羟自由基抑制率的影响Fig.12 Effects of mixed proteases on hydroxyl radical scavenging activity
可以看出,试验方案4(先添加胰蛋白酶,反应时间4 h,反应pH8,反应温度55℃;再添加碱性蛋白酶,反应时间3 h,反应pH8,反应温度59℃。)的效果最好:即先添加胰蛋白酶进行反应,酶添加量7 450.54 U/g,温度55℃,pH 8,反应时间4 h;再添加碱性蛋白酶进行反应,酶添加量6 752.46 U/g,温度59℃,pH 8,反应时间3 h。其对应的羟自由基清除率高达61%,比碱性蛋白酶单酶水解结果39.53%提高了21.47%,比胰蛋白酶单酶水解结果19.83%提高了40.17%,而且要高于碱性蛋白酶单酶)和胰蛋白酶单酶的测定结果叠加之和。由此可见,使用复合酶酶解能够实现酶切位点的互补,得到更多具有生物活性的肽段,进一步提高水解液的抗氧化活性。
3 结论
1)采用SDS-PAGE方法测定鲭鱼罐头蒸煮液中的蛋白分子量主要分布在20.1 kDa以上,选择10 kDa的中空纤维膜对蒸煮液蛋白进行浓缩,相比于蒸煮原液的1%蛋白含量,浓缩后蛋白含量提高了4倍。
2)以羟自由基清除率为指标,对风味蛋白酶、胰蛋白酶、碱性蛋白酶和中性蛋白酶的酶解效果进行比较,得出胰蛋白酶、碱性蛋白酶的水解效果较好。
3)以羟自由基清除率为指标,对碱性蛋白酶的酶解工艺进行单因素优化试验,再采用响应曲面实验设计对碱性蛋白酶的酶解工艺进行进一步优化,得出最佳条件为:反应温度58.59℃,反应pH8.45,酶添加量为6 752.46 U/g,在此条件下,羟自由基清除率为39.59%。
4)以羟自由基清除率为指标,对胰蛋白酶的酶解工艺进行单因素优化实验,再采用响应曲面试验设计对胰蛋白酶的酶解工艺进行进一步优化,得出最佳条件为:反应温度为54.48℃,反应pH7.12,酶添加量为7 450.54 U/g,在此条件下,羟自由基清除率为19.94%。
5)根据响应曲面的影响因素大小关系,设计出胰蛋白酶和碱性蛋白酶的复合酶解反应条件,得出复合分段酶解的效果最好。最佳的工艺条件为:先添加胰蛋白酶进行反应,温度为55℃,酶添加量为7 450.54 U/g,反应pH为8,反应时间为4 h;而后添加碱性蛋白酶进行反应,酶添加量为6 752.46 U/g,温度为59℃,反应pH为8,反应时间为3 h。其对应的羟自由基清除率达到了61%。
[1]孙晓莲.低值水产品及加工废弃物的综合利用 [J].食品研究与开发,2009,30(3):158-161
[2]周晓蕾.鳀鱼蒸煮液膜浓缩回收技术的研究[D].上海:上海海洋大学,2011
[3]钱名全.水产品加工下脚料和废弃物的综合利用[J].渔业致富指南,2004(3):24-27
[4]Jao C L,Ko W C.Utilization of cooking juice of young tuna processed into canned tuna as condiments:effect of enzymatic hydrolysis and membrane treatment[J].Fisheries Science,2002,68:1344-1351.
[5]Jao CL,Ko WC.Effect of enzyme treatment upon hydrolysis of proteins from the cooking juice of tuna[J].Food Sci Agri Chem,2000(2):226-232
[6]Cheng ML,Wang HC,Hsu KC,et al.Anti-inflammatory peptides from enzymatic hydrolysates of tunna cooking juice[J].Food and A-gricultural Immunology,2015,26(6):771-781
[7]谢主兰,涂苏红,陈龙,等.相应面法优化酶法制备低盐虾酱的工艺[J].中国酿造,2013,30(1):40-45
[8]Venugopal V,Shahidi F.Thermostable water dispersion of myofibrillar proteins from Atlantic Macherel(Scomber scombrus)[J].Food Sci.,1994,59(2):265-268
[9]柯虹乔,酶解金枪鱼头蛋白制备抗氧化活性肽的研究[D].湛江:广东海洋大学,2011
[10]Sanchez MC.Review:Method used to evaluate the free radical scavenging activity in foods and biological systems[J].International Journal of Food Science&Technology,2002,8(3):121-137
[11]Hwang JS,Ko W C.Angiotensin I-converting enzyme inhibitory activity of protein hydrolysates from tuna cooking juice[J].Journal of Food and drug Analysis,2004,12:62-68
[12]林伟锋.可控酶解从海洋鱼蛋白中制备生物活性肽的研究[D].广州:华南理工大学,2003
[13]Hsu KC,Lu GH,Jao CLA.Antioxidative properties of preptides prepared from tuna cooking juice hydrolysates with orientase(Bacillus subtilis)[J].Food Research International,2009,42:647-652
[14]中华人民共和国国家卫生和计划生育委员会.GB5009.3-2016食品安全国家标准食品中水分的测定[S].北京:中国标准出版社,2016
[15]中华人民共和国卫生部.GB5009.5-2010食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2010
[16]李春美,窦宏亮,陈美红,等.儿茶素氧化产物的分离鉴定及其抗氧化活性研究[J].食品科学,2008,29(12):141-145

