美国药品可负担性的影响因素考察
张天翔 黄宇玮(共同第一作者) 刘 宝
美国是卫生总费用和人均卫生费用最高的国家,卫生总费用已达到国内生产总值的 18%。美国的药品费用也居高不下,2016年美国药品费用达4500亿美元,约占美国个人医疗费用的 17%[1]。研究表明,美国高额的卫生费用投入并未产出与其他发达国家可比的健康绩效,而且处方药费用是美国卫生费用中增长最快的部分,增长速度显著高于通货膨胀率和家庭收入的增长,从而使得美国药品可负担性(affordability)问题凸显[2]。虽然,我国医药卫生体系与美国有很大不同,但我国药品费用长期居高不下,相应的可负担性问题也备受关注。本文将基于文献,围绕美国药品可负担性的影响因素,从药品价格、研究与开发费用、药品营销和流通、药品进口、保险设计等方面进行阐述,以期为我国药品可负担性的相关管理和决策提供参考。
1 药品价格
就药品可负担性而言,药品价格常作为首先考虑的因素。美国没有全国层面的药品价格管制,市场机制是主导。这与许多其他国家不同,对药品价格进行管制是许多国家的普遍做法,例如澳大利亚和德国的药品参考定价、加拿大的专利药价格管理、英国的药品利润控制、印度的基本药物制度等。
首先看品牌药(brand-name drugs)的价格情况。研究显示,美国品牌药价格持续上升,2000—2008年间有 416个品牌药的价格显著上升。这些品牌药的价格增幅主要在100%~499%之间,一些用于治疗真菌或病毒感染、心脏疾病的药品,其价格增长超过1000%。而且还有研究显示,268个销售额最高的品牌药在2006—2015年间大多数年份的增幅均远高于相应的物价指数,例如与2014年相比,2015年品牌药价格增幅为 15.5%,物价指数仅增 0.1%。品牌药的上市价格水平以及上市后价格都出现上升,专业药品(Specialty drugs)的价格涨幅更高。数据表明,抗癌药在过去15年间平均上市价格每年增长约8500美元,上市后价格的持续增长也备受关注。药品上市价格及上市后的变化体现了美国药品价格形成的复杂市场力量。制药企业和流通企业经常调整价格,这是因为制药企业和流通企业给予药品福利管理公司(PBMs)、保险公司、批发商、零售商和其他有关利益方的折扣策略随市场而变;而且由于通常难以获得这些折扣信息,消费使用端实际面对的净价格也难以确定[1,3]。
其次看仿制药(generic drugs)。仿制药现在占到美国所有处方的90%[4]。美国的仿制药价格也比其他国家低[5]。一般认为,仿制药进入市场后会倾向于按边际成本定价,当仿制药进入市场,其会降低品牌药的市场份额,这会对品牌药形成降价压力。
但是,有限的仿制药进入并不一定会使价格下降。在1980年,仿制药仅占处方的20%,许多昂贵的品牌药即使在专利过期后仍然没有仿制药上市[6]。显然,如果在仿制药替代品之间没有形成充分竞争,药品价格并不会降至预期的竞争水平。通常要使药品价格降到最低水平(主要基于生产成本),需要多个竞争性的仿制药企业进入市场。因此,如何加快推动食品药品监督管理局(FDA)对仿制药的审批至关重要。但实际的审批积压问题仍然十分严峻,截至2017年4月1日,美国FDA尚有2640个仿制药待批[7]。缺乏竞争和FDA审批缓慢还可能导致仿制药价格短期骤增。美国国会下属的政府审计局(GAO)考察了1400个仿制药的历史价格,发现351个在一年间出现异常价格增长的例子,其中一种用于治疗强迫症的抗抑郁仿制药的费用在 1年内增长20倍[8-9]。
关于仿制药供给结构与价格关系的研究进一步显示,近年来仿制药企业数量在下降(中位数为2)。而且研究发现,大多数仿制药企业生产的药品种类很少(少于5个药品),个别仿制药巨头企业则拥有数百甚至上千个药品生产[10]。事实上,在2010年平价医疗法案实施以后,伴随供给结构的垄断特征不断加强,仿制药价格也在提高。
此外,生物类似药(Biosimilars)的发展近年来备受关注,相关制度建设推进很快,专门的《生物药价格竞争及创新法案》(简称“BPCIA”)有力地支持了生物类似药的价格竞争和创新。兰德公司估计,如果生物类似药的应用覆盖所有治疗类别,在2014—2024年间的节约达130~660亿美元[11]。
2 药品研究与开发费用
由于研发费用需要通过药品销售收入给予补偿,因此,研发费用的增长又会导致药品价格上升,进而影响药品的可负担性。
长期以来,药品研发费用的估计研究广受关注。Morgan等2011年的研究认为,研发1个药品的费用估计在1.6~18亿美元之间[12]。DiMasi等2016年的研究则显示,1个药品成功上市的费用约为26亿美元,如果纳入上市后的费用则将达到约28.7亿美元[13]。2017年发布的一项关于癌症药品研发费用的研究(考察了10家企业生产的10个癌症药品)估计研发1个癌症药品的费用在1.6~19.5亿美元,中位数约6.5亿美元,如果纳入机会成本,则达到7.6亿美元[14]。而且不可忽略的是,那些最终未能成功上市的药品的大量研发费用依然需要由制药企业承担。
还有研究估计了仿制药的简略新药申请(Abbreviated New Drug Applications,ANDAs)的研发费用,口服片剂和胶囊的 ANDAs直接费用在100~500万美元[15],与其潜在的利润相比这个费用水平并不高。关于注射药品ANDAs直接费用还缺乏研究。
3 药品营销和流通
药品供应链的各个环节都影响着药品流通,患者和临床医生的选择直接关系到制药企业的利益。因此,通过各种渠道影响其决策就成为制药企业关注的焦点,在美国常见的方法包括给予PBM和批发企业折扣、直接对消费者的药品广告,以及对消费者的直接折扣。在发达国家中,仅美国与新西兰允许直接对消费者进行处方药广告。研究显示,2016年美国直接对消费者的药品广告费用约为52亿美元,其中绝大部分花在电视营销[16]。
药品营销成本构成了制药企业整体成本的一部分,但营销将提高处方药的使用,强化对特定药品的处方行为(如处方那些比其他治疗更贵的广告药品),甚至可能导致过度处方。营销活动会促进新患者的药品使用并提高对处方药品的依从性,但直接面向消费者的广告也可能提高对昂贵品牌药的需求。而且,在医患沟通时间已经非常有限的情况下,即使临床医生不处方广告药品,向患者解释为什么不用广告药品本身就需要花费一定时间,客观上增加了医患沟通压力,进而增加药物的治疗成本[17]。
在存在仿制药或其他品牌药竞争的情况下,专利药企业经常采用对消费者直接折扣的营销策略(如共付券)。对于有处方药保险的患者,直接折扣能很大程度上抵消共付段患者的自费压力,但是却会推动处方药保险年度保费的提高。近期的一项研究估计,共付券将使品牌药的销售额增加60%以上,该增加主要源于仿制药竞争对手药品销售的减少,而且共付券增加了处方药保险的成本[18]。
4 药品进口
在美国,从其他国家进口处方药(特别是仿制药和生物类似药)长期被认为是降低处方药价格和应对药品短缺的一个方法,理由是从其他具有高质量生产体系的国家(并且可能存在政府价格管制)进口低价药品,将使美国制药企业面临竞争,从而促使其降低价格。另一方法是“再进口”(reimportation),即美国的批发商和药店进口和销售那些在美国生产但是却在其他国家以较低价格销售的品牌药(只要FDA批准同样的药品可在国内使用,并且同一药品在美国的价格要高于其他国家)。
虽然,进口和再进口处方药在过去20年间是美国国会经常讨论的议题,在一些州和地区也有试点,但迄今进口和再进口仍被禁止。美国FDA禁止进口那些为美国以外市场而生产的药品[19]。2000年美国国会通过药品公平和药品安全法案(Medicine Equity and Drug Safety Act),允许从特定的一些国家再进口处方药,美国国会还在 Medicare现代化法案(Medicare Modernization Act)中也授权再进口(仅限加拿大)。两项法案都要求证明再进口药品是安全而且可以显著降低成本,但由于美国健康和人类服务部的反对,这两项法案都未能实施。
需要注意的是,进口和再进口将使制药企业降低其在研发上的投资。而且即使今后允许进口或再进口,也不能肯定其在多大程度上降低美国药品费用,因为这不仅受进口或再进口的药品来自哪个国家的影响,也受美国制药企业的应对举措影响。美国国会预算办公室估计,如果允许从25个国家再进口将在10年间节约400亿美元,但另一研究则认为这样的节约要小得多,大约在每年17亿美元[20]。
5 保险设计
保险设计是影响医疗服务可负担性的重要因素,药品也不例外,对改善患者药物可及性和依从性都有巨大作用。2010年美国平价医疗法案实施后,参保人数增加显著,但 65岁以下的人群中仍有约10%没有医疗保险(并且没有处方药保险覆盖)。而且,无论是65岁以下的人群还是Medicare参保人群,拥有保险的人也并不都是有处方药保险覆盖的。进入Medicare Part D药品计划的参保对象可以获得处方药保险覆盖,但由于是自愿参加,实际上仅 74%的Medicare参保人参加Part D计划。虽然其他还有一些药品保险渠道(如退伍军人事务部),但估计仍约有12%的Medicare参保对象缺乏药品保险覆盖[21]。
即使有处方药保险,自付费用仍可能形成较大的财务负担,特别是对使用高价品牌药的患者。一项调查显示,调查对象中大约有1/4报告付不起处方药费用,有1/4报告因经济原因而未取药、减少服药次数或降低服用剂量[22]。保费、起付线以及共付段所对应的自付费用都影响着药品的可负担性,美国的药品支付制度日趋严格,高价药的成本分担也转向以比例为基础。
图1显示了Medicare Part D处方药保险的具体设计[23]。2018年起付线为405美元,然后进入起始支付段(initial coverage period)的25%自付(直至起始支付段的上限,即总药费 3750美元),再进入支付缺口段(coverage gap)更高的自付比例(品牌药自付35%,仿制药自付44%),直至2018年个人总自付费用达到5000美元(总药费8418美元)。进入灾难性支付段(catastrophic coverage)后,Medicare支付药品费用的大部分(80%),Part D支付15%,个人自付5%。显然,即使达到灾难性支付阈值,高自付费用风险仍然存在,因为该阈值并非自付费用的硬封顶,如果每年药费达上万美元或更多,患者在灾难性支付段的自付费用将高于之前各支付段的总自付费用。2015年有360万Medicare参保人的总药费高于Part D的灾难性阈值,其中有100万人发生的个人自付药费超过阈值[24]。但从时间序列来看,2006年以来特别是近年来,起始支付段上限的提高幅度要大于灾难性支付阈值的提高,在一定程度上促进了药品可负担性[23]。
Medicare支付咨询委员会已建议取消参保人在灾难性支付阈值以上的比例分担。而且,为避免制药企业提高药品价格,建议提高灾难性支付段Part D计划的支付比例(高于目前的15%),从而促进Part D计划加强高价药谈判获得更大折扣,以及加强药品使用管控[25]。
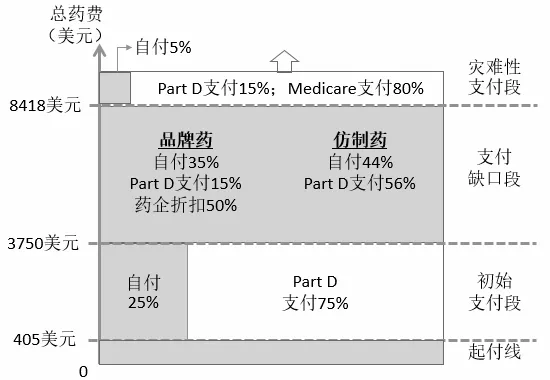
图1 美国Medicare处方药保险(2018年)[23]
6 其他影响因素
除以上阐述的影响因素外,患者协助项目(patient assistance program)、联邦药品折扣项目、罕见病政策以及药品短缺与浪费、处方者补偿(Prescriber Reimbursement)等问题也对药品可负担性带来影响。
为减轻患者费用负担,制药企业通过开展(仿制药企业通常不开展)患者协助项目,承担患者购买品牌药的个人自付的全部或部分费用。主要以患者的保险类型和收入水平为进入项目与否为依据。常见的做法既有向患者提供药品的,也有通过券、卡、疾病基金等多种方式直接支付给患者的。实际上是将患者面对的品牌药价格拉低至接近甚至低于仿制药价格。制药企业常通过推出患者协助项目打击仿制药竞争对手,以促进对品牌昂贵药品的使用。但这并不会减少保险方的费用压力,因为受协助的患者将更倾向于选择品牌药而非仿制药,从而推高保险支付的整体费用。总体上看患者协助项目还缺乏足够的透明性,相关监管也欠缺。Medicare Part D计划则不允许通过患者协助项目获取药品。
联邦政府还通过药品折扣项目提高药品的可负担性,著名的有1991年生效Medicaid药品折扣项目(Medicaid Drug Rebate Program,MDRP)。在MDRP框架下,制药企业通过和美国健康与人类服务部签署的折扣协议,以换取Medicaid对该企业生产的所有药品进行支付,以及通过Medicare Part B对覆盖的相关门诊药品进行支付。目前约有 600家企业进入该协议[26]。通过MDRP获得的折扣具有法定性,各州还可在该法定折扣之上就额外的折扣进行谈判。而且,对创新药和非创新药实行区别的折扣安排,对创新药的单位折扣量(unit rebate amount)至少为非创新药的1.8倍[27]。
罕见病药物可负担性也备受关注。事实上为满足罕见病(rare diseases)药物需求,美国于1983年就通过了孤儿药法案(Orphan Drug Act)推进孤儿药的生产供应。但由于适用人群规模小,也几乎没有竞争企业,罕见病药物通常为生物药(biologics),也不易于有仿制药竞争,因此,罕见病药物通常价格较高。2016年美国药品总销售额中7.9%是孤儿药费用,1993年该比例仅为3%。2015年到2016年孤儿药的销售额增加了12.2%,远高于非孤儿药 2.4%的增幅。到 2020年孤儿药全球销售额估计将达到2090亿美元(大约为除仿制药外的处方药销售额的21%)。在美国,孤儿药的每例患者中位费用是非孤儿药的5.5倍,费用排前100位孤儿药2016年的年平均费用为140 443美元,而非孤儿药为27 756美元[1,28]。此外,还出现了一些利用孤儿药身份快速扩张并成为市场重磅药品的情况[29]。
7 启示
美国是全球药品研发强国,但高居不下的药品费用仍然带来突出的药品可负担性问题,美国药品可负担性受到药品价格、研发费用、营销和流通、药品进口、保险设计等一系列因素的影响,并构成一个高度交互的复杂体系,其所相应采取的一些治理机制和策略值得关注和参考。
首先,美国药品价格形成机制着眼于市场机制,注重促进仿制药的市场进入(目前仿制药占美国所有处方的90%),以及仿制药与品牌药之间、仿制药之间的竞争。而且,美国经验还提示有限的仿制药进入并不一定会使价格下降。这对我国推进仿制药一致性评价工作和相关仿制药政策设计具有重要参考意义,尤其是在落实2018年4月颁布的《国务院办公厅关于改革完善仿制药供应保障及使用政策的意见》过程中予以充分重视[30]。
其次,药品研发费用以及药品营销和流通费用都需要通过药品销售得以补偿,成本推动始终是影响药品可负担性的重要因素。而且,需要注意那些似乎直接减轻患者药费负担的营销策略,可能通过推高保费以及减少仿制药销售而间接影响药品可负担性,这种间接效应在制药企业开展的患者协助项目中也有体现。
第三,美国严控药品进口和再进口,这虽有安全性方面的合理考量,但毕竟无法基于低价进口药减轻国内患者的药品负担。我国的情形则很不同,由于创新能力的发展还需要相当一段时期,药品进口仍将是常态,降低进口药品价格的重要性不言而喻。2018年3月30日,国务院总理李克强在十三届全国人大一次会议举行闭幕后会见中外记者时提出,针对群众、患者急需的进口抗癌药品力争降到零税率[31],这至少提示了一个导向,对国内新药创制和改善药品可负担性也具有一定影响。而且,还有必要加强药品外部参考定价研究,建设好国际药品价格数据库,支撑优质低价药品的进口、国家谈判和支付决策。
第四,美国保险制度发达,但Medicare药品保险制度设计中存在非强制性所带来的处方药保险覆盖缺口,并且灾难性支付段以上的比例分担模式也对药品可负担性带来重要影响。我国在药品相关的保险制度建设中需吸取经验教训。
此外,美国联邦药品折扣项目力度巨大,政府谈判覆盖面广,针对创新药和非创新药都有安排(虽有区别)。我国也已开展的国家药品价格谈判范围目前仍主要着眼于创新药,未来应考虑适时进一步扩大,以更加全面地提高药品可负担性,与此同时也应注意美国联邦谈判不够透明的问题。美国经验还提示,罕见病药品负担的解决既要通过立法强力推动药品生产供应保障,又要注意管控市场对立法的不当利用,使罕见病药品可负担性持续维持在合理水平。
[1]QuintilesIMS.Medicines use and spending in the U.S:A review of 2016 and outlook to 2021[R].Parsippany NJ,QuintilesIMS Institute.2017.
[2]Washington DC.National Academies of Sciences,Engineering,and Medicine.Making medicines affordable:A national imperative[M].Washington:The National Academies Press,2018.
[3]Shih Y,Xu Y,Liu L,et al.Rising prices of targeted oral anticancer medications and associated financial burden on Medicare beneficiaries[J].J Clin Oncol,2017,35(22):2482-2489.
[4]Grabowski H,Long G,Mortimer R,et al.Updated trends in U.S.brand-name and generic drug competition[J].J Med Econ,2016,19(9):836-844.
[5]Wouters OJ,Kanavos PG,McKEE M.Comparing generic drug markets in Europe and the United States:Prices,volumes,and spending[J].Milbank Q,2017,95(3):554-601.
[6]Grabowski H,Long G,Mortimer R.Recent trends in brand-name and generic drug competition[J].J Med Econ,2014,17(3):207-214.
[7]FDA.The Generic Drug Review Dashboard as of April 1,2017[EB/OL].https://tinyurl.com/ybqky4gy.2017.
[8]GAO.Generic drugs under Medicare:Part D generic drug prices declined overall,but some had extraordinary price increases.GAO-16-706[S].Washington DC,U.S.Government Accountability Office,2016.
[9]Greene JA,Anderson G,Sharfstein JM.Role of the FDA in affordability of off-patent pharmaceuticals[J].JAMA,2016,315(5):461-462.
[10]Berndt ER,Conti RM, Murphy SJ.The landscape of U.S.generic prescription drug markets,2004–2016.No.w23640[R].Cambridge,MA,National Bureau of Economic Research,2017.
[11]Mulcahy AW,Predmore Z,Mattke S.The cost savings potential of biosimilar drugs in the United States[J].Santa Monica,CA,RAND Corporation,2014.
[12]Morgan S,Grootendorst P,Lexchin J,et al.The cost of drug development:a systematic review[J].Health Policy,2011,100(1):4-17.[13]DiMasi JA,Grabowski HG,Hansen RW.Innovation in the pharmaceutical industry: New estimates of R&D costs[J].J Health Econ,2016(47):20-33.
[14]Mailankody S,Prasad V.Pharmaceutical marketing for rare diseases:Regulating drug company promotion in an era of unprecedented advertisement[J].JAMA,2017,317(24):2479-2480.
[15]Berndt ER,Newhouse JP.Pricing and reimbursement in U.S.pharmaceutical markets.In P.M.Danzon and S.Nicholson (eds.),Oxford Handbook of the Economics of the Biopharmaceutical Industry[M].Cambridge,UK,Oxford University Press,2012:201-265.
[16]Robins R.Drug makers now spend $5 billion a year on advertising.Here’s what that buys[EB/OL].http://www.statnews.com/2016/03/09/drug-industry-advertising.2016.
[17]Mailankody S,Prasad V.Pharmaceutical marketing for rare diseases:Regulating drug company promotion in an Era of Unprecedented Advertisement[J].JAMA,2017,317(24):2479-2480.
[18]Ross JS,Kesselheim AS.Prescription-drug coupons—No such thing as a free lunch[J].N Engl J Med,2013,369(13):1188-1189.
[19]Bluth R.Should the U.S.make it easier to import prescription drugs?[EB/OL].http://www.pbs.org/newshour/rundown/u-s-make-easi er-import-prescription-drugs.2017.
[20]Danzon PM,Johnson SJ,Long G,et al.Commercial importation of prescription drugs in the United States:Short-run implications[J].J Health Polit Policy Law,2011,36(2):295-316.
[21]KFF (Kaiser Family Foundation).The Medicare Part D prescription drug benefit[EB/OL].https://www.kff.org/medicare/factsheet/the-medicare-prescription-drug-benefit-fact-sheet.2017.
[22]KFF (Kaiser Family Foundation) and Health Research &Educational Trust.Kaiser/HRET survey of employer-sponsored health benefits[EB/OL].http://files.kff.org/attachment/Report-Employer-Hea lth-Benefits-Annual-Survey-2017.2017
[23]KFF.The Medicare Part D prescription drug benefi.https://www.kff.org/medicare/fact-sheet/the-medicare-prescription-drug-benefit-fa ct-sheet.October 2017.
[24]KFF (Kaiser Family Foundation).No limit: Medicare Part D enrollees exposed to high out-of-pocket drug costs without a hard cap on spending[EB/OL].https://www.kff.org/medicare/issue-brief/nolimit-medicare-part-d-enrollees-exposed-to-high-out-of-pocket-drugcostswithout-a-hard-cap-on-spending.2017.
[25]MedPAC (Medicare Payment Advisory Commission). Medicare and the health care delivery system. Washington,DC: MedPAC[EB/OL].http://medpac.gov/docs/default-source/reports/jun17_reportt ocongress_sec.2016.2016.
[26]CMS. Medicaid drug rebate program[EB/OL].https://www.medicaid.gov/medicaid/prescriptiondrugs/medicaid-drug-rebate-progr am/index.html.2017.
[27]Health Affairs.Medicaid best pric[EB/OL].http://www.healthaffairs.org/healthpolicybriefs/brief.php?brief_id=173.2017.
[28]Evaluate Pharma.Orphan drug report[EB/OL].http://info.evaluategroup.com/rs/607-YGS-364/images/EPOD17.2017.
[29]Daniel MG,Pawlik TM,Fader AN,et al.The Orphan Drug Act:Restoring the mission to rare diseases[J].Am J Clin Oncol,2016,39(2):210-213.
[30]中华人民共和国务院办公厅.国务院办公厅关于改革完善仿制药供应保障及使用政策的意见(国办发〔2018〕20号)[S].北京:2018-4-3.
[31]央视网.李克强:抗癌药品力争降到零关税[EB/OL].http://news.cctv.com/2018/03/20/ARTIYhU0XqqTNRy29ityWSt3180320.shtml.2018-3-20.

