气道内超声弹性成像技术在纵隔淋巴结性质判定中的价值*
李灵芝,谷伟,唐云,苏宁静,舒雅,方苏榕
[1.南通大学附属吴江医院 呼吸科,江苏 苏州 215200;2.南京医科大学附属南京医院(南京市第一医院) 呼吸科,江苏 南京 210006]
目前,肺癌已成为发病率和死亡率最高的恶性肿瘤之一[1],其5年生存率仅16.00%[2]。肺癌治疗方式的选择、预后的评估都与分期密切相关[3]。而淋巴结转移作为肺癌常见转移途径,对确定肺癌的分期意义重大。因此,淋巴结性质的判定成为明确诊断和精准治疗的关键。超声内镜引导下的经支气管针吸活检术(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)在支气管镜前搭载超声探头,实现了实时超声引导下对纵隔淋巴结进行穿刺活检,对于明确纵隔淋巴结的性质发挥着重要作用。超声弹性成像(ultrasound elastography,UE)技术是一种测量组织应变性的超声相关新技术,已逐步联合经支气管针吸活检术(transbronchial needle aspiration,TBNA)技术用于肺癌纵隔淋巴结的诊断[4]。本研究旨在通过对纵隔淋巴结进行超声及弹性成像检查,并记录相关参数及图像,同时行EBUS-TBNA穿刺,阴性结果以手术及近3个月随访确认作为最终诊断结果,对比分析常规超声及弹性成像对淋巴结性质判定的诊断效能,从而评价UE对纵隔淋巴结良恶性的诊断价值。
1 资料和方法
1.1 一般资料
回顾性分析南京市第一医院呼吸科气管镜室2016年6月-2017年3月行EBUS-TBNA检查的46例患者。其中,男35例,女11例,年龄27~77岁,中位年龄为55岁。纳入标准:①行胸部增强CT检查,发现纵隔淋巴结肿大(≥1 cm)或行PET/CT检查显示18-FDG吸收增加(SUVmax>2.5);②经研究者评估确认可行EBUS-TBNA检查并能够耐受支气管镜及EBUS-TBNA检查;③年龄>18周岁并≤80岁;④心肺功能基本正常;⑤生化、凝血功能正常;⑥无艾滋病等传染病。排除标准:①无EBUS-TBNA检查适应证;②年龄≤18岁或>80岁;③活动性大咯血;④麻醉药物等气管镜检查所需药物过敏;⑤严重的心脑血管疾病、呼吸衰竭及肝肾功能不全;⑥全身状况极度衰竭;⑦凝血功能异常,或检查前1周内使用抗凝药物;⑧有不易控制的精神病史;⑨研究人员认为不适合入选的其他情况者。
1.2 仪器
奥林巴斯260电子支气管镜系统,包括超声内镜主机(EU-ME2)、超声内镜(BF-UC260FW)、电子支气管镜(BF-260)、21G穿刺针,上述器械均由日本奥林巴斯公司生产。
1.3 术前评估
由研究人员对患者的一般情况及胸部影像资料进行评估,确定符合入选标准后,将研究的目的和意义及操作存在的风险、可能的并发症等充分告知患者及家属,并与其签订内镜知情同意书及麻醉药品、第一类精神药品知情同意书。此项研究已通过南京市第一医院伦理委员会批准(伦理号:YL20160713-020)。
1.4 麻醉方法
1.4.1 局部麻醉 2%利多卡因(5 ml∶0.1 mg中国大冢制药有限公司)5 ml雾化吸入后,给予利多卡因喉头喷雾器在患者喉头喷雾数次,至咽喉有麻木感。再给予环甲膜穿刺注入1~3 ml利多卡因(咯血、剧烈咳嗽者除外)。
1.4.2 清醒镇静 患者平卧,吸氧,监测脑电双频谱指数及心率、血压、指脉氧饱和度等指标。静脉注射咪达唑仑(2 ml∶10 mg江苏恩华药业股份有限公司)0.05 mg/kg及芬太尼(2 ml∶0.1 mg宜昌人福药业有限公司)0.02 mg/kg,观察3~5 min后静脉注射丙泊酚(20 ml∶200 mg西安力邦制药有限公司)2.00 mg/kg,操作过程中维持脑电双频谱指数值在65~85,必要时加用镇静镇痛药。
1.5 操作过程
1.5.1 电子支气管镜检查 由有5年以上操作经验的医师进行操作。观察各级支气管管腔是否通畅、是否有新生物等。根据情况进行常规刷检、活检和灌洗等。
1.5.2 超声内镜检查 经口通过声门进入气管,依据术前影像检查结果(胸部增强CT或PET/CT)初步定位目标淋巴结位置。将超声探头前水囊充盈后,打开二维灰阶模式,调整图像焦距及观测深度,使目标淋巴结及其周围部分正常组织能够完整显示于屏幕,适当调整超声内镜位置,确定目标淋巴结的最大层面,拍照留存。记录淋巴结大小、边界是否清晰、内部回声强弱和回声是否均匀等。
1.5.3 UE检查 切换为UE模式,待图像稳定后,冻结图像,拍照留存。观察目标淋巴结图像类型,测量该帧图像的应变率[正常组织(绿色最深)与最硬区域(蓝色最深)]比值并记录。见图1。
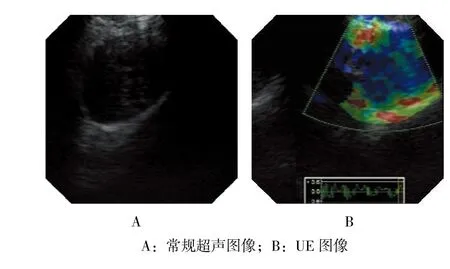
图1 常规超声及UE图像Fig.1 Images of B mode ultrasound and UE
1.5.4 EBUS-TBNA 切换为常规超声模式,调整超声内镜位置,确定目标淋巴结的安全进针路径。沿穿刺通道送入21号穿刺针,调节好鞘管位置,助手协助固定超声内镜,操作者适当调整进针深度,将穿刺针刺入淋巴结。退出穿刺针内芯,在穿刺针末端接上20 ml带有负压的Vaclok注射器,在超声实时指导下将穿刺针来回移动进行抽吸10~20次。每个靶淋巴结穿刺3次。结束后取出穿刺针获取病理标本,穿刺组织条置于福尔马林溶液中,穿刺液涂片后送病理科进行常规病理及细胞学检查。
1.6 术后分析
1.6.1 常规超声特点分析 ①大小:以淋巴结短径长度表示,单位为mm;②边界:分为边界清晰(与周围组织界限清楚)和不清晰;③回声强弱:目标淋巴结内部出现较周围组织减弱的回声,则为低回声;否则则为等回声或者稍高回声;④回声均匀程度:目标淋巴结内部回声均匀一致,则为回声均匀;反之则为回声不均。
1.6.2 弹性图像特点分析 对术中记录的数据、拍照留存的弹性图像进行处理,记录每例穿刺淋巴结的UE特点,指标如下:①图像类别:根据弹性成像图像颜色分布共分为3型[5]。1型主要是非蓝色(绿色和红色)图像,考虑良性;2型为部分蓝色,部分非蓝色(绿色和红色)图像,可能为良性,可能为恶性;3型主要是蓝色图像,考虑恶性;②弹性评分:对术中拍照留存的弹性成像图像进行评分,评分标准[6]如下:1分为切面≥80%区域为红色或绿色,2分为切面≥50%,但<80%区域为红色或绿色,3切面≥50%,但<80%区域为蓝色,4分为切面≥80%区域为蓝色。评分越高,恶性可能越大;③应变率比值:分析整理各个淋巴结术中测得的应变率比值;④蓝色区域占淋巴结区域的面积比例:通过Image J软件(版本号:1.6.0_24)计算每例病变弹性图像中蓝色区域像素点占整个病变区域像素点的比例。
1.7 诊断标准
确定EBUS-TBNA穿刺病理结果;若EBUSTBNA穿刺病理结果不能确定淋巴结的性质,以后续手术病理、经验性治疗和/或影像学随访至少3个月以确认淋巴结的良恶性。
1.8 统计学方法
使用SPSS 22.0统计软件进行统计分析。计量资料(正态分布)使用均数±标准差(±s)表示,采用独立样本t检验;非正态分布用中位数(最大值,最小值)表示,采用非参数检验;计数资料采用χ2检验,等级资料使用秩和检验。以P<0.05为差异有统计学意义。计算两种参数的诊断效能,获得敏感度、特异度、阳性预测值、阴性预测值以及准确率等指标,并构建受试者工作特征曲线(receiver operating characteristic curve,ROC)。
2 结果
2.1 病理结果
共穿刺了63例淋巴结,通过EBUS-TBNA诊断者共45例。其中,2R/L组淋巴结7例,4R/L组淋巴结28例,7组淋巴结26例,8组淋巴结2例。明确病理类型,恶性病变49例,其中肺癌44例,淋巴瘤2例,食管癌2例,肾癌转移1例;良性病变14例,其中淋巴结反应性增生8例,结节病3例,曲霉感染2例,结核1例。
2.2 常规超声特征对纵隔淋巴结的性质判定
2.2.1 常规超声特征在良恶性淋巴结中分布差异的分析 对纳入本次研究的63例淋巴结分析结果显示,良恶性淋巴结在边界清楚与否、回声强弱、内部回声均匀程度中差异均有统计学意义(P<0.05)。恶性淋巴结多见的超声特征为边界清楚、低回声及回声不均。见表1。
2.2.2 常规超声特征对良恶性淋巴结的诊断价值 以边界清楚与否、回声强弱、内部回声均匀程度判定淋巴结性质的特征,其诊断准确率、灵敏度、特异度、曲线下面积分别为:77.78%、81.63%、64.29%、0.73;69.84%、71.43%、64.29%、0.68;63.49%、61.22%、71.43%、0.66。3者中,边界清楚较其他两项超声特征在诊断恶性淋巴结中诊断效率高,见表2。通过构建ROC曲线来显示诊断价值,见图2。
2.3 UE参数对纵隔淋巴结的性质判定
2.3.1 弹性图像类型及弹性评分在良恶性淋巴结中分布差异分析 统计结果显示,弹性图像类型及弹性评分对良恶性淋巴结性质判定均有意义(P<0.05)。对于弹性图像类型,1型提示良性可能,3型提示恶性可能;而对于弹性评分,根据评分标准,若评分越高,则淋巴结恶性可能性越大。见表3。
2.3.2 弹性成像应变率比值及蓝色面积比例在良恶性淋巴结中分布差异分析 比较良恶性淋巴结组间应变率比值及蓝色面积比例的差异,统计结果显示,两种参数在两组间差异有统计学意义(P<0.05)。见表4。
2.3.3 超声弹性成像各参数对良恶性淋巴结诊断价值的分析 以各个弹性成像参数构建ROC曲线见图3,得到曲线下面积,统计显示各条曲线下面积均大于0.80,表明超声弹性参数对病变有诊断价值。根据统计结果计算各参数的Youden指数,以其最大时的截断点作为各个参数的最佳诊断界值。弹性图像类型以3型作为恶性诊断标准;弹性评分以3分作为恶性诊断界定值;应变率比值诊断的界定值为17;蓝色面积比例诊断的界定值则为0.63,以大于或等于上述界定值时将淋巴结性质诊断为恶性,小于界定值时诊断为良性,然后与金标准对比,分别计算各个参数诊断的准确率、敏感度、特异度、阳性预测值、阴性预测值,见表5。其中,以蓝色面积比例诊断效率最高。
2.4 常规超声和UE联合诊断对纵膈淋巴结性质判定的价值
根据上述统计结果,在常规超声特征中,边界(清楚)对恶性淋巴结诊断的价值最高;而在弹性成像参数中,弹性评分的准确率最高,蓝色面积比例的曲线下面积最大。将两者分别与边界(清楚)作为联合指标判断纵隔淋巴结性质,见图4,其准确率、灵敏度、特异度及曲线下面积分别为85.71%、81.63%、100.00%、0.95;92.06%、89.80%、100.00%、0.98。统计显示,联合诊断能提高诊断的准确率,并且以蓝色面积比例+边界(清楚)为联合诊断指标时,诊断效价更高。见表6。

表1 常规超声特征在良恶性淋巴结中的分布差异 例Table 1 The different distribution of B mode ultrasound in benign and malignant lymph nodes n
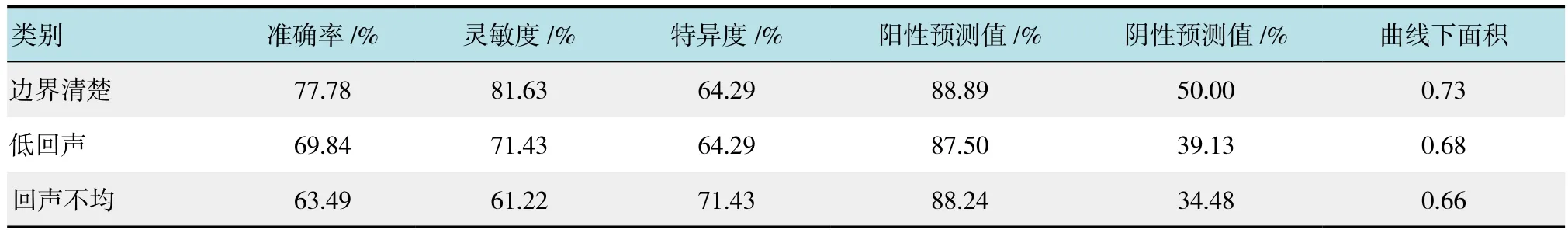
表2 常规超声特征对良恶性淋巴结的诊断价值Table 2 The value of B mode ultrasound in the diagnosis of benign and malignant lymph nodes

图2 常规超声特征判断淋巴结良恶性的ROC曲线Fig.2 Receiver operating characteristic curve for B mode ultrasound
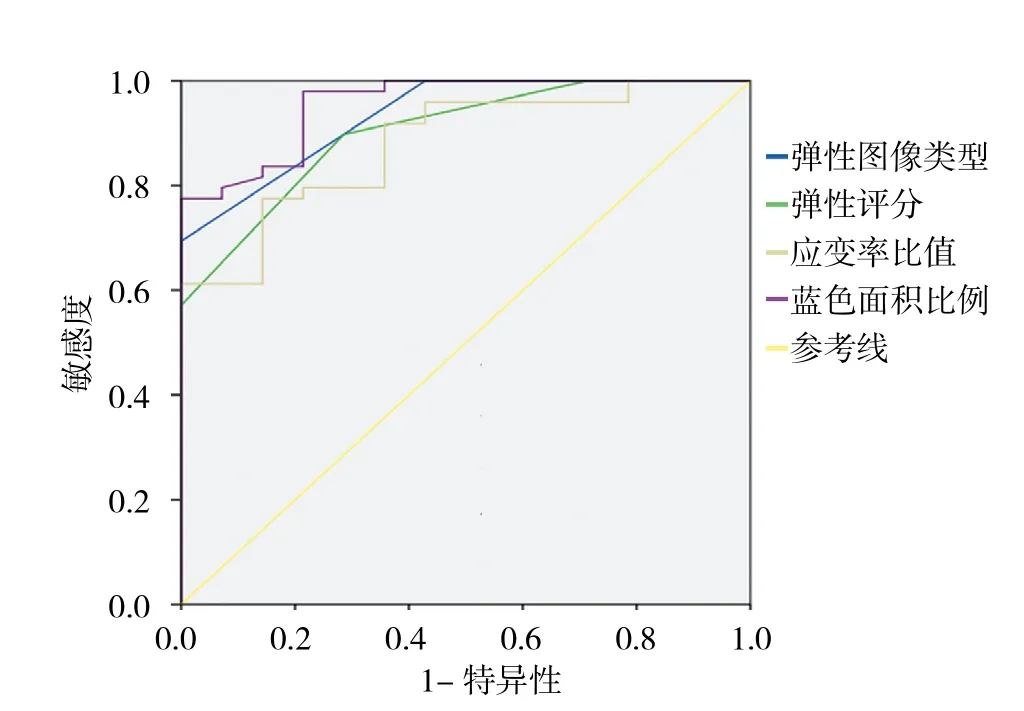
图3 UE各参数判断淋巴结良恶性的ROC曲线Fig.3 Receiver operating characteristic curve for UE

表3 良恶性淋巴结弹性图像类型和弹性评分差异 例Table 3 Different elastic image types and elasticity scores of benign and malignant lymph node n
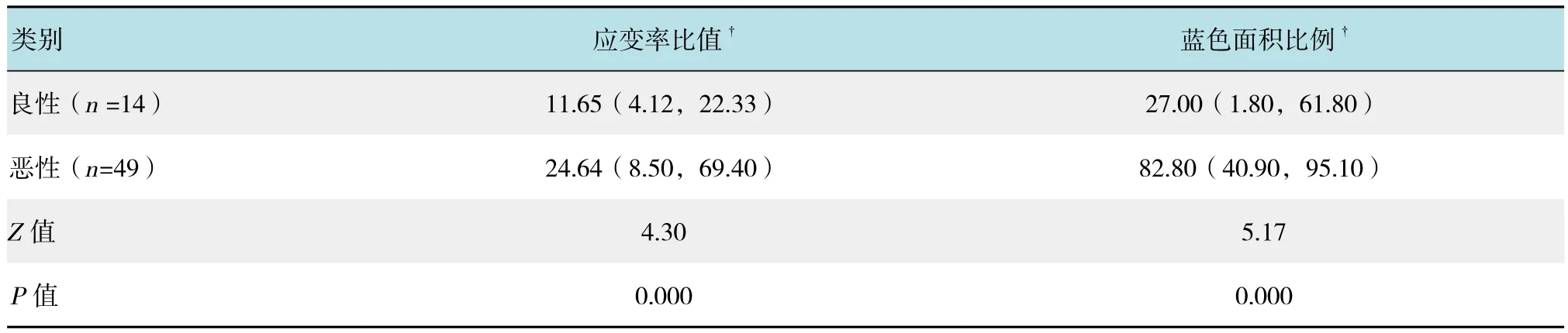
表4 良恶性淋巴结超声弹性应变率比值及蓝色面积比例的比较分析Table 4 A comparative of strain rate and blue area of UE in benign and malignant lymph nodes
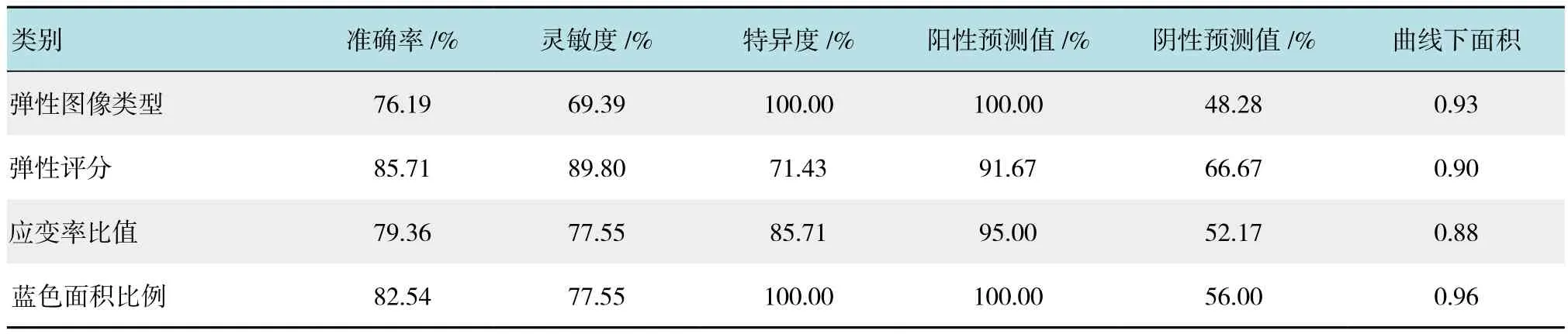
表5 UE各参数对良恶性淋巴结的诊断价值Table 5 Diagnostic value of UE Parameters for benign and malignant lymph nodes

表6 弹性评分、蓝色面积比值及其与边界(清楚)联合诊断时的诊断价值Table 6 Diagnostic value of joint diagnosis of elasticity score,blue area ratio,and clear boundary
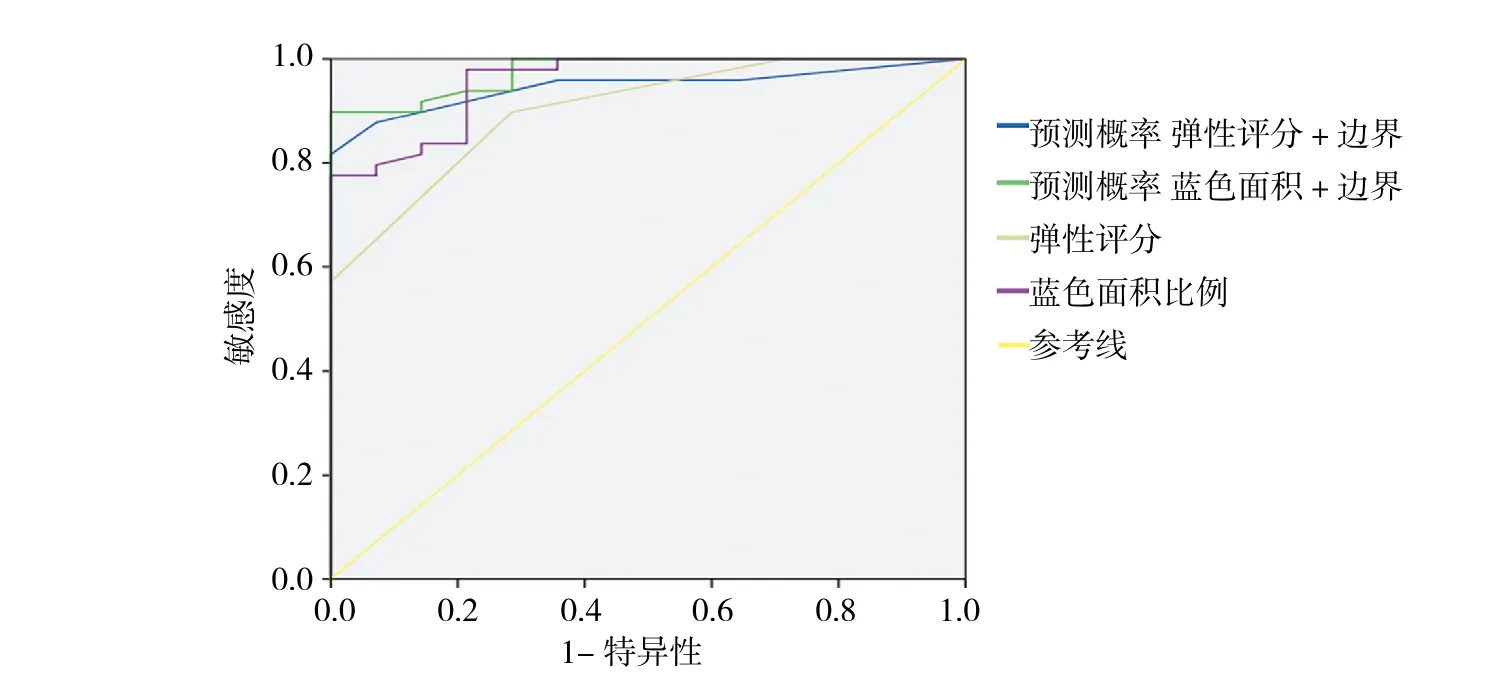
图4 常规超声及弹性成像联合判断淋巴结良恶性的ROC曲线Fig.4 Receiver operating characteristic curve for B mode ultrasound and UE
3 讨论
在肺癌诊断中,精准的分期决定患者后续治疗方法的选择及预后。EBUS-TBNA实现了在超声引导下进行支气管镜针吸活检,大大提高了纵隔淋巴结穿刺的准确率和阳性率。由于其在操作简便及安全性方面的明显优势,近年来EBUS-TBNA在淋巴结分期中的地位逐渐升高,并逐渐替代纵隔镜诊断的金标准地位。
常规超声有着实时、动态、无创和简便等优点,在进行EBUS-TBNA时,可以根据超声图像特征,初步判别淋巴结性质,从而选择性地进行穿刺,提高纵隔淋巴结穿刺的准确性及安全性。日本研究者FUJIWARA等[7]对1 061例纵隔淋巴超声声像进行回顾性特征分析,发现圆形、清晰的边界、内部回声不均和存在凝固性坏死等特征可作为诊断恶性淋巴结的独立预测因素。还有文献称,淋巴结短径尺寸也可作为判定淋巴结良恶性的因素,并以短径大小1 cm作为分界点,大于1 cm的淋巴结常提示恶性倾向[8]。但依据上述超声特征对淋巴结性质诊断的准确性有限。在本研究中,纵隔恶性淋巴结多见的超声特征为边界清晰、回声不均以及低回声,以上特征诊断良恶性纵隔淋巴结的准确率为63.49%~77.78%,反映诊断效能的ROC曲线下面积为0.66~0.73。一般情况下,认为AUC为0.5时,无明显诊断价值;在0.5~0.7之间时,诊断价值较低;在0.7~0.9之间时,有中等诊断价值;当大于0.9时诊断价值较高。由此可见,常规超声特征对纵隔淋巴结性质的诊断价值偏低。此外,在本研究中,淋巴结短径大小在良恶性纵隔淋巴结诊断中并无统计学意义,也可能与入选淋巴结中短径小于1 cm数目偏少相关,需要更大样本量的数据进行统计分析。
UE技术是近年来超声领域研究较多的一种新型超声成像技术。该技术通过探头压缩测量的组织,得到的组织内部应变反应分布,并以此为依据推算出其弹性系数分布。通常认为,组织弹性系数越大表示组织硬度越大。恶性组织因细胞增殖速度较快,组织硬度较大。这使得通过应用UE技术将恶性组织成分从正常组织中甄别出来成为可能。与常规超声以及传统的CT和MRI等相比,UE能更好地反应组织的生物学特性,对实性肿瘤良、恶性鉴别起着重要的作用。该技术在甲状腺、乳腺中的应用相对成熟,评价指标也多选用更加客观的定量指标[9-10]。目前分析UE的评价指标主要有:弹性图像类型、弹性评分、应变率比值及蓝色区域的面积比例。在本研究中,笔者将此4种目前常用的评价指标进行统计及分析,结果显示4种评价指标在良恶性淋巴结中均有显著差异,说明了UE技术在纵隔淋巴结性质判定中具有广泛的应用前景。
对于弹性图像类型,日本学者IZUMO等[5]在研究中将弹性图像分为3型,并将1型定义为良性淋巴结,3型定义为恶性淋巴结,共对75组纵隔淋巴结进行了评估,其诊断的准确率、灵敏度及特异度分别为96.70%、100.00%和92.30%。在本研究中,弹性图像类型对诊断纵隔淋巴结性质的准确率、灵敏度和特异度分别为76.19%、69.39%和100.00%,明显偏低。考虑出现这种结果的原因可能与图像分型标准较为主观,缺少确定的客观定量标准有关。
在弹性评分这个指标中,笔者将评分3分及以上的淋巴结定义为恶性,在这种情况下,诊断的准确率、灵敏度和特异度分别为85.71%、89.80%和71.43%,与国内学者何海燕等[4]的研究结果基本一致。值得注意的是,弹性图像类型及弹性评分法均是通过弹性成像图颜色分布特点进行分类及评分,受人为主观因素影响较大,不同观察者对同一幅超声弹性图可能给出不同的分类及评分。为尽量减少主观因素影响,在今后的研究中,弹性图像分型及弹性评分可由两名经正规培训后的内镜医生分别独立评判及记录图像结果,阅图结束后比较结果,结果不一致时由第三人协助判定,以减少人为主观因素对研究结果的干扰。
UE的应变率比值为正常组织与病变淋巴结区域应变率的比值,在一定程度上反映病变区域的硬度。本研究通过绘制ROC曲线,计算出其曲线下面积为0.88,且诊断的最佳界值取值17,其对应的准确率、灵敏度和特异度分别为79.36%、77.55%和85.71%。而其他研究团队在诊断界定值上得出的结果差异很大,国外学者ROZMAN等[11]得到的应变率比值诊断界值为8,其诊断的准确率、灵敏度和特异度分别为86.25%、88.24%和84.78%,而国内何海燕等[6]在其另一篇研究中确定的应变率比值的最佳诊断界值为32.07,准确率、灵敏度和特异度对应为85.30%、88.10%和80.80%。分析产生较大差异可能与操作者主观影响以及图像选取标准的不同相关。
从构建的ROC曲线上看,蓝色面积比例是弹性成像4个分析指标中诊断效价最高的指标,其曲线下面积为0.96,在0.63处取得最佳界定值,诊断的准确率、灵敏度、特异度分别为82.54%、77.55%和100.00%。虽然蓝色面积比例较其他3者诊断价值更高,但其灵敏度仅77.55%,明显低于其他文献报道[4,6,11]。笔者对其诊断结果进行了假阴性分析,结果显示,在确定为假阴性的11例淋巴结中,蓝色面积比例范围在40.90%~61.60%,对应的弹性图像类型均为2型,弹性评分中2分者有5例、3分者有6例。而最终病理显示,其中7例病理为恶性肿瘤伴大片坏死,还有2例为出血及大量红细胞中找到恶性肿瘤细胞。以上结果表明,当恶性淋巴结内部出现坏死或者出血时,其硬度会下降。相应的,弹性图像上蓝色面积比例下降,弹性评分降低,从而导致漏诊的产生。
在本研究中,笔者还将常规超声图像中的诊断价值最高的边界(清楚)分别与弹性评分、蓝色面积比值作为联合指标进行淋巴结性质的判定,通过绘制ROC的曲线,蓝色面积+边界(清楚)的曲线下面积最大,为0.98。其在最佳界值时对应的准确率、灵敏度和特异度分别为92.06%、89.80%和100.00%。但在实际的临床应用中,蓝色面积比例需要通过额外的软件分析获得,计算较为繁琐,不能在弹性成像操作过程中给出直观简明的倾向性判定。另外,从ROC曲线上分析,弹性评分+边界(清楚)联合诊断的诊断效价要高于UE单独指标,说明联合诊断是提高诊断效能的有效手段。
通过本研究综合的统计分析显示,UE各参数对纵隔淋巴结性质判定的价值高于常规超声特征,且两者综合应用能够提高良恶性淋巴结的鉴别准确率。在临床实践中,可以将UE技术和常规超声联合应用,确定恶性可能性大的重点穿刺淋巴结,并指导进行EBUS-TBNA操作,从而提高穿刺的准确性及安全性。另外,不同研究者得到的UE参数诊断界定值差别很大,这需要在今后进行更大样本的多中心研究,从而制定出标准的UE评价体系,以更大地发挥出UE的诊断价值。
参 考 文 献:
[1]SIEGEL R L, MILLER K D, JEMAL A. Cancer Statistics, 2016[J].CA Cancer J Clin, 2016, 67(1): 7-30.
[2]HOREWEG N, DE KONING H. The importance of screening for lung cancer[J]. Expert Rev Respir Med, 2014, 8(5): 597-614.
[3]HOWINGTON J A, BLUM M G, CHANG A C, et al. Treatment of stage I and II non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest,2013, 143(5 Suppl): e278S-e313S.
[4]何海艳, 吕学东, 马航, 等. 气道内超声弹性技术对肺癌患者肺门纵膈淋巴结转移的诊断价值[J]. 中南大学学报(医学版),2016, 41(1): 30-36.
[4]HE H Y, LÜ X D, MA H, et al. Value of endobronchial ultrasound elastography in the diagnosis of mediastinal and hilar lymph node metastasis in lung cancer[J]. Journal of Central South University(Medical Science), 2016, 41(1): 30-36. Chinese
[5]IZUMO T, SASADA S, CHAVEZ C, et al. Endobronchial ultrasound elastography in the diagnosis of mediastinal and hilar lymph nodes[J]. Jpn J Clin Oncol, 2014, 44(10): 956-962.
[6]HE H Y, HUANG M, ZHU J, et al. Endobronchial ultrasound elastography for diagnosing mediastinal and hilar lymph nodes[J].Chin Med J (Engl), 2015, 128(20): 2720-2725.
[7]FUJIWARA T, YASUFUKU K, NAKAJIMA T, et al. The utility of sonographic features during endobronchial ultrasound-guided transbronchial needle aspiration for lymph node staging in patients with lung cancer: a standard endobronchial ultrasound image classification system[J]. Chest, 2010, 138(3): 641-647.
[8]OZGUL M A, CETINKAYA E, KIRKIL G, et al. Lymph node characteristics of sarcoidosis with endobronchial ultrasound[J].Endosc Ultrasound, 2014, 3(4): 232-237.
[9]CHEN M, ZHANG K Q, XU Y F, et al. Shear wave elastography and contrast-enhanced ultrasonography in the diagnosis of thyroid malignant nodules[J]. Mol Clin Oncol, 2016, 5(6): 724-730.
[10]EVANS A, SIM Y T, THOMSON K, et al. Shear wave elastography of breast cancer: sensitivity according to histological type in a large cohort[J]. Breast, 2016, 26: 115-118.
[11]ROZMAN A, MALOVRH M M, ADAMIC K, et al. Endobronchial ultrasound elastography strain ratio for mediastinal lymph node diagnosis[J]. Radiol Oncol, 2015, 49(4): 334-340.

