FSHβ和ITGB1基因多态性与母猪繁殖性状的关联性分析
李梦寻 ,胡九英 ,谢苏 ,邱梅玉 ,鲁慧文 ,公红斌 ,来红霞 ,黄涛
(1石河子大学动物科技学院,新疆 石河子 832003;2新疆正大食品有限公司,新疆 五家渠 831301)
猪繁殖力是影响养猪企业生产效益的重要经济性状,但其遗传力低并受多种效应的影响,这使得利用常规育种对该性状进行遗传改良进展缓慢。因此,利用影响产仔性能的主效基因进行分子标记辅助育种是加快母猪繁殖性状遗传进展的有效途径。
FSHβ是母猪繁殖性状的主效基因,其β亚基使FSH具有生物活性并具有一定特异性,FSHβ由卵泡刺激素β亚基的基因编码。FSH能诱导雌性动物的卵泡发育,促进子宫内膜生长等,FSH还协同LH一起刺激性腺类固醇、雌二醇和孕酮的合成和分泌[1]。FSH在畜牧业生产中用于家畜的同期发情和超数排卵等[2]。有研究认为FSHβ基因可作为遗传学中有关繁殖性状研究的重要分子标记,基因中的1处逆转座子插入突变产生 AA、AB、BB三种基因型[3]。赵要风等[4]研究报道,FSHβ的 AA 基因型可显著提高产仔数。ITGB1是整合素家族成员,整合素β1在子宫内膜中表达水平的变化,可能会影响子宫内膜对胚泡的识别、粘附,导致子宫内膜容受性的降低,从而使胚胎着床失败[5]。目前对于ITGB1对繁殖性状的影响的研究报道较少,但可根据ITGB1对胚胎附植方面的影响,将ITGB1基因作为影响母猪繁殖性能的候选基因,其是否对母猪繁殖性状有影响还需要进行试验证实。
本研究检测了939头大白猪FSHβ和ITGB1基因多态性并分析其前三胎次单个基因基因型和合并基因型与猪繁殖性状之间的关系,以期为大白猪分子标记辅助选择提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
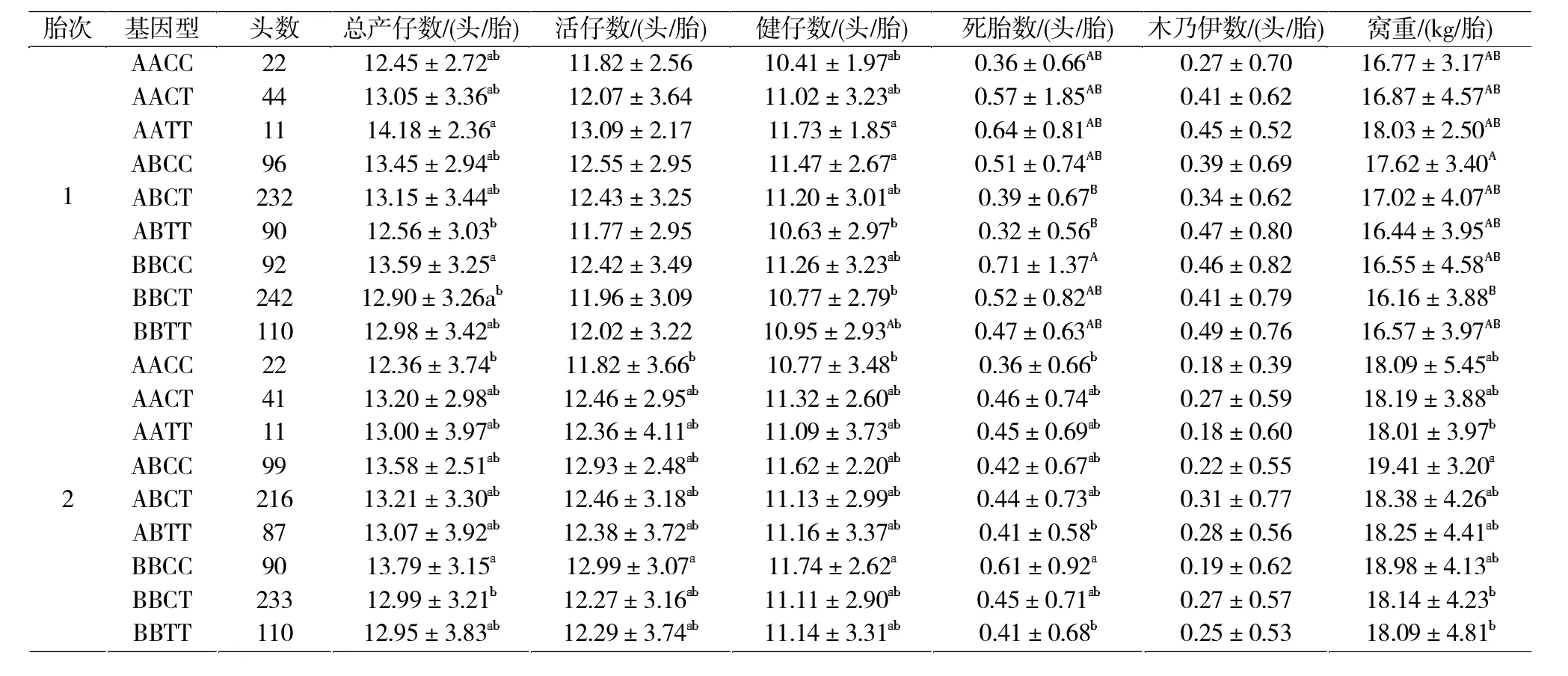
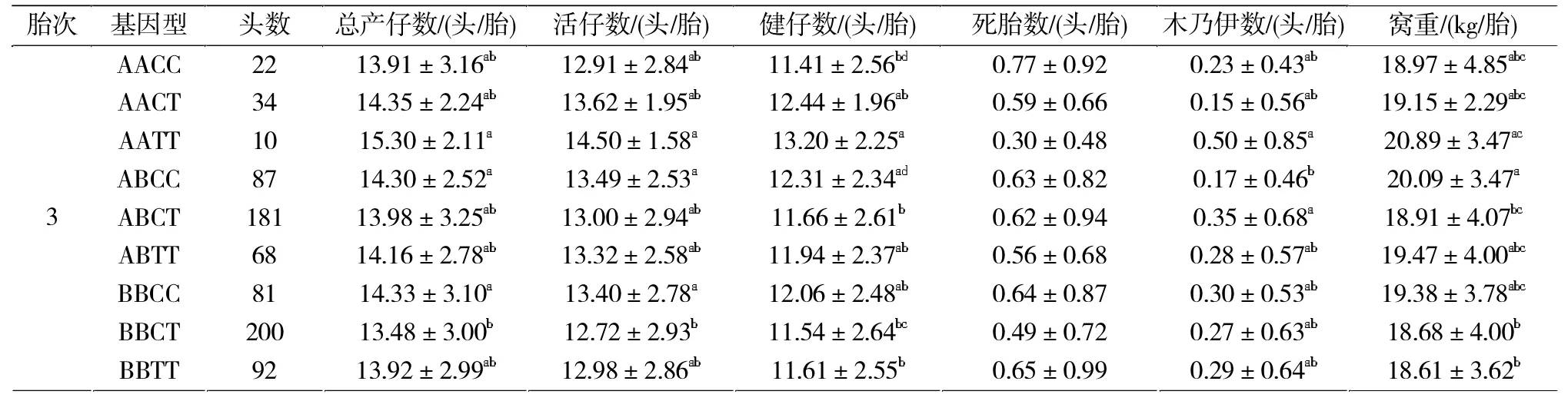
本试验所选用的939头大白母猪均来自新疆正大种猪场。采集耳组织样本,放入含1 mL 75%酒精的Eppendoff管内,放入冰盒带回实验室,-20℃保存,以备后面的样本组织DNA提取。此外搜集整理了样本群体经产头胎(939窝)、二胎(909窝)和三胎(775窝)的总仔数、活仔数、健仔数、窝重、死胎、木乃伊等繁殖性状相关资料。
1.1.2 试验试剂
2×EsTaqMasterMix购自 CWBIO 公司;Marker DL2000、血液/细胞/组织基因组DNA抽提试剂盒,购自TIANGEN公司;限制性内切酶RasI购自Takara公司。
1.2 方法
1.2.1 引物设计与合成
FSHβ和ITGB1基因PCR扩增引物参照和Knoll等[6]和刘超等[7]的引物序列,由上海生工生物工程技术服务有限公司合成,引物序列信息见表1。

表1 实验引物Tab.1 Primers in the study
1.2.2 猪耳组织DNA提取
用血液/细胞/组织基因组DNA抽提试剂盒对所采集母猪耳组织样进行基因组DNA提取并检测其浓度,-20℃保存备用。
1.2.3 PCR扩增与多态性检测
1.2.3.1 PCR扩增
PCR 反应体系 15 μL:2×Es Taq Master Mix 7.5 μL,上、下游引物各 0.4 μL,模板 DNA 0.5 μL,去离子水 6.2 μL。PCR 反应条件:94 ℃,4 min,35循环 (94 ℃,30 s;56 ℃/60 ℃,30 s;72 ℃,30 s),72℃延伸5min。所有基因PCR产物经琼脂糖凝胶检测后进行下一步反应。
1.2.3.2 基因型检测
FSHβ基因由片段插入造成,2.0%琼脂糖电泳检测 PCR产物即可见多态性。ITGB1基因酶切反应 :4 μL PCR 产 物 、0.4 μL RsaI、1.0 μL Buffer及双蒸水 4.6 μL,37 ℃条件下酶切 2.5 h;反应结束后取酶切产物10 μL用5.0%的琼脂糖凝胶电泳检测分型。
1.2.4 数据整理与统计分析
用Excel表格计算基因、基因型频率、多态信息含量(PIC)、有效等位基因数(Ne)、群体杂合度(H),并对基因型分布进行Hardy-Weinberg平衡检验,用SPSS17.0分析总产仔数、产活仔数、健仔数等繁殖性状在不同基因型之间的差异。
2 结果与分析
2.1 PCR扩增及酶切结果
FSHβ基因由片段插入造成,琼脂糖电泳检测PCR产物即可见多态性,PCR产物经2.0%的琼脂糖凝胶电泳检测,产生3种带型(图1):500 bp纯合子 (AA基因型),500、220 bp杂合子 (AB基因型),220 bp纯合子(BB基因型)。
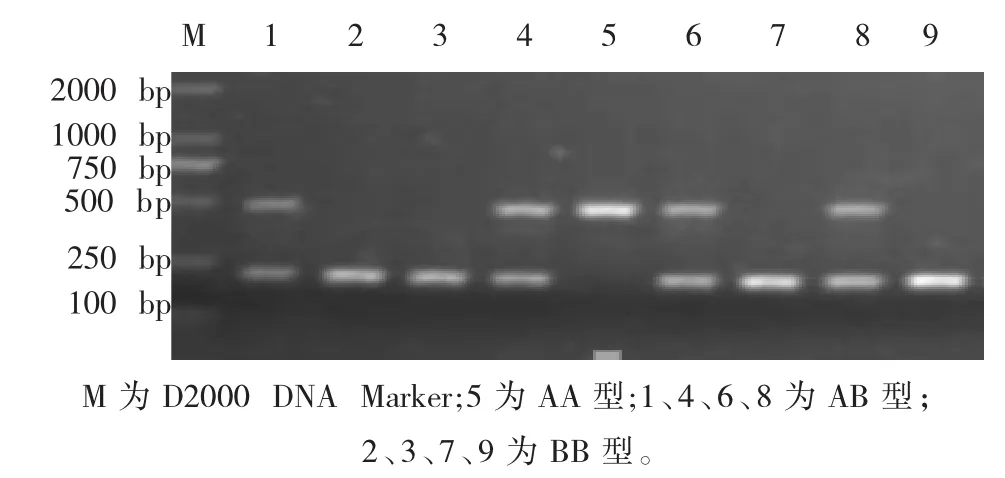
图1 FSHβ基因的酶切结果Fig.1 The results of enzyme digestion of FSH beta gene
ITGB1基因经限制性内切酶Rsa I酶切电泳检测到3种带型 (图2):22和114 bp的片段为CC基因型,22、114和136 bp为 CT基因型,136 bp的片段为TT基因型。由于22 bp片段较小,因此在图像中未有显示。
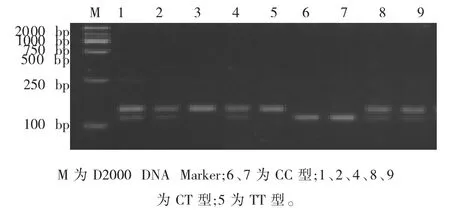
图2 ITGB1基因基因的酶切结果Fig.2 The results of enzyme digestion of ITGB1 gene
2.2 各基因型频率、基因频率及群体遗传特性
2.2.1 各基因型频率、基因频率
由表2可知,FSHβ基因型频率在大白猪上为BB>AB>AA,优势基因为B等位基因。ITGB1基因型频率在大白猪上为CT>CC>TT,优势基因为C基因。
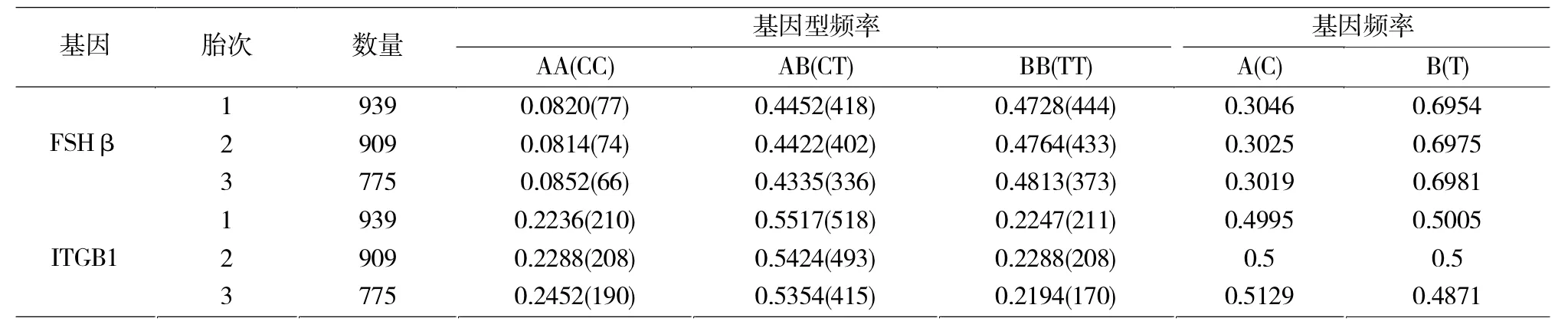
表2 FSHβ和ITGB1基因的基因型频率及等位基因频率Tab.2 The frequencies of genotype and allele of FSHβand ITGB1 genes
2.2.2 不同基因的群体遗传特性
由表3可知,FSHβ和ITGB1基因在试验群体中具有中度多态(0.25 表 3 基因PIC、H、Ne及 χ2检验Tab.3 Date ofPIC,H,Neand χ2test of FSHβ and ITGBI genes FSHβ基因在头胎的死胎数性状上AB基因型显著低于BB型0.15头/胎(P<0.05),而在窝重性状上AB基因型显著高于BB基因型0.69 kg/胎(P<0.05),其他胎次中不同基因型对繁殖性状的影响不显著(表4)。ITGB1基因在头胎的总仔、健仔和窝重性状上均为CC>CT>TT,但在死胎数上TT型显著低于CC型(P<0.05);在二胎的窝重性状上CC型显著高于CT和TT型,分别高0.88 kg/胎和0.97 kg/胎(P<0.05);在三胎健仔数和窝重性状中CC型均显著高于CT型 (P<0.05),由此可见CC基因型为ITGB1在繁殖性状上的优势基因型(表4)。 表4 FSHβ与ITGB1基因多态性与母猪繁殖性状的关联分析Tab.4 Correlation analysis of FSHβ and ITGB1 gen polymorphism and sow reproduction traits 2.3.2.1 FSHβ与ITG B1合并基因型与母猪繁殖性状的关联分析 由表5可见,在初产繁殖情况中,FSHβ 与ITGB1合并基因型中AATT在各繁殖性状中优于其他基因型,但其个体数量较少。在初产总产仔数性状上,BBCC型个体比 ABTT型高出 1.25头 /胎(P<0.05),在健仔数性状上ABCC显著高于ABTT和BBCT(P<0.05),在死胎性状上 ABCT、ABTT 极显著低于BBCC(P<0.01),在窝重性状上 ABCC显著高于BBCT 1.46 kg。二胎次中,在总产仔数性状上BBCC基因型显著高于BBCT基因型(0.80头/胎)和BBTT基因型(0.85头/胎),在总活仔数上BBCC基因型显著高于AACC型1.17头/胎(P<0.05),在健仔数上BBCC基因型显著高于AACC型0.97头/胎(P<0.05),但其死胎数多于其他基因型(P<0.05)。 表5 FSHβ和ITGB1合并基因型与大白猪繁殖性状的关联分析Tab.5 Correlation analysis of the combined genotypes of FSHβ and ITGB1 in Yorkshire reproduction traits 表5 续 由表5可见,三胎次中,在窝重性状中三胎次中ABCC显著高于BBCT与BBTT型,在总产仔数和总活仔性状中BBCC基因型显著高于BBCT型0.85头/胎(P<0.05)和0.68头/胎(P<0.05)。由此可见,在初产繁殖性状中的优势基因型AATT,BBCC次之;在经产二胎次和三胎次中,BBCC为优势基因型。因此,可以选留较少数的高产AATT型个体以及BBCC型个体分别进行纯繁,以提升大白母猪群体繁殖性能。 FSHβ是母猪繁殖性状的一个主效基因。研究表明B等位基因为优势基因,经产母猪各基因型之间产仔数差异不显著[8]。在赵要风等[3]的研究中,杜洛克、大约克、长白等国外猪种中BB型为FSHβ的优良基因型,AA型比较罕见,而Korwin-Kossakowska等[9]、Linville等[10]研究结果发现,FSHβ对产仔数的提高无显著影响。本研究所用经产大白猪群体,FSHβ基因型频率为AB>BB>AA,优势基因为B等位基因,在初产胎次中,死胎数性状上AB基因型显著低于BB型(P<0.05),而在窝重性状上AB基因型显著高于BB基因型(P<0.05),这与前人的研究有所不同。在经产胎次FSHβ的不同基因型对经产母猪不同繁殖性状的影响均不显著,这与前人[11-13]的结论一致。这表明单个基因FSHβ对经产母猪的繁殖性状的选择可能不具有显著意义。 目前对于ITGB1基因的研究大多集中在ITGB1基因对人卵巢癌细胞黏附和侵袭能力的影响研究较多[14]。郭良勇等[15-16]分别采用创造酶切位点技术和DNA池测序技术对ITGB1基因多态性进行检测,结果表明等位基因T的频率为0.55;ITGB1基因型效应显著影响(P<0.05)母猪产仔数性状,3种基因个体TNB和 NBA的总体趋势为 TT>TC>CC。翟腾蛟等[17]在269头大白猪中做了ITGB1基因的多态性分析发现各基因型对母猪产仔数、产活仔和健仔数影响的趋势也是 TT>TC>CC,而沈永巧等[18]在检测了685头母猪ITGB1的基因的多态性时分析发现各基因型对母猪总产仔数性状的影响趋势为TC>CC>TT。本研究中检测了大白猪头胎939窝,二胎次909窝,三胎次775窝,并分别作了基因型与产仔性状关联分析,结果ITGB1基因对产仔数影响的趋势CC>TT、CC>TC差异均达到显著水平(P<0.05),与其他人的研究结果均不一致。这种差异可能是由对母猪的饲养管理、胎次以及检测数量的不同而造成的。 FSHβ-ITGB1不同合并基因型在在大白猪的总产仔数、总活仔数、窝重、死胎性状上均存在不同的差异。本研究通过对较大群体的大白猪重进行分FSHβ-ITGB1合并基因型检测分析发现:在二胎次和三胎次中BBCC为最优分子标记组合,AATT次之,因此可通过提高 BBCC基因型频率来提高猪群的繁殖效益。这提示在种猪繁殖性状的选育过程中,应根据猪群特征有目的地选择2个或多个影响繁殖性能的候选基因进行合并,并结合分子标记辅助育种方法来进一步有效地改善母猪的繁殖性状。 [1]Phillips C L,Lin L W,Wu J C,et al.17 beta-estradiol and progesterone inhibit transcription of the genes encoding the subunits of ovine follicle-stimulating hormone[J].Mol Endocrinol,1988,2(7):641-649. [2]李俊,陈大芳,张勇,等.FSHβ基因对从江香猪母猪繁殖性能的影响[J].养猪,2017(3):73-77.Li J,Chen D F,Zhang Y,et al.The effect on reproductive performance for FSHβ gene in Congjiang Sow Pigs[J].Swine Production,2017(3):73-77. [3]Zhang D J,Liu D,Yang G W.Polymorphism of FSHβ subunitgene in six pig breeds[J].Journal of Northeast Agricultural University(English Edition),2010,17(1):62-64. [4]赵要风,李宁,肖璐,等.猪FSHβ亚基基因结构区逆转座子插入突变及其与猪产仔数关系的研究 [J].中国科学:C辑,1999,29(1):81-86.Zhao Y F,Li N,Xiao L,et al.Retrotrarsposon mutation of pig FSHβ subunit gene and its relationship with piglet litter size[J].Science in China:Series C,1999,29(1):81-86. [5]Ru P P R,Hernandez A,Mallard B A,et al.Association ofbovine leukocyte antigen (BoLA)DRB3.2 with immune response,mastitis,and production and type traits in Canadian Holsteins[J].Dairy Sci,2007,90(2):1029-1038. [6]Knoll A,Stratil A.Length polymorphism in an intron of the porcine osteopontin(spp1)gene is caused by the presence or absence of a sine(pre-1)element[J].Animal Genetics,1999,30(6):462-478. [7]刘超,沈君叶,朱士恩,等.FSHβ、ESR、BF基因对大白猪繁殖性状的遗传效应分析[J].中国畜牧杂志,2013(17):6-11.Liu C,Shen J Y,Zhu S E,et al.Genetic effects of FSHβ,ESR and BF genes on reproductive traits in large white pigs[J].Chinese Journal of Animal Science,2013(17):6-11. [8]王立辛,苏玉虹,高继红.猪 ESR、FSH-β和 PRLR基因合并基因型对产仔数的影响[J].中国农学通报,2011,29(7):18-22.Wang L X,u Y H,ao J H,et al.Effects of combinedgenotype of ESR,FSH-β and PRLR on litter size in pigs[J].Chinese Agricultural Science Bulletin,2011,29(7):18-22. [9]Korwin-Kossakowska A,Kamyczek M,Cielak D,et al.Theeffect of the polymorphism of leptin(LEP),leptin receptor(LEPR)and osteopontin genes on selected reproductiontraits of synthetic line 990 sows[J].Anim Sci Papers and Reports,2002,20:159-168. [10]Linville R C,Pomp D,Johnson R K,et al.Candidate gene anal-ysis for loci affecting litter size and ovulation rate in swine[J].Journal of Animal Science,2001,79(1):60-67. [11]方宇瑜.苏淮猪群体ESR1和FSHβ基因多态性及其与繁殖性状的关联性研究[J].畜牧与兽医,2017,49(2):1-5.Fang Y Y.Polymorphism analysis of genes ESR1 and FSHβ in Suhuai pigs and correlation analysis with reproductive traits[J].Animal Husbandry&Veterinary Medicine,2017,9(2):1-5. [12]Chen K,Ning L.The cambined genetypes effect of ESR and FSHβ genes on litter size traits in five different pig breeds[J].China Sci Bull,2001,46(12):140-143. [13]刘卫东,吴常信.中国地方品种淮猪 FSHβ亚基、ESR1和 HAL基因的多态性及其产仔效应分析[J].中国畜牧杂志,2006,42(15):4-7.Liu W D,Wu C X.Polymorphisms of FSHβsubbcnit,ESR1 and HAL genes and their litter effects in Huai pigs of China[J].Chinese Journal of Animal Science,2006,42(15):4-7 [14]Hu Z,Gao S,Gao J,et al.Elevated levels of lewis Y and integrinα5β1 correlate with chemotherapeutic drug resistance inepithelial ovarian carcinoma[J].Int J Mol Sci,2012,13(12):15588-15600. [15]郭良勇.猪ITGB1基因多态性与产仔数的关联性分析[J].中国畜牧杂志,2012,21(8):22-25+60.Guo L Y.Correlation analysisof porcine ITGB1 gene polymorphisms and litter size[J].Chinese Journal of Animal Science,2012,21(8):22-25,60. [16]郭良勇.猪整合素β1基因CRS-PCR多态性与产仔数的关联性分析[J].遗传,2012,4(7):88-95.Guo L Y.Analysis of associationbetween CRS-PCR polymorphisms of integrin β1 geneand litter size in pigs[J].Hereditas,2012,4(7):88-95. [17]翟腾蛟.猪RBP4和ITGB1基因多态性对母猪繁殖性能的影响[J].中国兽医学报,2016,36(11):1959-1963.Zhai T J.Influence of RBP4 and ITGB1 polymorphisms on reproductive traits of sow[J].Chin J Vet Sci,2016,36(11):1959-1963. [18]沈永巧,胡九英,孙敬礼,等.PRLR和ITGB1基因多态性对大白猪繁殖性能的影响[J].石河子大学学报(自然科学版),2017,35(2):146-151.Shen Y Q,Hu J Y,Sun J L,et al.The influence of polymor phisims of PRLR and ITGB1 geneson reproduction traits of Yor kshire sows[J].Journal of Shihezi University(Natural Science),2017,35(2):146-151.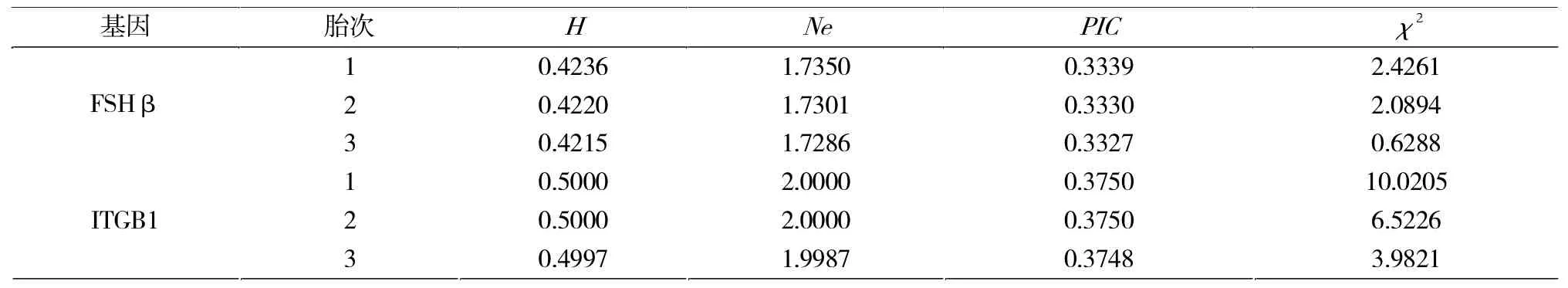
2.3 基因多态性与猪繁殖性状的关联分析
2.3.1 单个基因多态性与猪繁殖性状的关联分析

2.3.2 合并基因型与猪繁殖性状的关联分析
3 讨论

