紫花苜蓿细胞质雄性不育恢复基因的初步定位
张世超,王英哲,金 艳,陈晶晶,王 莹,徐 博
(1.吉林农业大学动物科学技术学院,吉林 长春 130118; 2.吉林省农业科学院,吉林 长春 130124)
紫花苜蓿(Medicagosativa)杂种优势较强。在生产中,为了使这一优势得到广泛的利用,授粉的控制体系尤为重要,保证它的稳定性和高效性十分必要,雄性不育(male sterility)是最具有代表性的途径之一[1]。其中的细胞质雄性不育(cytoplasmic male sterility,CMS)更易于找到保持系从而实现“三系”配套,应用前景十分广阔[2-3]。2000年以来,如何综合利用转基因和分子标记等遗传技术对苜蓿CMS进行研究[4]成为热点。如,Barcaccia等[5]利用RAPD技术,对减数分裂过程中苜蓿的突变体进行标记,找到了许多具有特异性标记的突变体,并通过这些特异性标记对突变体中的2n配子形成机制进行了新的研究,并用QTL技术将二倍体苜蓿群体的大花粉基因(jumbo pollen,jp)定位于6号染色体上,推测出形成多核小孢子的基因在6号连锁群上。Rosellini等[6]成功将雄性不育基因Bamase转入苜蓿,发现影响花粉正常发育的原因主要是胼胝质酶的合成与分泌,因此可通过改变胼胝质酶的含量也能得到雄性不育植株。
由于杂交种的生产涉及一些商业秘密,针对紫花苜蓿细胞质雄性不育的理论研究较少,多集中在细胞核[7],对选育紫花苜蓿的新杂交品种推动不大。而2008年通过卫星搭载公农1、2、3号紫花苜蓿后代,新发现紫花苜蓿雄性不育材料(MS-GN)[8],其特性表现为无花粉或花粉败育[9]。在不育系(MS-GN)的基础上,进一步杂交育种,成功获得4份紫花苜蓿雄性不育系材料,其不育特性近100%且十分稳定[8]。再将已获得的材料不断运用回交、测交的方式,终于选育出3份不育率超高的保持系材料(后代不育率高于95%)[8],这3份材料对细胞质雄性不育特性有稳定的高维持性,对今后雄性不育方向的理论研究和应用价值起到了至关重要的作用。但在紫花苜蓿细胞质不育遗传基础、遗传模式和不育机理上需要进一步研究,尤其在优良恢复系筛选等方面也需要进一步探索。
本研究对不育系MS-GN-1A的不育特征进行分析,利用SSR分子标记法,以不育恢复基因所在的引物类群为基础,完成初步定位,以期对未来紫花苜蓿雄性不育系的研究提供一点参考和理论依据。
1 材料与方法
1.1 材料
以吉林省农业科学院于洪柱等[8]选育的紫花苜蓿不育系MS-GN-1A为母本,恢复系MS178为父本配置杂交组合产生F1代(144株),在 2014年获得杂交F1代种子,2015年将F1代种子种植于大田中。使用人工方式强迫自交获得F2代种子,2016年种植于大田中,得到F2代分离群体(221株)。
1.2 方法
1.2.1花粉育性鉴定 在紫花苜蓿开花盛花期,取父母本、F1和F2代群体单株未开放的小穗于冰盒中,带回实验室。采用花粉染色I2-KI染色法进行染色,于显微镜下观察花粉育性情况[10-11]。育性观察统计并计数以后,并取父母本、F1和F2代群体的单株的叶片提取 DNA 用于连锁分析[12]。
1.2.2叶片DNA的提取和PCR反应 根据试剂盒说明进行叶片DNA的提取,将提取后的DNA置于在-20 ℃储存备用。PCR扩增产物用 30%变性聚丙烯酰胺凝胶电泳后,进行核酸燃料染色后观察统计并拍照。
1.2.3多态性标记的筛选 参照F2育性观察结果分析,结合田间植株表现[13],将所有植株划分为可育和不育两组,并构建可育和不育DNA混池,混池DNA从可育和不育植株组DNA中各随机抽取20个样品。
通过已发表的紫花苜蓿遗传图谱中公布的SSR引物 (共8条连锁群296个SSR引物)[14],随机选取160条作为初步筛选的引物。通常在 SSR-PCR 反应完成后,PCR 产物会先经过琼脂糖凝胶电泳检测其质量,并进行多态性条带鉴定,而后再进行聚丙烯胺凝胶电泳。观察基因池之间的扩增条带是否存在多态性。
初次验证筛选引物后发现含有多态性位点的染色体连锁群,找到这一条染色体上的所有引物序列。以上引物均根据文献中提供的引物序列[14],由上海生工生物技术公司合成引物。
1.2.4电泳条带统计与重组率计算 在显微镜下观察 F2群体单株是否可育,并结合田间形态观察的结果,确定F2单株所表现的基因型。将可育单株的基因型标记为“A”,不育单株的基因型标记为“B”。同时利用具有特异性的SSR引物对F2单株基因组进行扩增,对扩增产物进行聚丙烯酰胺凝胶电泳,并进行核酸染料染色,对得出的结果进行统计分析。如果扩增出的群体单株目的基因条带与不育基因池相同,那么将此条带标记为“B”,若与可育基因池条带相同,则标记为“A”,如果条带与不育和可育基因池均不相同(杂合型),则标记为“H”。统计条带后做成Excel表格,再通过遗传作图软件Joinmap 4.0构建遗传图谱,将3.0作为 LOD 最小值,最大遗传距离为 50 cM。
2 结果与分析
2.1 花粉育性判定
淀粉与I2-KI溶液反应,在显微镜下呈现为深蓝色。可育的花粉粒可以合成淀粉,显微镜下可以看到深蓝色的花粉颗粒细胞,反之不育株的花粉不能被染色,呈现为黄色或浅褐色。有些植株在盛花期的花药中,并没有花粉颗粒的存在,所以也就不能被I2-KI染成深蓝色。这说明在植株生长发育至开花期,一部分植株的花粉粒没有正常合成,导致花药在发育过程中就发生不正常的改变,最终形成不育植株[15]。
于盛花期对大田种植的221株F2代群体单株花粉颗粒染色后,显微镜下观察统计出,不育的F2代株数为57,可育F2代株数164,并没有观察到半不育植株。
2.2 紫花苜蓿细胞质雄性不育恢复基因的SSR标记
2.2.1SSR引物的筛选 首先对随机挑选的160对引物(从296对引物中随机选出)进行PCR扩增反应,结果发现,所有引物都能扩增出多条条带,但其中具有特异性的扩增产物有2对。分别是Mt2c12和AW166。图1为 Mt2c12和AW166 的所在位置,即部分引物的筛选结果,6号引物Mt2c12和7号引物AW166其扩增产物具有特异的多态性。
根据文献[14]中的引物,将有多态性条带的引物在文章中找到相应的类群Composite5,将该类群上所有引物进行合成,现已完成该类群的引物筛选,结果在两个基因池间发现了5个具有多态性的 SSR 引物,分别为Mt2c12、AW166、BI68、AW776153和BG267。图2为BI68和BG267所在组中部分引物筛选结果。
2.2.2恢复基因定位 把Mt2c12、BI68、AW776153和BG267分别作为扩增引物,发现相对应的分别有21、16、32和28株扩增条带与其对应的基因池不同(即为交换),其他个体的 DNA 扩增条带均与其对应基因池相对应(图3为BG267的部分电泳条带)。将所有数据统计分析输入软件后,结果如图4所示,与恢复基因连锁的SSR引物 BI68、Mt2c12、BG267和AW776153,它们的遗传距离分别为 19.0、20.9、44.6和72.1 cM。并且与恢复基因连锁最为紧密的是引物BI68。

图1 部分引物初步筛选结果Fig. 1 Initial screening results of partly screened SSR primers
M,100 bp ladder.图2,图3同。Marker in Figure 2 and Figure 3 is the same as Figure 1.
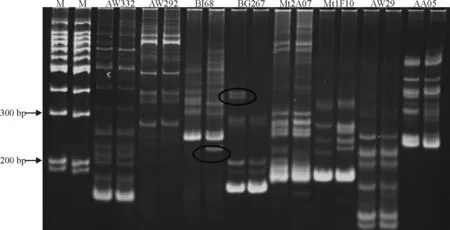
图2 部分引物筛选结果Fig. 2 Screening results of partly screened SSR primers
在筛选引物过程中,择优选取,挑选与恢复基因Rf较近的引物,所以,在最后遗传作图的时候,隐去了AW166这个引物。
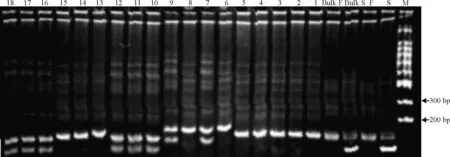
图3 SSR引物BG267在基因池和F2可育株的扩增结果Fig. 3 Results of PCR amplification of BG267 marker gene pools and F2 fertile individuals
1-18:植株个体编号;Bulk S:不育基因池;Bulk F:可育基因池;S:父本 F:母本。
1-18: Plant individual number; Bulk S: Sterility gene pool; Bulk F: Fertile gene pool; S: Male parent; F: Female parent.

图4 紫花苜蓿细胞质雄性不育恢复基因Rf的遗传连锁图Fig. 4 Composite genetic linkage map of 5 primers of cytoplasmic male sterile restorer gene in alfalfa
3 讨论与结论
本研究使用紫花苜蓿不育系MS-GN-1A为母本,恢复系MS178为父本做组合构建BSA分离群体,所获得的F1代均表现为雄性可育,在大田种植了221株F2代群体单株,盛花期将花粉颗粒染色后,显微镜下观察统计出,不育的F2代株数为57,可育F2代株数164,并没有观察到半不育植株。本研究通过筛选紫花苜蓿细胞质雄性不育恢复基因紧密连锁的SSR分子标记,进行染色体定位和不育恢复基因的定位分析,首先找到2条引物Mt2c12、AW166具有多态性条带,找到相应的染色体,将所有引物进行合成、筛选、定位后发现,与恢复基因连锁的SSR引物BI68、Mt2c12、BG267和AW776153,遗传距离分别为19.0、20.9、44.6和72.1 cM。其中BI68与恢复基因连锁最为紧,将恢复基因定位于Composite5连锁群上。细胞质雄性恢复基因的定位是紫花苜蓿杂种优势利用的基础[16]。随着分子标记越来越迅速的发展及其被更加广泛的应用,许多主要农作物用于分子标记的指纹图谱被系统化、全面化[17],这也是分子标记定位到目前为止,在各种农作物的育性基因定位的试验中,科学研究者首选方法的原因[18]。目前,越来越多物种的微卫星标记图谱密度的增加和技术都得到了很好的发展[19],微卫星标记技术将在基因定位中发挥更大的作用[20]。因此本研究采用SSR标记和BSA法来定位紫花苜蓿恢复系MS178的恢复基因。虽然19.0所cM是一个较远的标记,但是为进一步精细定位提供了基础。
参考文献References:
[1] 刘忠松,官春云,陈社员.植物雄性不育机理的研究及应用.北京:中国农业出版社,2001.
Liu Z S,Guan C Y,Chen S Y.Research and Application of Plant Male Sterility Mechanism.Beijing:China Agriculture Press,2001.(in Chinese)
[2] Gyulanasyrov G,Gyulanasyrova Z.Heterosis breeding in lucerne-problems and prospects.Plant Science,2005,42(2):111-117.
[3] 朱元娣,李光晨,李春雨,董利民,王涛.苹果柱型基因的ISSR分子标记研究.园艺学报,2003,30(5):505-510.
Zhu Y D,Li G C,Li C Y,Dong L M,Wang T.Studies on the ISSR marker analyses of the columnar gene in apple.Acta Horticulturae Sinica,2003,30(5):505-510.(in Chinese)
[4] 陈沁滨,侯喜林,陈晓峰,张静宜,薛萍.洋葱细胞质雄性不育基因RAPD及SCAR分子标记研究.南京农业大学学报,2007,30(4):16-19.
Chen Q B,Hou X L,Chen X F,Zhang J Y,Xue P.Identification of RAPD and SCAR markers linked to the cytoplasmic male sterility of onion line.Journal of Nanjing Agricultural University,2007,30(4):16-19.(in Chinese)
[5] Barcaccia G,Tavoletti S,Mariani A.Occurrence,inheritance and use of reproductive mutants in alfalfa improvement.Euphytica,2003,133(1):37-56.
[6] Rosellini D,Pezzotti M,Veronesi F.Characterization of transgenic male sterility in alfalfa.Euphytica,2001,118(3):313-319.
[7] Capomaccio S,Barone P,Reale L.Isolation of genes from female sterile flowers inMedicagosativa.Plant Reproduction,2009,22(2):97-107.
[8] 于洪柱,王志锋,金春花,徐安凯.苜蓿雄性不育材料的新成员:MS-GN.中国草学会牧草育种委员会第七届代表大会论文集.北京:中国草学会,2009.
Yu H Z,Wang Z F,Jin C H,Xu A K.The new members of the alfalfa male sterile materials:MS-GN.//The Chinese Society of Grass Forage Breeding Committee of Congress,Beijing:Chinese Glassland Society,2009.(in Chinese)
[9] 于洪柱,徐安凯,栾博宇,任伟,王志锋.紫花苜蓿雄性不育系的研究.黑龙江畜牧兽医,2013(17):81-82.
Yu H Z,Xu A K,Luan B Y,Ren W,Wang Z F.The research of alfalfa male sterile lines.Heilongjiang Animal Husbandry and Veterinary,2013(17):81-82.(in Chinese)
[10] 任良真.大豆细胞质雄性不育恢复基因的SSR标记.长春:吉林大学硕士学位论文,2012.
Ren L Z.SSR makers of cytoplasmic male sterile restorer gene in soybean.Master Thesis.Changchun:Jilin Agricutural University,2012.(in Chinese)
[11] 连世超,雷梦林,张瑞军,白志元,张海平,卫保国.大豆细胞质雄性不育恢复基因的标记定位.山西农业科学,2016,44(5):579-582.
Lian S C,Lei M L,Zhang R J,Bai Z Y,Zhang H P,Wei B G.Marker location for cytoplasmic male sterile restorer gene in soybean.Journal of Shanxi Agricultural Sciences,2016,44(5):579-582.(in Chinese)
[12] Alavi M,Ahmadikhah A,Kamkar B,Kalateh M.Mapping Rf3 locus in rice by SSR and CAPS markers.International Journal of Genetics & Molecular Biology,2009,1(7):121-126.
[13] 赵丽梅,孙寰,黄梅,王曙明,王跃强.大豆结实率与花粉败育率之间的关系.大豆科学,2004,23(4):249-252.
Zhao L M,Sun H,Huang M,Wang S M,Wang Y Q.The relationship between seed setting rate and pollen sterility rate of soybean.Soybean Science,2004,23(4):249-252.(in Chinese)
[14] Sledge M K,Ray I M,Jiang G.An expressed sequence tag SSR map of tetraploid alfalfa (MedicagosativaL.).Theoretical and Applied Genetics,2005,111(5):980-992.
[15] 刘伟华,罗红兵,邱博.玉米CMS-C型雄性不育系C543恢复基因的初定位.湖南农业大学学报(自然科学版),2016,42(1):16-19.
Liu W H,Luo H B,Qiu B.Primary mapping of restoring gene for CMS-C cytoplasmicmale sterility line C543 in maize.Journal of Hunan Agricultural University (Natural Sciences),2016,42(1):16-19.(in Chinese)
[16] Christine D.Chase.Cytoplasmic male sterility:A window to the world of plant mitochondrial nuclear interactions.Trends in Genetics,2007,23(2):81-90.
[17] Song L Q,Fu T D,Tu J X,Ma C Z,Yang G S.Molecular validation of multiple allele inheritance for dominant genic male sterility gene inBrassicanapusL.Theoretical Applied Genetices,2006,113:55-62.
[18] Edwin B,David A,John I.The hybridization barrier between herbaceousMedicagosativaand woodyM.arboreais weakened by selection of seed parents.Plants,2013,2:343-353.
[19] Zhou W,Kolb F L,Domier L L,Wang S.SSR markers associated with fertility restoration genes againstTriticumtimopheevii,cytoplasm inTriticumaestivum.Euphytica,2005,141(1-2):33-40.
[20] Daniel I O,Adetumbi J A,Oyelakin O O,Olakojo S A,Ajala M.Application of SSR markers for genetic purity analysis of parental inbred lines and some commercial hybrid maize (ZeamaysL.).Australian Journal of Experimental Agriculture,2012,2(4):597-606.

