慢性乙型肝炎患者恩替卡韦治疗前后血清共刺激分子水平变化及临床意义
罗光成,易婷婷,刘素兰,蒋兴亮,郭晓兰,张国元
(1川北医学院附属医院,四川南充637000;2川北医学院;3川北医学院转化医学研究中心)
我国乙肝病毒(HBV)感染者约9 300万,其中慢性乙型肝炎(CHB)患者约2 000万[1]。我国肝硬化和肝细胞肝癌(HCC)患者中,由HBV感染引起的比例分别为60%和80%[2]。CHB的发病机制主要是机体的HBV特异性免疫功能紊乱导致病毒不能有效清除,其中HBV特异性T细胞是病毒清除和疾病转归的关键因素。共刺激分子是T细胞活化的必要分子,可为T细胞活化提供协同刺激信号,白细胞分化抗原28(CD28)、细胞毒性T淋巴细胞相关抗原4(CTLA4)和淋巴细胞活化基因3蛋白(LAG3)是调节T细胞免疫功能的重要共刺激分子。研究[3,4]表明,共刺激分子在HBV特异性T细胞的产生、数量维持和功能发挥方面起着重要作用,在CHB患者T细胞上共刺激分子表达异常,且与疾病进程相关。既往研究[5,6]发现,恩替卡韦对CHB患者HBV特异性细胞免疫功能有明显的影响。然而,关于恩替卡韦治疗对CHB患者血清共刺激分子水平的影响,以及在治疗过程中的动态变化和临床意义,目前国内外鲜有报道。因此,本研究将探讨血清共刺激分子CD28、CTLA4和LAG3在CHB患者恩替卡韦治疗前后的水平变化及其意义。
1 资料与方法
1.1 临床资料 收集2015年10月~2017年4月在川北医学院附属医院感染科就诊的CHB患者31例(CHB组),其中男18例、女13例,年龄(33.5±12.8)岁;符合2010年版《慢性乙型肝炎防治指南》中CHB的诊断标准,HBeAg均阳性;入组前未接受抗病毒治疗,入组后参照2010年版《慢性乙型肝炎防治指南》给予核苷类似物抗病毒治疗,随访均截至2017年4月。对照组23例为川北医学院附属医院体检中心体检健康者,均为HBsAg阴性,年龄和性别与CHB组匹配。两组均排除其他嗜肝病毒重叠感染和人类免疫缺陷病毒感染,排除自身免疫性、酒精性、药物性、脂肪性等其他因素引起的肝损害,既往或近期未使用免疫抑制剂。
1.2 治疗方法 参照2010年版《慢性乙型肝炎防治指南》给予恩替卡韦0.5 mg,每日1次口服。在达到HBV DNA低于检测下限、ALT复常、HBeAg血清学转换后,再巩固至少1年(经过至少2次复查,每次间隔6个月)仍保持不变、且总疗程至少已达2年,可考虑停药,但延长疗程可减少复发[1]。
1.3 血清CD28、CTLA4和LAG3检测方法 取对照组和CHB组治疗前及治疗后4、12、24、48周外周静脉血,采用ELISA法检测血清CD28、CTLA4和LAG3,操作步骤均严格按照试剂盒说明书进行。CD28 ELISA试剂盒购自美国MyBioSource公司,CTLA4和LAG3 ELISA试剂盒购自美国CLOUD-CLONE公司。
1.4 抗病毒疗效判断方法 取对照组和CHB组治疗前及治疗后4、12、24、48周外周静脉血,采用乙肝病毒核酸定量检测试剂盒(上海科华生物工程公司)和美国ABI-7300荧光PCR仪检测HBV-DNA,其检测下限为5.0E+02 IU/mL,低于该值为病毒学应答(VR);采用美国雅培ARCHITECT i2000全自动电化学发光仪及配套试剂检测乙肝标志物(HBV-M)五项,记录HBeAg转阴情况。
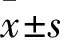
2 结果
2.1 两组血清CD28、CTLA4和LAG3水平比较 截至2017年4月,CHB组随访到24周时仍31例、48周时仅10例。CHB组治疗前血清CD28、CTLA4和LAG3水平均低于对照组(P均<0.05),治疗48周血清CD28、CTLA4和LAG3水平均高于治疗前(P均<0.05),血清CD28和CTLA4水平与对照组比较差异无统计学意义(P均>0.05),但血清LAG3水平低于对照组(P<0.05)。
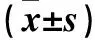
表1 两组血清CD28、CTLA4和LAG3水平比较
注:与对照组比较,*P<0.05;与治疗前比较,#P<0.05。
2.2 CHB患者恩替卡韦抗病毒效果 CHB患者治疗4周时VR 7例(22.6%)、12周时21例(67.7%)、24周时27例(87.1%)、48周时10例(100%),VR共27例。CHB患者治疗4周时HBeAg转阴0例、12周时10例(32.3%)、24周时13例(41.9%)、48周时9例(90.0%),共转阴13例。
2.3 CHB患者VR、HBeAg转阴前后血清CD28、CTLA4和LAG3水平比较 CHB患者VR前血清CD28、CTLA4和LAG3水平分别为(5.67±3.81)ng/mL、(245.30±134.37)pg/mL、(2.98±0.82)ng/mL,VR后分别为(6.89±8.09)ng/mL、(303.29±254.32)pg/mL、(4.34±3.20)ng/mL,VR后血清LAG3水平较VR前升高(P<0.05)。CHB患者HBeAg转阴前血清CD28、CTLA4和LAG3水平分别为(5.80±4.55)ng/mL、(231.24±132.65)pg/mL、(3.08±1.22)ng/mL,转阴后分别为(7.34±9.09)ng/mL、(370.53±289.64)pg/mL、(4.95±3.66)ng/mL,转阴后血清CTLA4、LAG3水平高于转阴前(P均<0.05)。
3 讨论
HBV感染后,首先激活机体的天然和适应性免疫系统,诱导一系列免疫反应,其中HBV特异性T细胞免疫反应是HBV感染转归的重要决定因素。T细胞的激活需要双信号刺激:第一信号由T细胞表面受体-抗原肽-MHC分子复合物产生,该信号决定了T细胞抗原应答的特异性;第二信号由共刺激分子与其相应受体结合产生,调控着免疫应答的类型和强度[7]。CD28是T细胞活化过程中主要的正向调节共刺激分子,表达于T细胞膜上;其与配体B7结合,协同MHC-TCR-CD3产生双信号,起着增强或放大免疫效应的作用。缺少B7/CD28共刺激信号,会导致抗原刺激的T细胞凋亡和抗原再刺激无反应。CTLA4、LAG3是T细胞活化过程中重要的负性共刺激分子,仅在T细胞接受抗原刺激后被诱导表达。CTLA4同样也与B7配体结合,其表达量较CD28低,而亲和力较CD28高。其主要功能为调节Th1/Th2平衡,促进Th0细胞向Th1亚群分化[7]。LAG3是一种独立的负调节分子,负性调控CD8+T细胞的增殖和功能,增强Treg细胞的抑制活性,同时还调控抗原提呈细胞的活性[8, 9]。研究[10]显示,在慢性淋巴细胞脉络丛脑膜炎病毒感染中,LAG3与慢性病毒感染导致的T细胞耗竭密切相关。文献报道[4,11],CHB患者外周血T细胞表面的CD28、CTLA4、LAG3存在表达异常。因此,本研究进一步阐述了抗病毒治疗过程中血清CD28、CTLA4、LAG3动态变化情况。
本研究显示,CHB患者血清CD28、CTLA4和LAG3水平均低于对照组。这与王琳等[12,13]的研究结果类似。其研究发现,CHB患者外周血CD4+CD28+和CD4+CTLA4+T细胞数量明显下降,外周血单个核细胞中的CD28和CTLA4 mRNA表达量也明显下降。共刺激分子是调节T细胞反应的重要分子,CD28促进Th2细胞分化,而CTLA4能抑制Th1细胞的分化[7, 14]。研究[15]表明,CHB患者的HBV特异性T细胞数量减少且功能下降。因此,上述究结果提示CHB患者的HBV特异性T细胞功能异常可能与共刺激分子表达异常有关。王琳等[12]研究发现,抗病毒治疗有效的CHB患者的CD8+CD28+T细胞数量高于未治疗者。本研究进一步证实,抗病毒治疗使CHB患者血清CD28、CTLA4和LAG3水平逐渐升高;尤其在治疗48周后,血清CD28、CTLA4和LAG3水平升高明显。上述结果表明,CHB患者血清CD28、CTLA4和LAG3水平与抗病毒治疗之间密切相关。我们之前的研究发现,抗病毒治疗能够明显增强CHB患者HBV特异性细胞毒性T细胞(CTLs)的数量和功能,但其机制并不清楚[15]。结合本研究结果推测:高滴度的HBV可能抑制了CD28、CTLA4和LAG3等共刺激分子的表达,进而导致患者HBV特异性T细胞功能异常;而抗病毒治疗直接降低了病毒载量,进而促进了共刺激分子的表达,最终促进了CHB患者HBV特异性T细胞功能恢复。
LAG3被认为是抑制性免疫分子,与T细胞免疫功能密切相关。关于LAG3在CHB患者中的表达情况的文献不多,且结论不一。Ye等[11]发现,LAG3在CHB患者外周血CD8+T细胞上表达增多,且抑制其IFN-γ分泌能力。Kennedy等[16]研究发现,儿童CHB患者T细胞上的LAG3表达正常,并且较成人CHB患者的HBV特异性T细胞反应更强。而本研究显示,CHB患者血清LAG3水平降低,且抗病毒治疗后血清LAG3水平明显增高。HBV感染不同疾病阶段的特异性CTLs免疫功能存在明显差异[17],而LAG3表达情况与特异性CTLs免疫功能明显相关[14]。因此,上述差异可能与不同研究中患者所处的疾病阶段不同有关,也可能与标本类型不同有关。本研究发现,CHB患者发生VR后的血清LAG3水平较VR前升高,HBeAg转阴后血清LAG3水平高于转阴前。这提示LAG3可能具有预测疾病转归潜在价值,但还有待大样本研究来进一步证实。
综上所述,CHB患者血清CD28、CTLA4和LAG3水平降低,核苷类似物恩替卡韦抗病毒治疗使其水平逐渐升高,其中血清LAG3水平与疾病转归密切相关,可能具有预测疾病转归的潜在价值;然而,这些可溶性共刺激分子在免疫应答中具体的作用机制有待进一步研究。
:
[1] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南年版[J].中华肝脏病杂志,2011,19(1):13-24.
[2] 王贵强,王福生,成军,等.慢性乙型肝炎防治指南(2015年更新版)[J].临床肝胆病杂志,2015,31(12):1941-1960.
[3] Li Z, Li N, Li F, et al.Immune checkpoint proteins PD-1 and TIM-3 are both highly expressed in liver tissues and correlate with their gene polymorphisms in patients with HBV-related hepatocellular carcinoma[J]. Medicine (Baltimore), 2016,95(52):e5749.
[4] Wang L, Zhao C, Peng Q, et al. Expression levels of CD28,CTLA-4,PD-1 and Tim-3 as novel indicators of T-cell immune function in patients with chronic hepatitis B virus infection[J]. Biomed Rep, 2014,2(2):270-274.
[5] 张弦,蒋伟,甘建和,等.恩替卡韦治疗慢性乙型肝炎的疗效及其对外周血调节性T细胞水平的影响 [J].山东医药,2016,56(34):42-44.
[6] 李建湘.恩替卡韦治疗对慢性乙型肝炎患者特异性细胞免疫功能的影响及其与血清学转换的关系[J].中华实验和临床病毒学杂志,2008,22(2):122-123.
[7] Chen L, Flies DB. Molecular mechanisms of T cell co-stimulation and co-inhibition[J]. Nat Rev Immunol,2013,13(4):227-242.
[8] Workman CJ, Wang Y, El KK, et al. LAG-3 regulates plasmacytoid dendritic cell homeostasis[J]. J Immunol, 2009,182(4):1885-1891.
[9] Huang RY, Eppolito C, Lele S, et al. LAG3 and PD1 co-inhibitory molecules collaborate to limit CD8+T cell signaling and dampen antitumor immunity in a murine ovarian cancer model[J]. Oncotarget, 2015,6(29):27359-27377.
[10] Freeman GJ, Sharpe AH.A new therapeutic strategy for malaria: targeting T cell exhaustion[J]. Nat Immunol, 2012,13(2):113-115.
[11] Ye B, Li X, Dong Y, et al.Increasing LAG-3 expression suppresses T-cell function in chronic hepatitis B: A balance between immunity strength and liver injury extent[J]. Medicine(Baltimore), 2017,96(1):e5275.
[12] 王琳,赵春楠,祁松楠,等.慢性乙型肝炎患者外周血T淋巴细胞表面共刺激分子表达量变化及其意义[J].中华检验医学杂志,2014,37(2):105-109.
[13] 王琳,赵春楠,史进方,等.HBV慢性患者外周血单个核细胞CD28/B7家族共刺激分子mRNA 表达及其意义[J].重庆医学,2014,43(2):196-199.
[14] Ye B, Liu X, Li X, et al. T-cell exhaustion in chronic hepatitis B infection: current knowledge and clinical significance[J]. Cell Death Dis, 2015,6(3):e1694.
[15] Luo G, Feng X, Huang Y, et al. Effects of antiviral therapy on the cellular immune response in patients with chronic hepatitis B[J]. Mol Med Rep, 2015,11(2):1284-1291.
[16] Kennedy P, Sandalova E, Jo J, et al. Preserved T-cell function in children and young adults with immune-tolerant chronic hepatitis B[J]. Gastroenterology, 2012,143(3):637-645.
[17] 罗光成,易婷婷,蒋兴亮,等.HBV慢性感染者不同阶段的特异性CTLs水平分析[J].免疫学杂志,2015,31(7):637-640.

