以血清学指标比值为变量的肝纤维化诊断模型构建与评价
李曼,李涛,刘振杰,曹永坚,钟伟国,余婷玉,何敏,徐宁
(广州中医药大学第二附属医院,广州510370)
肝纤维化是肝脏受损后的修复愈合反应,该过程中会产生不同程度的纤维化,且与病理分期呈正相关[1];及时发现并控制肝纤维化的发展,对肝病患者的病情发展和预后具有重要意义[2,3]。目前,肝组织病理学检查仍是评价肝纤维化的金标准,但由于其有创伤性、取样误差、患者依从性差等局限性,很难动态观察和评估疗效。因此,寻找能够实时监测且全面评估肝纤维化病情的无创诊断方法已成为研究的重要方向。本研究以肝组织病理活检结果为金标准,采用血清学指标比值为变量建立肝纤维化诊断模型,并对该模型进行效能评价,为临床提供诊断依据。
1 资料与方法
1.1 临床资料 收集2010年10月~2014年7月就诊于广东中医药大学第二附属医院行肝组织病理活检的慢性肝病患者398例,男262例、女136例,年龄15~65岁,排除合并脂肪肝、肝硬化、肝肿瘤等其他肝病。本研究经医院医学伦理委员会同意,患者均签署知情同意书。
1.2 肝组织病理学检查 入选患者均常规行肝脏穿刺术,取肝组织长度1.0~2.0 cm,至少包含6个以上汇管区。常规HE和嗜银染色,由两位资深病理医师按照2000年《病毒性肝脏防治方案》[4]进行阅片,将肝纤维化程度分为5期(S0~S4)。
1.3 肝脏相关血清学指标检查 在肝组织活检前后1周内,空腹采集患者血清标本,纳入15个相关指标,包括透明质酸(HA)、Ⅲ前胶原肽(PⅢNP)、层粘连蛋白(LN)、Ⅳ型胶原(CⅣ)、谷氨酰转肽酶(GGT)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、天门冬氨酸氨基转移酶(AST)、白蛋白(ALB)、腺苷脱氨酶(ADA)、直接胆红素(DBIL)、总胆红素(TBIL)、尿素(UREA)、载脂蛋白A1(Apo A1)、血小板计数(PLT)。HA、PⅢNP、LN、CⅣ采用化学发光法,GGT、ALT、ALP、AST、ADA、UREA采用酶法,ALB采用溴甲酚绿法,DBIL、TBIL采用重氮法,Apo A1采用免疫比浊法,PLT采用光学法。
1.4 肝纤维化诊断模型构建与评价 采用SPSS20.0统计软件。随机选取338例用以诊断模型的建立:将15个血清学指标分别与PLT、ALB作比值,依据肝组织病理活检分期(S0~S4),采用Spearman等级相关分析各指标与肝纤维化分级相关性,r≥0.3存在相关性,P<0.05为差异有统计学意义。对纤维化分级(S)组合: 分组一,是否产生纤维化组,即S≥1(区分S0与S1~4);分组二,纤维化是否≥2级组,即S≥2(区分S0~1与S2~4);分组三,纤维化是否≥3级组,即S≥3(区分S0~2与S3~4);分组四,纤维化是否≥4级组,即S≥4(区分S0~3与S4)。根据以上分组,将与病理分期相关的指标进行二元Logistic回归分析,选择进入法,纳入显著性Sig<0.05单项指标,拟合出四组诊断模型。绘制ROC曲线,曲线下面积(AUC)≥0.7认为有诊断价值。另外60例用以评价诊断模型,参照病理活检分期结果,将以血清学指标比值为变量建立肝纤维化诊断模型的预测结果与其比较。
2 结果
2.1 肝组织病理学检查结果 398例慢性肝病患者中,肝纤维化S0期81例,S1期87例,S2期126例,S3期50例,S4期54例。
2.2 肝脏相关血清学指标检查结果及其与肝纤维化分期的相关性 398例慢性肝病患者,血清HA(16.60,45.00)ng/mL,PⅢNP(5.60,10.20)ng/mL,LN(31.65,74.83)ng/mL,CⅣ(24.40,59.88)ng/mL;ALT(19.00,68.00)U/L,AST(20.00,47.75)U/L,GGT(17.00,55.75)U/L,ALP(56.00,87.00)U/L,ADA(8.60,15.68)U/L,ALB(41.73,46.90)g/L,TBIL(9.30,16.60)μmol/L,DBIL(3.20,5.80)μmol/L;UREA(3.70,5.01)mmol/L,Apo A1(1.02,1.35)g/L,PLT(149.00,222.75)×109/L。除CⅣ/PLT、 Apo A1/PLT、CⅣ/ALB、UREA/ALB、Apo A1/ALB与肝纤维化分期相关性较小外,其他指标的相关系数r均>0.3,P均=0.000。结果见表1。

表1 肝脏相关血清学指标与肝纤维化分期的相关性
2.3 构建的肝纤维化诊断模型 ln(p1/1-p1)=-4.603+21.838×HA/PLT-151.979×PⅢNP/PLT+117.009×ADA/PLT-5.507×HA/ALB+36.553×PⅢNP/ALB;ln(p2/1-p2)=-3.314-1.839×HA/ALB+10.345×ADA/ALB+0.645×GGT/ALB+9.450×HA/PLT;ln(p3/1-p3)=-3.524+27.842×ADA/PLT+3.282×PⅢNP/ALB+0.582×ALP/ALB-4.932×ADA/ALB;ln(p4/1-p4)=-4.170-5.979×AST/PLT+44.142×ADA/PLT+5.001×PⅢNP/ALB-6.926×ADA/ALB+1.174×AST/ALB。p1为S≥1预测概率,p2为S≥2的预测概率,p3为S≥3的预测概率,p4为S≥4的预测概率。利用p1、p2、p3、p4绘制ROC曲线,AUC均>0.7,根据ROC曲线结果得出有诊断价值的最佳截断点。见表2。

表2 不同分组ROC曲线结果
2.4 肝纤维化诊断模型的诊断效能评价结果 预测模型分级与活检分期结果完全相同的有23例,占38.33%;活检分期为S1者23例,模型预测完全一致者12例;活检分期为S2者28例,模型预测完全一致者7例;活检分期为S3者6例,与模型预测完全一致者2例;活检分期为S4者3例,模型预测完全一致者2例。参考病理学半定量分期可接受正负一个等级判定,纳入符合病例数40例,占总样本的70%。见表3。
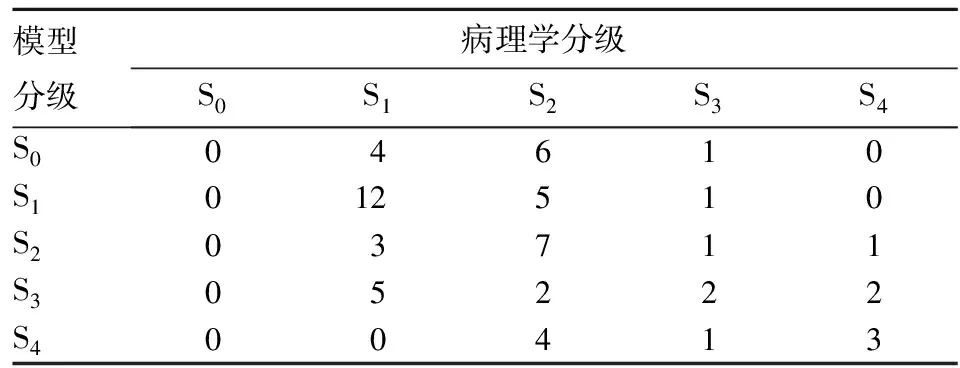
表3 模型预测结果与病理学分级结果对比
3 讨论
肝纤维化是各种慢性肝病发展的必经病理过程,也是细胞外基质合成与降解失衡的体现,及时干预和治疗肝纤维化发展,防止其向肝硬化甚至肝细胞癌的恶性转变已成为目前面临的重要任务。肝组织病理活检可以准确反映肝脏纤维化程度,但由于其存在一定的局限性,很难作为常规检查手段。近年来,随着血清学检测技术的发展和不断更新,血清学指标的敏感性和特异性也逐渐升高,快速、准确、及时的检测结果,可为临床提供诊断和监测病情的依据。与肝脏疾病相关的血清学指标已成为临床诊断的科学依据[5],联合多个血清学指标构建诊断模型已成为未来发展的趋势。目前报道的非创伤性诊断模型,具有代表性的包括Hepascore模型[6]、Zeng模型[7]、Forns指数[8]、APRI指数[9]等,但这些模型未在临床广泛应用,诊断效能仍需进一步验证。
本文构建了以血清学指标比值为变量的诊断模型,采用回顾性数据分析。首先通过Excel表格对数据进行初步处理,综合单项指标的中位数、四分位数和均值,发现部分指标数值随着病理分期呈逐渐上升或逐渐下降的趋势;将整体上有上升趋势的指标与呈下降趋势的PLT、ALB作比值,筛选与病理组织分期相关的指标进行二元Logistic回归分析。结果显示,被纳入拟合模型的指标包括HA/PLT、PⅢNP/PLT、ADA/PLT、HA/ALB、PⅢNP/ALB、ADA/ALB、GGT/ALB、ALP/ALB、AST/PLT、AST/ALB。除作为分母的ALB、PLT外,分组模型中均出现的指标是ADA;PⅢNP出现在分组一、三、四,HA出现在分组一、二,GGT出现在分组二,ALP出现在分组三,AST出现在分组四。ADA是反应肝功能损伤的敏感指标,与机体细胞免疫活性相关。肝硬化时, ADA明显上升,并随着肝纤维化程度而逐渐升高,可作为慢性肝病的筛选指标[10],灵敏地反映肝纤维化活动的情况。肝纤维化的产生与细胞外基质及其代谢产物有关,其中HA、PⅢNP及CⅣ已成为临床诊断肝纤维化程度的常用指标[11]。HA是肝细胞外间质的重要成分,肝间质细胞增多,可致肝纤维化;同时,间质细胞分解降低,血液中HA增加,其水平可反映肝纤维化的发展程度[12]。苑同业等[13]报道,PⅢNP与炎症及肝纤维化的进展相一致,在不同病理分期中存在差异,可反映肝纤维化的活动程度,其水平高低提示肝纤维化程度的轻重。有研究[14]显示, GGT、AST、ALT、ALP等均是诊断肝脏疾病的关键酶,联合检测可准确全面地反映肝脏疾病酶学的变化,存在明显的临床价值。
以上阐述,除PLT和ALB与肝脏病变呈负相关外[15,16],其他被纳入模型的指标都与肝脏疾病密切相关,与病变程度呈正相关,但是否随着肝纤维化分期呈明显的正相关还有待研究。所以,本研究将与肝纤维化分期呈正相关或有趋势变化的指标与PLT、ALB的比值作为变量纳入模型,更加突出地显示这些指标在分期中的诊断价值。相关报道[17,18]显示,GGT/PLT、ALT/PLT、AST/PLT对肝纤维化有诊断价值,但相关指标与ALB比值的研究未见报道。PLT在肝脏纤维化分期中存在显著差异,但以往研究中不同肝纤维化分期PLT平均值差异较大,主要是因为患者之间的PLT分布较离散,方差较大;再加上PLT检测方法的局限性,大多医院还采用电阻抗法检测,因其识别血小板仅根据颗粒大小,容易受小红细胞、红细胞碎片等因素干扰,可能导致PLT假性偏高或减低。本研究PLT检测采用光学法,是通过分析细胞大小、内部结构及DNA、RNA载量综合判断,更加真实地反映PLT水平。有研究显示[16],肝纤维化形成的活跃期ALB明显增加,随着肝纤维化程度逐渐增加,ALB呈下降趋势。本研究初期对数据的分析中ALB与病理分期呈负相关,呈逐渐下降趋势,与以上报道有部分不符,可能与收集的数据存在差异有关;同时对模型的验证也显示,综合指标对病理分级具有较好的诊断价值。
综上所述,本研究以血清学指标比值为变量建立的诊断模型,同时纳入多个相关指标作为变量,平衡单个指标的趋势性优势与离散性缺点,提高了该模型的预测能力,但由于收集病例的数量有限,可能一些有诊断价值的指标没有纳入模型,后续将更全面的收集病例进行研究,完善诊断模型。
:
[1] Gaggini MC, Navarro RS, Stefanini AR, et al. Correlation between METAVIR scores and Raman spectroscopy in liver lesions induced by hepatitis C virus: a preliminary study[J]. Lasers Med Sci, 2015,30(4):1347-1355.
[2] Yoav L, Muriel W, Ruth C, et al. Non-invasive diagnosis of liv er fibrosis and cirrhosis[J]. World J Gestroenterol, 2015,21(41):11567-11583.
[3] 肝脏硬度评估小组.瞬时弹性成像技术诊断肝纤维化专家意见[J].中华肝病杂志,2013,21(6):420-424.
[4] 中华医学会传染病与寄生虫病学会,肝病学分会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[5] 赵晓薇.ADA 与ALT AST GGT 联合检测在肝脏疾病诊断中的意义[J].内蒙古医学杂志,2014,46(11):1357-1358.
[6] Adams LA, Bulsara M, Rossi E, et al. Hepascore: an accurate validated predictor of liver fibrosis in chronic hepatitis C infection[J]. Clin Chem, 2005,51(10):1867-1873.
[7] Zeng MD, Lu LG, Mao YM, et al. Prediction of significant fibrosis in HBeAg-positive patients with chronic hepatitis B by a noninvasive model[J]. Hepatology, 2005,42(6):1437-1445.
[8] Forns X, Ampurdanes S, Llovet JM, et al. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model[J]. Hepatology, 2002,36:986-992.
[9] Wai CT, Greenson JK, Fontana RJ, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C[J]. Hepatology, 2003,38(2):518-526.
[10] 叶柱均,叶淑霞,张飞勇,等.ADA与ALT、AST、GGT联合检测在肝脏疾病诊断中的意义[J].国际医药卫生导报,2016,22(9):1300-1302.
[11] Friedman SL. Evolving challenges in hepatic fibrosis[J]. Nat Rev Gastroenterol Hepatol, 2010,7(8):425-436.
[12] Hou XY, Ellis MK, McManus DP, et al. Diagnostic value of non-invasive bio-markers for stage-specific fibrosis in patients with advanced schist-osomiasis japonca[J]. Int J Parasitol, 2011,41(34):325-332.
[13] 苑同业,刘国凤,张立营.血清Ⅲ型前胶原测定在肝纤维化诊断中的应用[J].中国疗养医学,2014,23(9):238-240.
[14] 张伟龙,肖翔,潘理想,等.ADA 与ALT、AST、GGT 联合检测在肝脏疾病诊断的价值研究[J].中国实用医药,2017, 12(1):53-55.
[15] Keef EB, Dieterich DT, Han SH, et al. A treatment algorithm for the management of chronic hepatitis B virus in ghe United States:an update[J].Clin Gastroenterol Hepatol, 2006,4(8):936-962.
[16] 许庆忠,雷霆雯,马小平.实验性肝纤维化血清白蛋白含量变化[J].贵阳医学院学报,2002,27(2):128-129.
[17] 夏琦,符节海,蔡卫民,等.AST/PLT和GGT/PLT比值对肝纤维化的诊断价值[J].临床肝胆病杂志, 2007,23(5):364-366.
[18] 董菁菁,郭宏华.GGT与PLT比值指数对慢性乙型肝炎肝纤维化的诊断价值[J].临床肝胆病杂志,2017,33(3):548-551.

