烟酸、果寡糖及柠檬酸稀土组合对肉牛瘤胃体外发酵特性及菌群结构的影响
梁 欢 赵向辉 许兰娇 文露华 陈作栋 赵二龙 瞿明仁
(江西农业大学,江西省动物营养重点实验室,营养饲料开发研究中心,南昌 330045)
瘤胃是反刍动物区别于单胃动物最显著的特征之一,瘤胃发酵功能及特性的好坏对反刍动物健康与生产影响巨大。因此,如何调控瘤胃发酵特性,增强瘤胃发酵功能,一直是反刍动物营养研究的重中之重。
果寡糖(fructooligosaccharides,FOS),又称为低聚果糖、果聚糖,是在蔗糖分子上以β-1,2-糖苷键结合数个D-果糖所形成的一组低聚糖的总称,具有调控瘤胃微生物区系的作用[1]。瞿明仁等[2]和凌宝明等[3]均通过研究发现,灌注2.00%果寡糖可以显著降低绵羊瘤胃液相pH和瘤胃内的氨态氮(NH3-N)含量,显著提高瘤胃内挥发性脂肪酸(VFA)和微生物蛋白(MCP)含量,有效添加剂量为饲粮的0.8%。

柠檬酸稀土(rare earth citrate,REC),是一种有待开发的新型高效饲料添加剂,其中稀土元素对生物体有较强的生理活性,是一种生理激活剂,可以改变动物或微生物对饲料营养物质的消化吸收,增强机体蛋白质和核酸的合成,从而促进动物和微生物生长,柠檬酸稀土的有效添加剂量为饲粮的0.6%[8]。
从上述研究可见,果寡糖、烟酸及柠檬酸稀土对瘤胃的发酵功能具有调控作用,而且均是通过促进瘤胃微生物生化代谢及生长繁殖来实现瘤胃调控功能的,但目前研究报道均是使用单一调控剂来调控瘤胃发酵功能,而对这3种调控剂是否有组合效应、是否能增强其调控效果、适宜的组合如何,尚未见到研究报道。因此,本试验拟研究这3种调控剂组合对肉牛瘤胃体外发酵特性及菌群结构的影响,旨在为开发效果优良的复合瘤胃调控剂,并为其在肉牛养殖中的应用提供依据和技术支撑。
1 材料与方法
1.1 试验材料
果寡糖购自河北维尔康制药有限公司,其纯度大于90%。
烟酸购自郑州嘉禾生物制品有限公司,有效成分含量≥95%。
柠檬酸稀土购自江西筐庐科技有限公司,为白色或淡黄色流动性粉末,其柠檬酸稀土含量≥99%,其中稀土元素(RE,主要是镧系元素)≥36%,镉(Cd)≤0.000 1%、铅(Pb)≤0.002%、砷(As)≤0.000 5%。
1.2 试验动物、饲粮及饲养管理
选用3只体重为(375±28) kg、安装有永久性瘤胃瘘管的健康锦江黄牛公牛为瘤胃液供体,口服伊维菌素统一驱虫,单圈饲养。基础饲粮为玉米-豆粕-稻草型饲粮,按照《肉牛饲养标准》(NY/T 815—2004)配制,精粗比为20∶80。基础饲粮组成及营养水平见表1。每日分2次(08:00和18:00)等量饲喂,自由饮水。
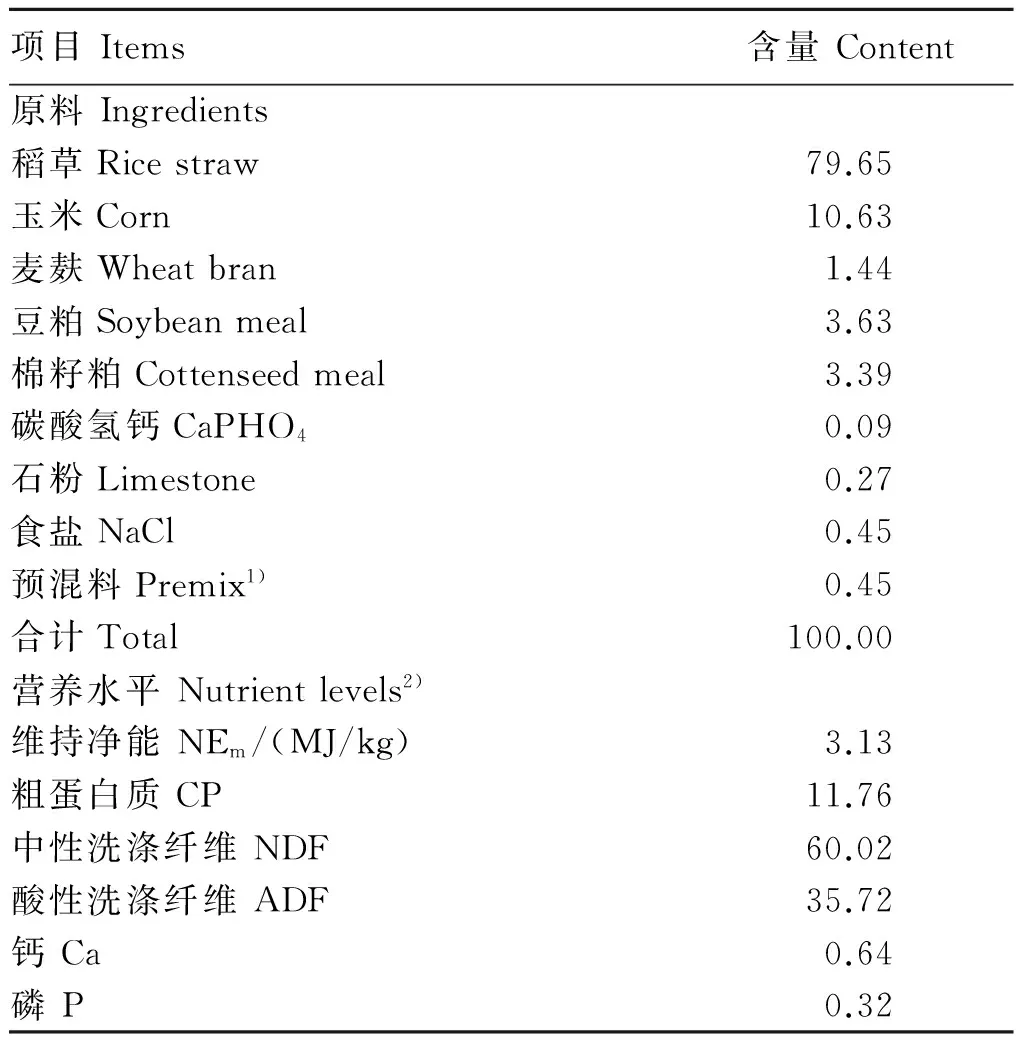
表1 基础饲粮组成及营养水平(干物质基础)
1)每千克预混料含有Contained the following per kg of premix:VA 500 000 IU,VD380 000 IU,VE 200 000 IU,Fe 10 g,Mn 8 g,Zn 6 g,Se 0.02 g,I 0.1 g,Co 0.02 g。
2)NEm为计算值,计算方法:NEm=DE×Km;Km=0.187 5×(DE/GE)+0.457 9。式中:NEm为维持净能;DE为饲粮消化能;Km为消化能转化为维持净能的效率;GE为饲粮总能[9]。其他营养水平为测定值。NEmwas a calculated value, which was calculated as follows: NEm=DE×Km; Km=0.187 5×(DE/GE)+0.457 9. In the formulas, NEmpresented net energy for maintenance, DE presented digestive energy, Km presented the efficient of DE converted into NEm, and GE presented gross energy[9]. The other nutrient levels were measured values.
1.3 体外发酵方法
试验前,根据Menke等[10]的配方配制缓冲液,主要包括微量元素溶液、碳酸缓冲溶液、磷酸缓冲溶液、硫化钠(Na2S)还原溶液以及刃天青指示剂。将配制好的缓冲液混匀后持续通入CO2在30 min以上直至溶液pH达到6.8,置于39 ℃恒温水浴锅中备用。
于晨饲前利用长臂手套,通过瘤胃瘘管分别于瘤胃上下前后4个部位采集等量瘤胃液,混合均匀。采集好的瘤胃液迅速灌入经预热达39 ℃并通有CO2的灭菌清洁烧杯中,烧杯置于装有39 ℃蒸馏水的保温瓶中,灌满后立即盖好保温瓶盖子,迅速返回试验室,经4层纱布过滤后持续通入CO25 min,然后迅速分装至已预热好并装有培养底物(基础饲粮500 mg+对应的调控剂组合)和缓冲液(40 mL)的培养瓶内,每个培养瓶加20 mL瘤胃液。接通培养瓶和注射器,打开振荡开关,培养48 h。体外批次培养装置参照卢德勋[11]和程茂基[12]所述的方法设计。该装置主体为恒温水浴摇床,其水浴温度和振荡速率可调。培养瓶为瓶口安装有橡皮塞的150 mL酸奶瓶,酸奶瓶通过1根带针头的橡胶管上与注射器连接。
1.4 试验设计
试验采用3因素3水平[L9(33)]正交试验设计,共设9个调控剂组合,每个调控剂组合设3个培养瓶。各调控剂在基础饲粮中的添加水平见表2。
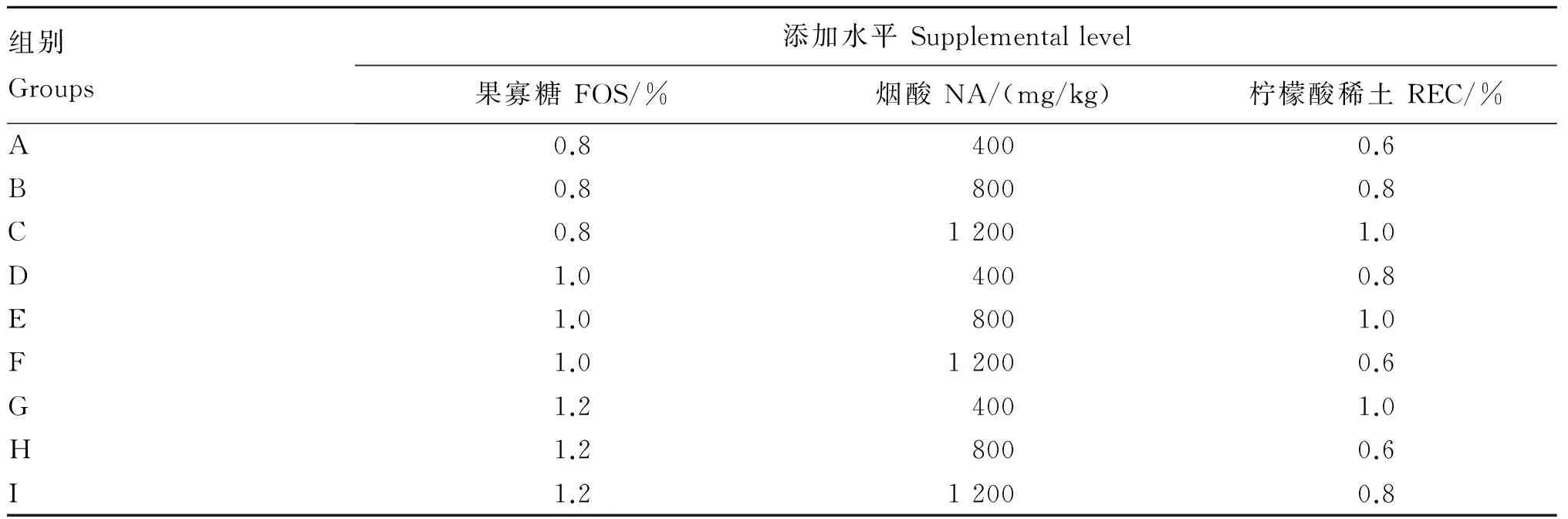
表2 L9(33)正交试验设计
1.5 样品的预处理
培养48 h后,取培养液立即测定pH,将培养瓶中滤渣无损地转移入经烘干称重的尼龙袋(孔径200目)中,采集滤液样品,部分滤液-20 ℃冷冻保存,用于瘤胃发酵参数(NH3-N、VFA和MCP含量)的测定,部分滤液装在离心管中,-80 ℃冷冻保存,用于高通量测序。
1.6 测定指标与测定方法
饲粮中粗蛋白质(CP)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、钙(Ca)和磷(P)含量的测定参照《饲料分析及饲料质量检测技术》[13]进行。
培养液pH采PHS-25型实验室pH计(上海今迈仪器仪表有限公司)进行测定;NH3-N含量采用苯酚-次氯酸钠比色法[14]进行测定;VFA含量采用Waters-Baseline 520液相色谱仪进行测定,分析条件为波长214 nm,C18柱温维持在30 ℃,流动相0.02 mol/L KH2PO4/H3PO4,pH 2.37,流速1 mL/min,进样量10 μL[15];MCP含量利用紫外分光光度计采用比色法[16]进行测定。
1.7 高通量测序及生物信息学分析
通过分析前期试验数据,从9个组中筛选出结果差异最大的2个组(A和I组)进行高通量测序分析。取5 mL瘤胃体外发酵培养液样品送上海祥音生物公司进行DNA提取,并对质量合格样品的细菌16S rDNA V4~V5区(515F~907R)进行测序,测序采用Illumina MiSeq PE250测序平台。
对测得的原始数据进行质量控制,舍弃低质量序列(read尾部碱基质量<20,质控后的read<50 bp),获得的高质量序列用Usearch 7.1软件进行聚类,以16S rDNA序列97%的相似度作为分类操作单元(operational taxonomic unit,OTU)的划分标准。获得的OTU与RDP数据库比对,通过RDP Classifier鉴定OTU代表性序列的微生物分类地位。丰富度指数(Chao指数、Ace指数)和多样性指数(Shannon指数、Simpson指数)的计算利用Mothur 1.30.1软件完成。采用Metastats分析方法比较分析各组之间的差异菌群。
1.8 统计分析
试验数据经Excel 2003初步整理后,利用SPSS 17.0软件进行单因素方差分析(one-way ANOVA),当差异显著时,采用Duncan氏法进行多重比较,结果以平均值±标准误表示,P≤0.05为差异显著。
2 结果与分析
2.1 体外培养液pH、NH3-N和MCP含量分析
由表3可知,不同调控剂组合对体外培养液pH和NH3-N含量具有显著影响(P≤0.05),G组体外培养液的pH最高,为6.77,显著高于A、B、C、D、E组(P≤0.05),A组体外培养液的pH最低,为6.66,显著低于E、F、G、H、I组(P≤0.05);C组体外培养液中NH3-N含量最高,为12.04 mg/dL,显著高于G、H组(P≤0.05),G组体外培养液中NH3-N含量最低,为9.77 mg/dL,显著低于其余各组(P≤0.05);各组体外培养液中MCP含量差异不显著(P>0.05),其中I组培养液中MCP含量最高,为37.55%,B、C组体外培养液中MCP含量均最低,为34.97%。
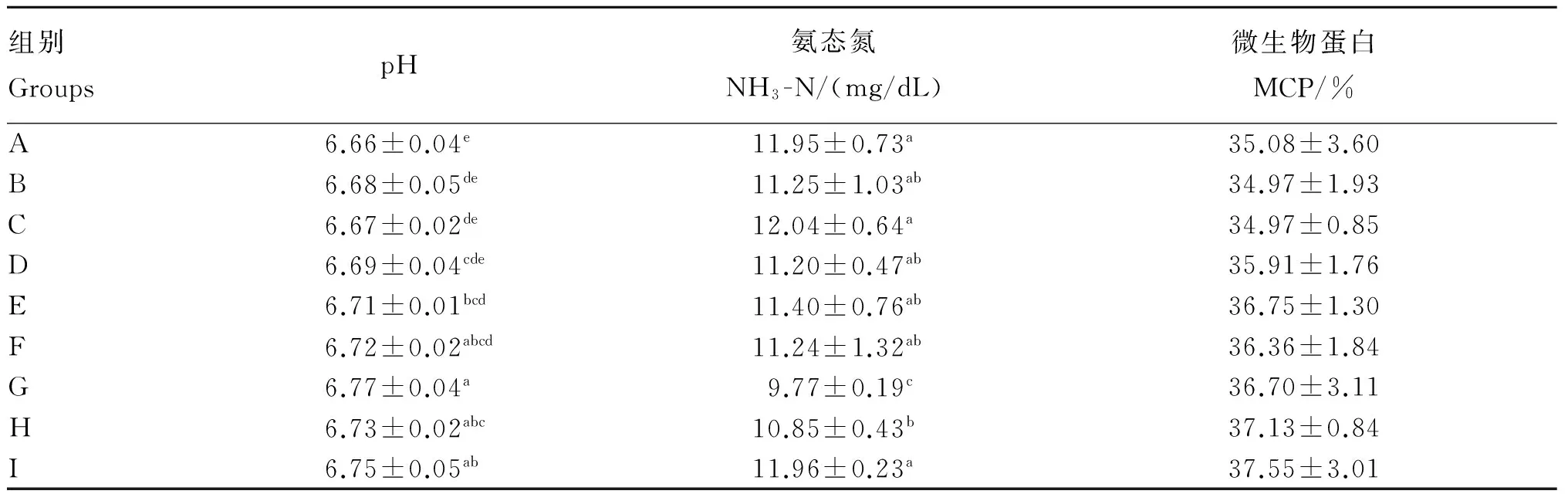
表3 不同调控剂组合对体外培养液pH、NH3-N和MCP的影响
同列数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P≤0.05)。下表同。
In the same column, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P≤0.05). The same as below.
2.2 体外培养液VFA含量分析
由表4可知,体外培养液中总挥发性脂肪酸(TVFA)浓度、乙酸和丁酸含量各组之间无显著差异(P>0.05),其中A组体外培养液的TVFA浓度和乙酸含量均为最高,C组体外培养液的丁酸含量最高;不同调控剂组合对体外培养液中丙酸含量和乙酸/丙酸值具有显著影响(P≤0.05),其中I组培养液中丙酸含量最高,为28.53%,显著高于A、B、D、E组(P≤0.05),I组体外培养液的乙酸/丙酸值最低,显著低于A、B、D组(P≤0.05)。
2.3 OTU聚类分析
本试验选取A和I组2个调控剂组合,共6个瘤胃体外培养液样品(A1、A2、A3、I1、I2、I3)进行高通量测序,共获得426 895条序列,平均每个样品71 149条。序列在97%的相似度下共获得12 531个物种分类的OTU,平均每个样品2 089个OTU。A1、A2、A3的OTU数分别为2 012、1 522和2 050个;I1、I2、I3的OTU数分别为2 482、1 662和2 803个。
由图1-A可知,来自同一组的样品聚类在一起,主成分分析(PCA)获得主成分1(PC1)的贡献率为77%,主成分2(PC2)的贡献率为16%;门水平分类上的丰度热图(图1-B)显示体外培养液中主要菌群来自拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicultes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)、螺旋体门(Spirochaetes)。
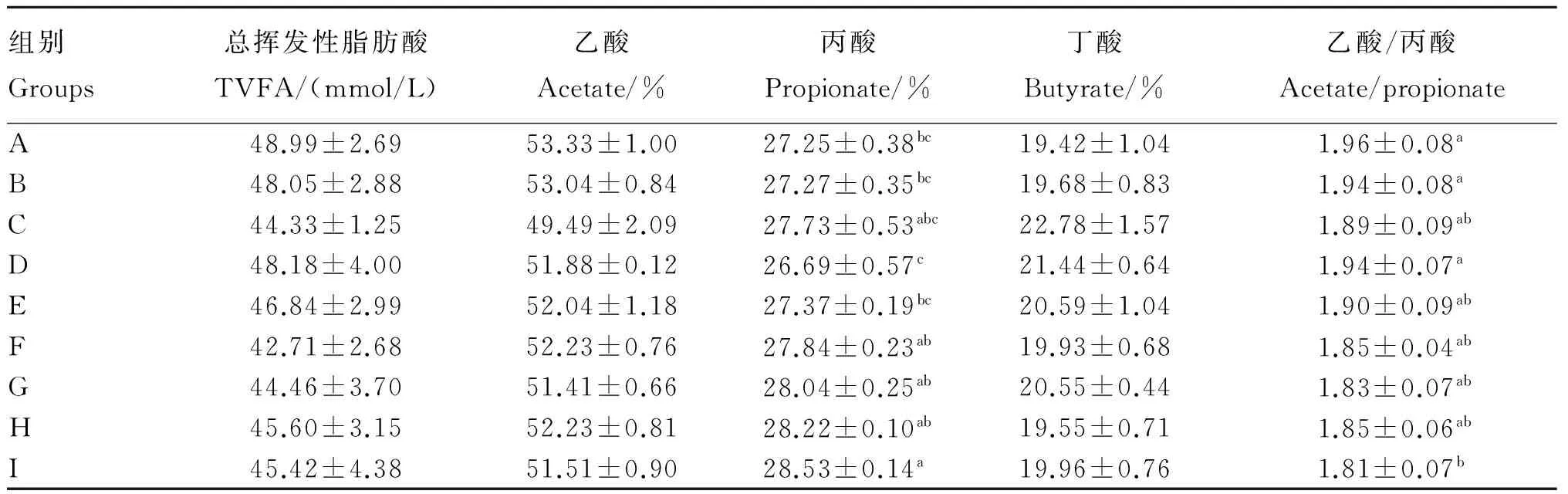
表4 不同调控剂组合对体外培养液VFA含量的影响
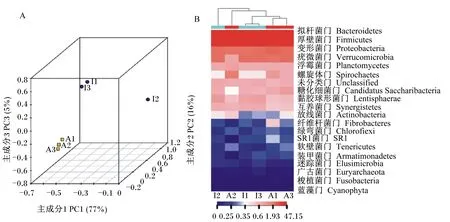
图1 体外培养液菌群OTU主成分分析图(A)及其门水平分类热图(B)
2.4 菌群α多样性分析
α多样性反映了单个样品内部物种的多样性,其中Chao指数和Ace指数反映样品中菌群的丰富度,Shannon指数和Simpson指数反映样品中菌群的多样性。由表5可知,与A组相比,I组体外培养液的Chao指数、Ace指数和Shannon指数均较高,而Simpson指数较低,因此I组体外培养液具有更高的菌群多样性。
2.5 菌群结构分析
A和I组体外培养液的差异菌群统计结果见表6。在门水平上,2组之间存在4个差异显著的菌群(P≤0.05),分别是Spirochaetes、黏胶球形菌门(Lentisphaerae)、互养菌门(Synergistetes)和软壁菌门(Tenericutes)。在属水平上,2组之间存在15个差异显著的菌群(P≤0.05),分别是普氏菌属(Prevotella)、Paraprevotella、未分类的亚门5(subdivision 5_genera_incertae_sedis)、施氏菌属(Schwartzia)、假丁酸弧菌属(Pseudobutyrivibrio)、密螺旋体菌属(Treponema)、梭菌属14a(ClostridiumⅩⅣa)、Victivallis、未分类的亚门3(subdivision 3_genera_incertae_sedis)、依赖杆菌属(Fretibacterium)、寡糖菌属(Oligosphaera)、梭菌属14b(ClostridiumⅩⅣb)、月单胞菌属(Selenomonas)、Hydrogenibacillus、嗜热菌属(Defluviitalea)。
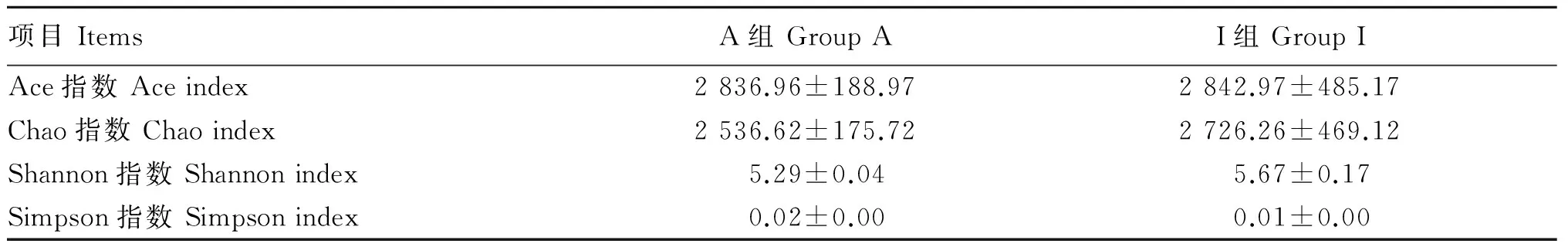
表5 体外培养液菌群α多样性分析
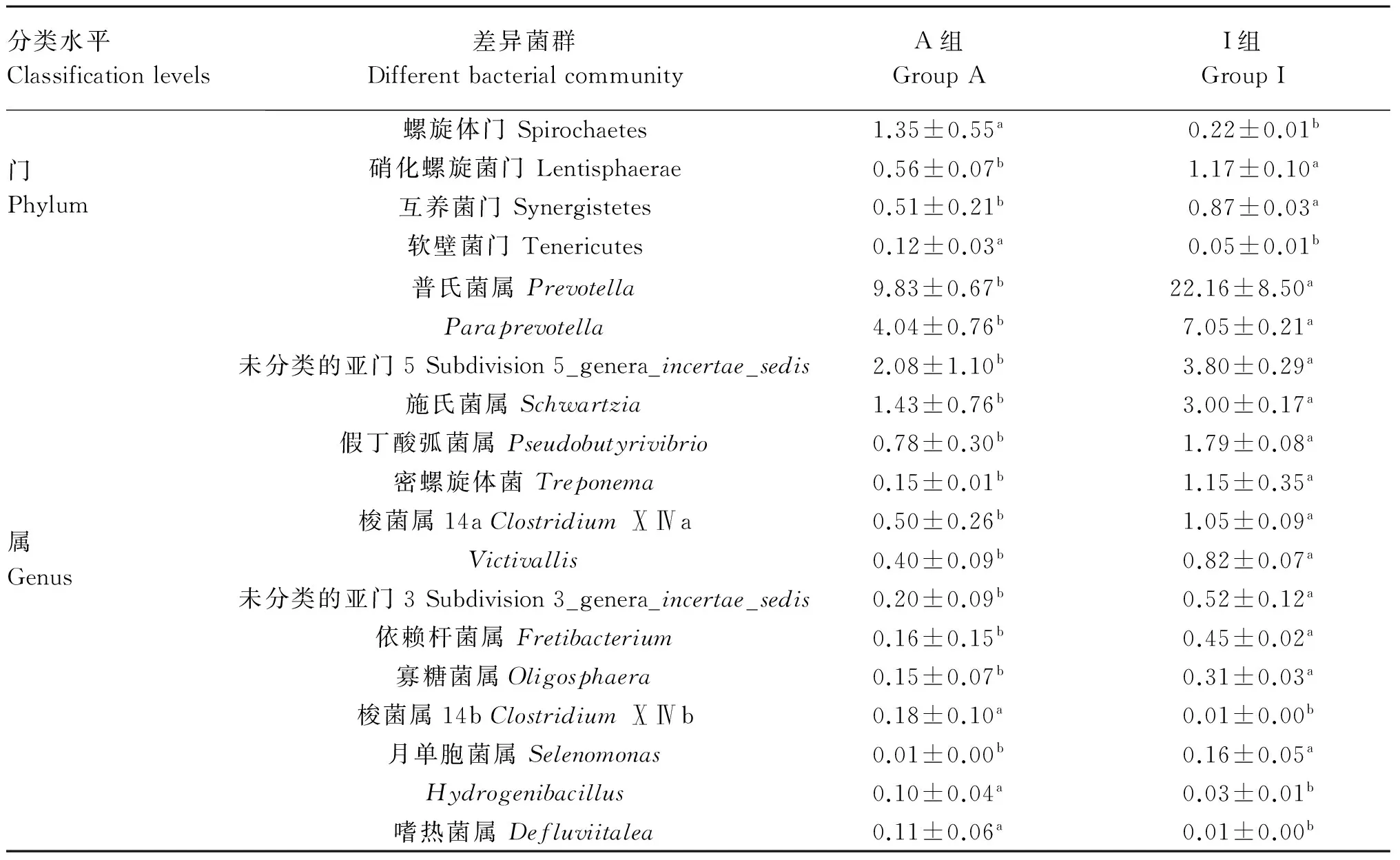
表6 体外培养液差异菌群分析
3 讨 论
3.1 烟酸、果寡糖及柠檬酸稀土组合对肉牛瘤胃体外培养液pH、NH3-N和MCP含量的影响
瘤胃液的pH是衡量瘤胃发酵的综合指标,适宜的瘤胃液pH是瘤胃微生物正常活动所必需的,瘤胃液pH的正常变化范围为5.5~7.5,本次试验中各组体外培养液pH均在正常瘤胃pH范围内。在正常情况下,饲粮添加寡糖会降低瘤胃液pH,而本次试验中,体外培养液的pH随着果寡糖添加水平的增加而显著提高,但仍在正常范围之内,这与Vidová等[17]的研究结果不一致,原因可能与烟酸的添加有关,烟酸可显著降低瘤胃内乳酸含量,提高瘤胃液pH,表明果寡糖和烟酸之间存在交互作用。
NH3-N是瘤胃内肽、氨基酸、蛋白质和尿素等其他非蛋白氮化合物共同分解的终产物,也是瘤胃微生物合成MCP的主要原料。瘤胃内最佳NH3-N含量为0.35~29.00 mg/dL[18],本试验各组体外培养液中NH3-N含量介于9.77~12.04 mg/dL,在正常范围内。本试验中,体外培养液NH3-N含量随果寡糖添加水平的增加而显著降低,这与瞿明仁等[2]的研究结果一致,通过比较本次试验与瞿明仁等[2]的试验结果可发现,本次试验的整体NH3-N含量更低,说明瘤胃微生物对NH3-N的利用效果更好,原因可能是添加烟酸和柠檬酸稀土均可以促进能量代谢,为瘤胃微生物利用NH3-N合成MCP提供能量,表明这3种瘤胃调控剂之间存在正组合效应。此外,本试验还发现,添加0.8%的柠檬酸稀土会显著降低体外培养液NH3-N含量,这与Liu等[19]的研究结果相一致,原因可能是适量的稀土元素会促进瘤胃微生物对NH3-N的利用。
MCP是反刍动物最主要的氮源,可满足反刍动物氮需要量的40%~80%,本次试验中各组体外培养液中MCP含量差异不显著,但以I组体外培养液的MCP含量最高,为37.55%,且MCP含量的整体水平随果寡糖添加水平的增加而提高,导致各组之间差异不显著的原因可能与3种瘤胃调控剂之间的交互作用有关。
3.2 烟酸、果寡糖及柠檬酸稀土组合对肉牛瘤胃体外培养液VFA含量的影响
丙酸是反刍动物体内糖异生的主要前体物质,且丙酸发酵时可以利用氢气,使甲烷产量减少,能量转化效率提高[20]。乙酸/丙酸值反映瘤胃发酵类型,其值越小,丙酸比例越高,饲料能量利用率也相应越高。本试验中,不同调控剂组合对体外培养液中丙酸含量和乙酸/丙酸值存在显著影响,说明添加不同调控剂组合显著影响了瘤胃发酵类型,其中I组体外培养液中丙酸含量最高,乙酸/丙酸值最低,原因可能与I组瘤胃调控剂组合的比例有关,I组中果寡糖和烟酸的添加水平均为本次试验设计的最高值,柠檬酸稀土添加水平为0.8%。张学峰等[21]通过体外试验研究发现,在绵羊饲粮中添加寡糖能降低发酵产物中乙酸/丙酸值,Schaetzel等[22]研究发现添加烟酸对瘤胃微生物的生长有影响,可显著降低瘤胃中乙酸/丙酸值,Liu等[19]研究发现,添加适量的稀土添加剂[氯化镧(LaCl3)]后,肉牛瘤胃中丙酸含量显著高于对照组,乙酸/丙酸值显著低于对照组,这些结果均与本试验结果相一致。通过比较本试验与张学峰等[21]的试验结果可以发现,在同等试验条件下,本次试验整体丙酸含量更高,乙酸/丙酸值更低,说明3种瘤胃调控剂组合之间存在正组合效应,其中烟酸发挥了更显著的作用,有效地促进了丙酸发酵。本次试验中各组体外培养液中乙酸和丁酸含量差异不显著,原因可能是在添加的3种瘤胃调控剂中,烟酸对碳水化合物的发酵具有更显著影响,烟酸可提高丙酸含量,降低乙酸和丁酸含量[23],削弱果寡糖提高瘤胃内乙酸和丁酸含量的作用,造成各组乙酸和丁酸含量差异不显著。
3.3 烟酸、果寡糖及柠檬酸稀土组合对肉牛瘤胃体外培养液菌群多样性的影响
本试验利用Illumina Miseq测序平台,采用16S rDNA高通量测序技术比较研究了不同调控剂组合对肉牛瘤胃体外培养液菌群多样性的影响,结果表明,与A组相比,I组菌群的丰富度和多样性相对较高,通过分析A和I组的瘤胃调控剂组合可以发现,I组中果寡糖和烟酸添加水平均为本次试验设计的最高值,分别为1.2%和1 200 mg/kg,而A组均为最低值,这说明在低精料饲粮中适量增加寡糖和烟酸可以促进瘤胃微生物的生长,提高瘤胃中菌群的多样性,这一结果与闵力等[24]、潘龙等[25]和Ottou等[26]的研究结果相一致。高雨飞等[27]研究了在高精料饲粮中添加烟酸对瘤胃菌群多样性的影响,结果表明添加烟酸降低了瘤胃菌群多样性,这一结果与本试验结果不一致,原因可能与添加柠檬酸稀土有关,柠檬酸稀土是一种生理激活剂,可促进微生物生长,提高瘤胃菌群多样性。
3.4 烟酸、果寡糖及柠檬酸稀土组合对肉牛瘤胃体外培养液菌群结构的影响
本次试验结果表明,在不同调控剂组合处理下,锦江黄牛瘤胃体外培养液中优势菌群均为Bacteroidetes和Firmicultes,这与其他反刍动物的研究结果[28-29]相一致。黄色瘤胃球菌(Ruminococcusflavefaciens)、白色瘤胃球菌(Ruminococcusalbus)和琥珀酸丝状杆菌(Fibrobactersuccinogenes)是瘤胃中主要的纤维分解菌[30]。但也有研究报道,有些非纤维降解菌能与纤维降解菌发生协同作用,提高瘤胃中纤维素的降解率[31],如栖瘤胃普雷氏菌(Prevotellaruminicola)[32]、Treponema[33]等,本试验中,与A组相比,I组体外培养液中Prevotella和Treponema的丰度显著提高了,这2种菌属可能与纤维降解菌发生了协同作用,促进纤维分解菌的活性。产琥珀酸菌(Succiniclasticumruminis)[34]和Schwartzia[35]可以将瘤胃中的琥珀酸盐转化为丙酸,为反刍动物提供葡萄糖合成的前提物质。反刍兽月形单胞菌(Selenomonasruminantium)也是非纤维降解菌,它可以协同Fibrobactersuccinogenes和Ruminococcusflavefaciens进行纤维素的降解,并提高瘤胃中丙酸的产生量[36]。本试验中,与A组相比,I组体外培养液中Schwartzia和Selenomonas的丰度显著提高,由上述可知,这2种菌群均可促进瘤胃中丙酸的产生,这与本试验中瘤胃发酵参数的结果相一致,即I组体外培养液VFA中丙酸的比例最高。
4 结 论
① 不同烟酸、果寡糖及柠檬酸稀土组合可以显著改变肉牛瘤胃发酵模式,提高体外培养液中丙酸含量。
② 不同烟酸、果寡糖及柠檬酸稀土组合显著影响了肉牛瘤胃菌群中Prevotella、Schwartzia、Treponema和Selenomonas等的丰度。
③ 肉牛玉米-豆粕-稻草型饲粮条件下,较优的调控剂组合为1.2%果寡糖+1 200 mg/kg烟酸+0.8%柠檬酸稀土和1.2%果寡糖+400 mg/kg烟酸+1.0%柠檬酸稀土。
参考文献:
[1] FIRKINS J L,OLDICK B S,PANTOJA J,et al.Efficacy of liquid feeds varying in concentration and composition of fat,nonprotein nitrogen,and nonfiber carbohydrates for lactating dairy cows.[J].Journal of Dairy Science,2008,91(5):1969-1984.
[2] 瞿明仁,凌宝明,卢德勋,等.灌注果寡糖对生长绵羊瘤胃发酵功能的影响[J].畜牧兽医学报,2006,37(8):779-784.
[3] 凌宝明,余学兰,陈水均,等.功能性寡糖及其在反刍动物营养中的应用[J].广东畜牧兽医科技,2006,31(5):6-9.
[4] 李新建,高腾云,王永才.烟酸在反刍动物营养中的研究进展[J].安徽农学通报,2006,12(3):133-135.
[5] 王桂兰,王益娜,马江锋,等.不同还原性碳源对重组大肠杆菌厌氧发酵生产丁二酸的影响[J].中国酿造,2009,28(3):16-19.
[6] FOSTER J W,PARK Y K,PENFOUND T,et al.Regulation of NAD metabolism in Salmonella typhimurium:molecular sequence analysis of the bifunctional nadR regulator and the nadA-pnuC operon[J].Journal of Bacteriology,1990,172(8):4187-4196.
[7] 张琪.烟酸及其拮抗物对瘤胃发酵参数及乳酸代谢的影响[J].硕士学位论文.南昌:江西农业大学,2014.
[8] 杨耐德.稀土饲料添加剂在动物生产中的应用研究[J].安徽农学通报,2008,14(24):88-89.
[9] 中华人民共和国农业部.NY/T 815—2004 肉牛饲养标准[S].北京:中国农业出版社,2004.
[10] MENKE K H,STEINGASS H.Estimation of the energetic feed value obtained from chemical analysis andinvitrogas production using rumen fluid[J].Animal Research and Development,1988,28:7-15.
[11] 卢德勋.反刍动物营养学发展现代化进程的回顾及其展望[J].饲料工业,2010(增刊1):1-5.
[12] 程茂基.绵羊瘤胃内寡肽的产生、降解、吸收、流通与微生物摄取规律的研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2000:20-22.
[13] 张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003:45-100.
[14] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,1993(6):40-41.
[15] 赵建军,赵旭昌,王哲,等.高效液相色谱法测定瘤胃内容物挥发性脂肪酸和乳酸[J].中国兽医学报,1993(4):393-394.
[16] 王放.瘤胃细菌和原虫蛋白测定方法的初步研究[J].中国畜牧杂志,1990(2):43.
[18] OWENS F N,BERGEN W G.Nitrogen mtabolism of ruminant animals:historical perspective current understanding and future implications[J].Journal of Animal Science,1983,57(Suppl.2):498-518.
[19] LIU Q,WANG C,HUANG Y X,et al.Effects of lanthanum on rumen fermentation,urinary excretion of purine derivatives and digestibility in steers[J].Animal Feed Science and Technology,2008,142(1/2):121-132.
[20] GUILOTEAU P,TOULLEC R,GRONGNET J F,et al.Digestion of milk,fish and soya-bean protein in the preruminant calf:flow of digesta,apparent digestibility at the end of the ileum and amino acid composition of ileal digesta[J].British Journal of Nutrition,1986,55(3):571-592.
[21] 张学峰,瞿明仁,王立阁,等.大豆寡糖对瘤胃发酵的影响及适宜添加量筛选[J].黑龙江畜牧兽医,2008(10):46-47.
[22] SCHAETZEL W P,JOHNSON D E.Nicotinic acid and dilution rate effects oninvitrofermentation efficiency[J].Journal of Animal Science,1981,53(4):1104-1108.
[23] SOLIVA C R,KUNZ C.Preliminary study on the effects of ammonium nicotinate oninvitroruminal fermentation as determined using rumen simulation technique (Rusitec)[J].Animal Production Science,2011,51(3):233-239.
[24] 闵力,瞿明仁,戈婷婷,等.不同功能性寡糖组合对锦江黄牛瘤胃固相微生物多样性的影响[J].江西农业大学学报,2012,34(4):769-774.
[25] 潘龙,卜登攀,程建波,等.烟酸对奶牛瘤胃发酵及缓解热应激的影响[J].中国饲料,2013(7):25-27,31.
[26] OTTOU J F,DOREAU M.Influence of niacin oninvitroruminal fermentation and microbial synthesis depending on dietary factors[J].Animal Feed Science and Technology,1996,58(3/4):187-199.
[27] 高雨飞.高精料日粮条件下烟酸对牛瘤胃微生物区系的影响[D].硕士学位论文.南昌:江西农业大学,2016:32-35.
[28] PINLOCHE E,MCEWAN N,MARDEN J P,et al.The Effects of a probiotic yeast on the bacterial diversity and population structure in the rumen of cattle[J].PLoS One,2013,8(7):e67824.
[29] LENG J,CHENG Y M,ZHANG C Y,et al.Molecular diversity of bacteria in Yunnan yellow cattle (Bostaurs) fromNujiangregion,China[J].Molecular Biology Reports,2012,39(2):1181-1192.
[30] SATOSHI K,YASUO K.Fibrolytic rumen bacteria:their ecology and functions[J].Asian-Australasian Journal of Animal Sciences,2009,22(1):131-138.
[31] WOLIN M J,MILLER T L,STEWART C S.Microbe-microbe interactions[M]//HOBSON P N,STEWART C S,eds.The rumen microbial ecosystem.Dordrecht:Springer Netherlands,1997:467-491.
[32] FONDEVILA M,DEHORITY B A.Interactions between fibrobacter succinogenes,prevotella ruminicola,and ruminococcus flavefaciens in the digestion of cellulose from forages[J].Journal of Animal Science,1996,74(3):678-684.
[33] KUDO H,CHENG K J,COSTERTON J W.Interactions betweenTreponemabryantiiand cellulolytic bacteria in theinvitrodegradation of straw cellulose[J].Canadian Journal of Microbiology,1987,33(3):244-248.
[34] VAN GYLSWYK N O.Succiniclasticumruminisgen nov,sp nov,a ruminal bacterium converting succinate to propionate to propionate as the sole energy-yielding mechanism[J].International Journal of Systematic Bacteriology,1995,45(2):297-300.
[35] VAN GYLSWYK N O,HIPPE H,RAINEY F A.Schwartziasuccinivoransgen.nov.sp.nov.another ruminal bacterium utilizing succinate as the sole energy source[J].International Journal of Systematic Bacteriology,1997,47(1):155-159.
[36] SAWANON S,KOIKE S,KOBAYASH Y.Evidence for the possible involvement of Selenomonas ruminantium in rumen fiber digestion[J].FEMS Microbiology Letters,2011,325(2):170-179.

