一种猪胃肠道内容物与粪便微生物梯度离心分离方法
李金龙 王 瑶 马娅君 陈庆菊 卢昌文 唐志如
(西南大学动物科技学院,生物饲料与分子营养实验室,重庆 400715)
动物肠道内定植着种类繁多和数量庞大的微生物,其数量为1013~1014个[1],构成了一个错综复杂的生态系统。肠道内的微生物对宿主能量代谢、营养物质吸收、机体生理和免疫功能的发挥等方面起着关键性的作用[2-3]。随着分子生物技术的蓬勃发展,众多研究肠道微生物的分子生物学技术不断涌现,如指纹图谱技术[聚合酶链反应-变性梯度凝胶电泳(PCR-DGGE)]、荧光原位杂交技术、实时荧光定量PCR等[4]。然而,如何高效地从动物胃肠道及粪便中将微生物进行分离,是运用生物学技术进行分析检测的前提基础,但目前国内外缺乏从胃肠道内容物和粪便中进行微生物分离的统一标准。因此,本试验旨在摸索猪胃肠道和粪便微生物与分离缓冲液的适宜比例,采用梯度离心法从猪胃肠道内容物和粪便中对微生物进行分离,以寻求胃肠道内容和粪便中微生物的最佳分离条件,为进一步深入研究肠道微生物氮营养素的代谢、内源性氮和氨基酸的组成、微生物区系以及粪便微生物氮和氨基酸排出情况等研究提供方法。
1 材料与方法
1.1 样品来源
试验按照完全随机设计将18头健康的30 kg“杜×长×大”三元生长猪分为3组,每组6头猪。各组分别饲喂12.0%、15.0%和18.0% 3种蛋白质水平的玉米-豆粕型饲粮,饲养30 d,单栏饲养,且自由采食和饮水。试验结束后,每组屠宰6头猪,采用无菌厌氧操作方法分别采集胃、空肠中段、回肠中段、盲肠和结肠中段内容物各50 g,并且收集每组6头猪的肛门粪便,用于微生物菌体分离。
1.2 缓冲液配制
准确称取0.85 g的NaCl溶于1 000 mL双蒸水中,待充分溶解后再加入1 mL吐温-80,然后置于121 ℃高压灭菌锅内灭菌20 min,备用。
1.3 分离方法
微生物分离流程如图1所示,具体流程如下:1)选取1头30 kg的猪屠宰后,无菌收集胃、空肠、回肠、盲肠、结肠内容物和粪便样品,于4 ℃保存,待用。2)分别称取在称取量范围内的胃、空肠、回肠、盲肠、结肠内容物和粪便于无菌50 mL离心管a中,4 ℃、10 000 r/min离心5 min,弃上清。3)向离心管a中加入40 mL分离缓冲液,漩涡混匀仪上剧烈摇匀2~3 min,4 ℃、1 500 r/min离心5 min。4)轻轻将离心管a取出(不能剧烈摇晃),将上清液倒入对应编号的无菌50 mL离心管b中,将装有上清液的离心管b置于离心机中,4 ℃、10 000 r/min离心5 min,弃上清。5)取40 mL分离缓冲液,加入离心管a中,漩涡混匀仪上剧烈摇匀2~3 min(需将沉淀彻底摇散悬浮),4 ℃、1 500 r/min离心5 min,将提取上清液倒入对应编号的无菌离心管b中,将装有上清液的离心管b置于离心机中,4 ℃、10 000 r/min离心5 min,弃上清。6)重复步骤3)、5)各1次。7)倾倒上清液,将沉淀转入无菌2 mL离心管中,-70 ℃保存,待各项指标测定。

图1 微生物分离流程图
1.4 微生物菌体氨基酸检测
准确量取粪便和回肠内容物离心分离后的样品0.8 mL于15 mm×150 mm试管中,向盛有样品的试管中加入0.8 mL、6 mol的盐酸,振荡混匀。用酒精喷灯将试管口下1/3处拉细至4~6 mm,抽真空10 min后封管。再将试管置于(110±10) ℃恒温烘箱中沙浴水解22 h,结束后取出冷却至室温,转移离心。取1 mL滤液于50 mL烧杯中,用60 ℃恒温水浴蒸干滤液,再加入1 mL、0.02 mol的盐酸,用0.22 μm滤膜过滤,然后置于全自动氨基酸分析仪上机分析,并记录测定结果。
1.5 PCR-DGGE检测
取不同稀释比例下分离得到的胃肠道内容物及粪便样品微生物菌体,立即用于微生物DNA提取。扩增的DNA片段为细菌16S rRNA的V3可变区,引物采用357F-GC-clamp、357F和518R引物进行PCR扩增和变性梯度凝胶电泳,其中GC夹子为:5′-CGC CCG GGG CGC GCC CCG GGC GGG GCG GGG GCA CGG GGG GAA CGC GAA GAA CCT TAC-3′, 357F引物序列为:5′-CCT ACG GGA GGC AGC AG-3′,518R引物序列为:5′-ATT ACC GCG GCT GCT GG-3′。电泳采用D-code通用性梯度凝胶电泳(DGGE)系统(Bio-Rad),电泳缓冲液为1×TAE电泳缓冲液(pH 8.0)。点样,升温电泳液至60 ℃,随后在100 V直流电压下电泳19 h。电泳结束后,银染,拍照,保存图片。
1.6 数据统计方法
试验数据采用Excel 2007软件进行整理。采用SAS 9.1.3软件进行单因素方差分析,组间显著性分析采用Duncan氏法进行多重比较,结果以平均值和标准误(SEM)表示。
2 结果与分析
2.1 不同肠道内容物与粪便样品的稀释比例和称取量及其分离程度和菌体干重含量
不同肠道内容物与粪便样品的稀释比例和称取量及其分离程度和菌体干重含量如表1、表2和表3所示。当胃、空肠和回肠内容物样品的称取量分别为5.6、4.8、4.0、3.2 g时,稀释比例分别为14%、12%、10%、8%,菌体干重含量和分离程度依次升高。在不同称取量和稀释比例下,胃内容物微生物分离程度均较高,达99%以上,菌体干重含量可达到1.63 g/kg以上;稀释比例为12%及以下时,空肠、回肠内容物微生物分离程度较高,可达98.0%~99.9%,菌体干重含量分别可达到2.00和2.50 g/kg以上。当盲肠、结肠内容物和粪便的稀释比例由8%降至2%时,样品的称取量由3.2 g降至0.8 g,菌体干重含量和分离程度也依次升高。稀释比例在6%及以下时,盲肠微生物分离程度可达97%以上,可获得的菌体干重含量可达7.04 g/kg以上;稀释比例在6%及以下时,结肠微生物分离程度可达95%以上,菌体干重含量可达15.29 g/kg以上;稀释比例在4%及以下时,粪便微生物分离程度可达98%以上,菌体干重含量可达20.32 g/kg以上。
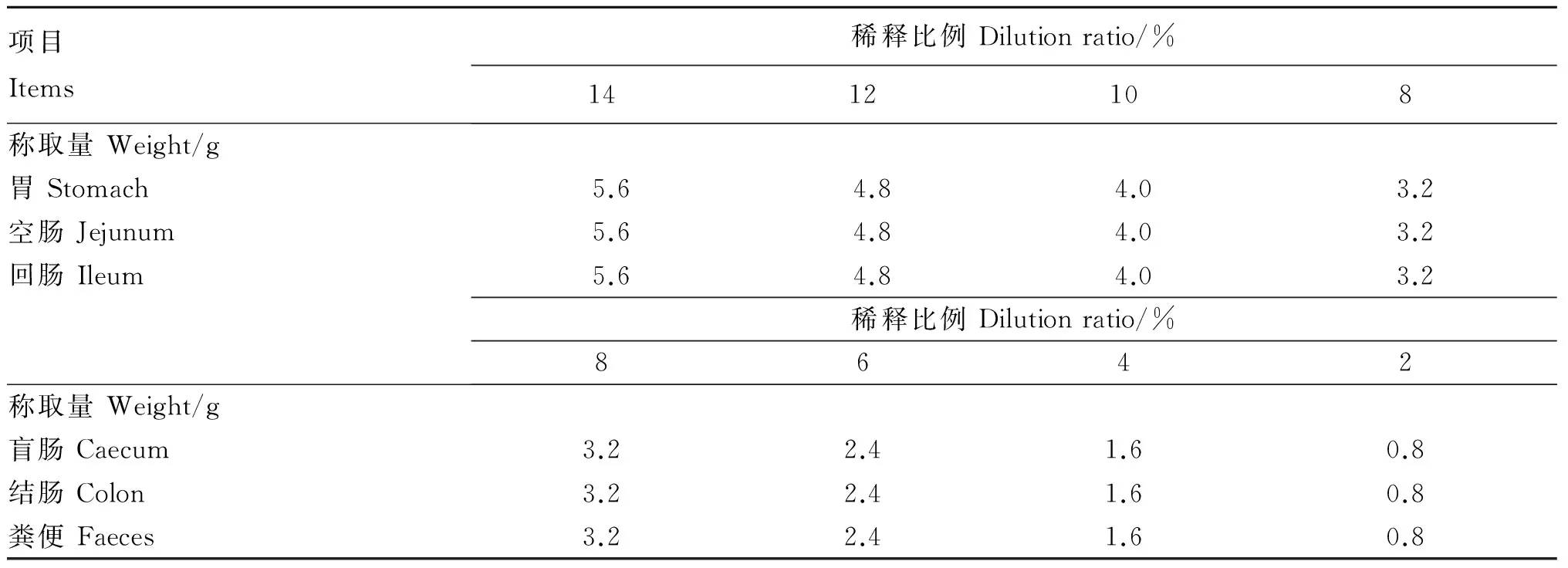
表1 肠道内容物及粪便样品的稀释比例和称取量
2.2 猪回肠内容物和粪便微生物菌体氨基酸组成检测结果
猪回肠内容物和粪便微生物菌体氨基酸组成检测结果如表4和表5所示。结果显示,猪回肠内容物和粪便微生物菌体氨基酸共有17种。其中,猪粪便中微生物菌体氨基酸组成中天冬氨酸(Asp)、丝氨酸(Ser)、丙氨酸(Ala)、脯氨酸(Pro)、半胱氨酸(Cys)、缬氨酸(Val)、异亮氨酸(Ile)、亮氨酸(Leu)、赖氨酸(Lys)、组氨酸(His)和精氨酸(Arg)对饲粮不同蛋白质水平的营养模式响应效果显著(P<0.05),谷氨酸(Glu)、甘氨酸(Gly)、络氨酸(Tyr)、苏氨酸(Thr)、甲硫氨酸(Met)、苯丙氨酸(Phe)对饲粮不同蛋白质水平的营养模式响应效果不显著(P>0.05)。猪回肠内容物中微生物菌体氨基酸组成中Asp、Ser、Glu、Gly、Ala、Pro、Thr、Cys、Val、Met、Ile、Leu、Phe、His和Arg对饲粮不同蛋白质水平的营养模式响应效果显著(P<0.05),仅Tyr和Lys对饲粮不同蛋白质水平的营养模式响应效果不显著(P>0.05)。

表2 不同稀释比例下胃、空肠和回肠内容物样品分离程度及菌体干重含量
1、2代表同一个样品取的平行样。分离程度(%)=100×(鲜样总菌数量-分离后总菌数量)/鲜样总菌数量。菌体干重含量(g/kg)=分离后的菌体干重(g)/鲜样总重(kg)。表3同。
1 and 2 represent parallel samples taking from the same sample. Degree of separation (%)=(the amount of bacteria in fresh sample-the amount of total bacteria after separation)/the amount of bacteria in fresh sample. Content of dry cell weight (g/kg)=the content of dry cell weight after separation (g)/the total weight of fresh sample (kg). The same as Table 3.

表3 不同稀释比例下盲肠、结肠内容物和粪便样品的分离程度及菌体干重含量

续表3项目Items稀释比例Dilutionratio/%8642结肠-1Colon-113.2215.2918.4618.55结肠-2Colon-213.2415.3218.4818.58粪便-1Faeces-113.2516.0020.3220.41粪便-2Faeces-213.2816.0420.3620.45

表4 饲粮不同蛋白质水平对猪粪便微生物菌体氨基酸组成的影响
L-CP:低蛋白质水平(12%);M-CP:中蛋白质水平(15%);H-CP:高蛋白质水平(18%)。同列数据肩标不同小写字母表示差异显著(P<0.05),肩标相同小写字母表示差异不显著(P>0.05)。下表同。
L-CP: low protein level (12%); M-CP: middle protein level (15%); H-CP: high protein level (18%). Values in the same column with different small letter superscripts mean significant difference (P<0.05), while with same small letter superscripts mean no significant difference (P>0.05).The same as below.

表5 饲粮不同蛋白质水平对猪回肠内容物微生物菌体氨基酸组成的影响
2.3 胃肠道内容物和粪便不同稀释比例PCR-DGGE结果
在不同稀释比例下,胃、空肠、回肠、盲肠、结肠内容物和粪便中的微生物组成PCR-DGGE结果如图2所示。提取不同稀释比例后的胃、空肠、回肠、盲肠、结肠内容物和粪便中微生物基因组DNA,再以细菌通用引物进行PCR扩增和变性梯度凝胶电泳。结果显示,PCR-DGGE电泳均能检测出胃、空肠、回肠、盲肠、结肠内容物和粪便不同稀释比例后的DGGE条带,并且条带较清晰和丰富,重复性好。
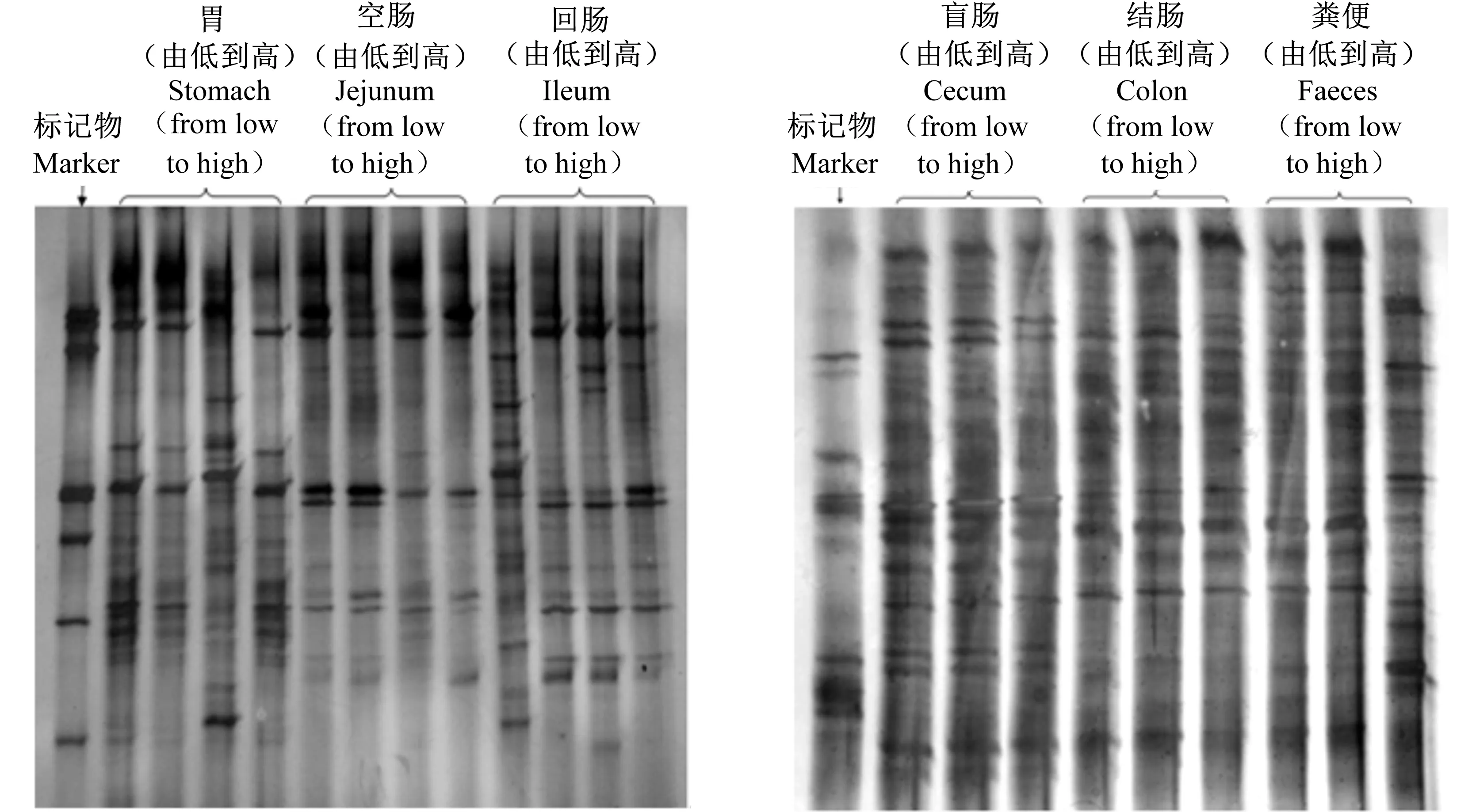
图2 胃肠道内容物和粪便不同稀释比例PCR-DGGE结果
3 讨 论
常规分离培养动物肠道微生物的方法是借助不同种类的培养基或培养液进行培养,再运用生物化学手段对其分离纯化得到微生物,然后用于分析肠道中微生物组成、数量及其特征。但该方法存在一定的局限性,例如肠道中有很多微生物难以培养、大多数厌氧微生物未被鉴定和描述、体外培养的微生物与其在体内生理特征存在差异以及分离技术操作步骤繁琐等因素都会导致无法获取胃肠道菌群的全面信息[5]。有学者通过测定不同稀释菌液的光密度(OD)值,再与平板计数结果和烘干称重结果相对应,建立菌液OD值与菌体干重之间的回归方程,以此来实时测定菌体干重[6-7]。虽然此方法与传统的方法(平板计数法或者比浊法)相比,提高了菌体干重结果准确性,同时也提高了工作效率和降低了生产成本,但胃肠道内容物及粪便中的微生物种类繁多,加之不同微生物分离培养的条件存在差异[5],也局限了该方法的运用。本试验采用梯度离心分离方法对猪胃肠道内容物与粪便中的微生物进行分离。稀释比例在12%及以下时,胃、空肠和回肠内容物的微生物分离程度均较高,达98%以上;稀释比例在4%及以下时,盲肠、结肠内容物以及粪便中的微生物分离程度也可达98%以上,并且在适宜的稀释比例范围下,胃肠道内容物和粪便样品中均可获得较理想的菌体干重。本试验还对分离得到的胃、空肠、回肠、盲肠、结肠内容物和粪便中的微生物进行DGGE分析,结果得到较清晰而丰富的胃肠道内容物中微生物的DGGE条带。此外,本试验选用吐温生理盐水试剂预先处理样品,再通过梯度离心来分离富集微生物,有效地减少了化学试剂的使用。有研究报道,首先将内容物或者粪便与微生物分离,不仅可以有效地排除动物肠道内容物及粪便中许多未消化的食物残渣、消化酶、黏液和多糖(草食动物)等物质对微生物细胞壁破除和高质量微生物总DNA的提取的干扰[8-9],而且也能减少因过多化学试剂的使用导致提取的DNA中试剂残留过多等问题[10]。
本试验对分离得到的3种不同蛋白质水平下猪回肠内容物和粪便微生物的氨基酸组成进行了检测。结果显示,猪回肠内容物和粪便中微生物菌体氨基酸组成共有17种,猪回肠内容物和粪便中微生物菌体氨基酸组成对饲粮不同蛋白质水平的营养模式响应效果存在差异性。其中,猪粪便微生物菌体氨基酸中Asp、Ser、Ala、Pro、Cys、Val、Ile、Leu、Lys、His和Arg对饲粮不同蛋白质水平的营养模式响应更显著。回肠微生物菌体氨基酸中Asp、Ser、Glu、Gly、Ala、Pro、Thr、Cys、Val、Met、Ile、Leu、Phe、His和Arg对饲粮不同蛋白质水平的营养模式也响应显著。此外,本试验分离微生物的方法还能运用于测定猪肠道微生物菌体胞内酶活性和微生物脱羧酶活性[11]。由此可见,运用本试验方法分离得到的微生物可用于多种相关指标的检测。
4 结 论
① 本试验建立的一种猪胃肠道内容物与粪便微生物梯度离心分离方法不仅具有分离程度高,获取菌体干重含量多等优点,而且还具有成本低廉、重复性好、操作简单等特点。
② 本试验方法的建立,可为进一步研究胃肠道中微生物的功能作用提供有效快捷的研究手段。
参考文献:
[1] POWER S E,O’TOOLE P W,STANTON C,et al.Intestinal microbiota,diet and health[J].British Journal of Nutrition,2014,111(3):387-402.
[2] JERNBERG C,LÖFMARL S,EDLUND C,et al.Long-term ecological impacts of antibiotic administration on the human intestinal microbiota[J].ISME Journal,2013,7(2):456.
[3] DAI Z L,WU G,ZHU W Y.Amino acid metabolism in intestinal bacteria:links between gut ecology and host health[J].Frontiers in Bioscience,2011,16(1):1768-1786.
[4] 王保军,刘双江.环境微生物培养新技术的研究进展[J].微生物学通报,2013,40(1):6-17.
[5] 凌泽春,郭立辉,任素芳,等.猪胃肠道微生物菌群的研究现状及调控技术进展[J].家畜生态学报,2011,32(5):5-9.
[6] 李学贵,袁生.微生物转化过程中利用OD值实时监测细菌生物量变化的研究[J].南京师大学报(自然科学版),2003,26(4):90-93.
[7] 马勇,樊永军.用OD值监测产油酵母培养过程中的菌体生物量变化[J].安徽农业科学,2011,39(12):7342-7343,7346.
[8] TANG J N,ZENG Z G,WANG H N,et al.An effective method for isolation of DNA from pig faeces and comparison of five different methods[J].Journal of Microbiological Methods,2008,75(3):432-436.
[9] 赵健元,李进华.对影响哺乳动物粪便DNA提取相关因素的探讨[J].生物学杂志,2008,25(3):5-8.
[10] 吴敏娜,武亚琦,屈艳,等.四种小鼠肠道微生物DNA提取方法比较[J].生态学杂志,2015,34(4):1183-1188.
[11] 赖星,石宝石,刘金艳,等.日粮蛋白水平对生长育肥猪肠道微生物酶活性的影响[J].中国兽医学报,2017,37(2):327-334.

