三丁酸甘油酯对动物生长和肠道屏障功能的影响及其作用机制
郑 欣 徐树德,* 艾庆辉 麦康森
(1.广东溢多利生物科技股份有限公司,珠海 519060;2.中国海洋大学,农业部水产动物营养与饲料重点实验室,教育部海水养殖重点实验室,青岛 266003)
随着集约化畜牧业养殖的扩增,疾病已经成为困扰广大养殖户的一个重大难题。而为了应对抗生素带来的负面效应,欧盟已于2006年1月起全面执行了禁用抗生素的政策[1]。因此,越来越多的研究人员开始了绿色、安全的新型饲料添加剂的研发,并已被广泛应用于生产中。三丁酸甘油酯(tributyrin,TB)是由4个碳原子组成的短链脂肪酸酯,经胃肠道胰脂肪酶的催化,能够被分解为丁酸和甘油,经血液运输后到达各组织器官,然后被吸收利用。相较于丁酸,因其具有脂肪香味、且不易被胃液分解和代谢缓慢等优点,已被广泛应用于畜牧业养殖中。研究报道,TB能够通过维持菊黄东方鲀(Takifuguflavindus)肠道菌群平衡[2]、提高仔猪肠道免疫力[3]和增强建鲤(Cyprinuscarpiovar. Jian)肠道抗氧化损伤功能[4],进而达到促进动物健康生长的作用。因此,本文主要阐述TB在促进动物生长和维持肠道屏障功能方面的作用以及可能的作用机制。
1 TB的理化特性与代谢
1.1 理化特性
3分子丁酸和1分子甘油组成的TB,是一种短链脂肪酸酯,其分子式为C15H26O6,相对分子质量为302.41,是一种无色近油状的液体,具有脂肪的香味。因其具有不溶于水,易溶于乙醚和乙醇等有机溶剂,以及熔点较低和沸点较高的物理特性(熔点:-75 ℃,沸点:305~310 ℃),所以在高温、光照和制粒等条件下,其理化性质基本无变化,适合目前各类饲料加工的生产工艺。
1.2 代谢
丁酸盐在体内代谢过程中极易在胃和小肠的上端被快速吸收,很少进入肠道后端发挥生理效应。而TB不易被胃酸分解,可以顺利通过胃,在肠道中经胰脂肪酶的作用后,可被缓慢分解为丁酸和甘油[5]。一方面,丁酸其极易被结肠黏膜上皮细胞吸收,大部分的丁酸被氧化成酮体,进而合成ATP,为肠道细胞提供能量[6];另一方面,丁酸在丁酸辅酶A合成酶的作用下转化成丁酸辅酶A,然后经过一系列化学反应生成乙酰辅酶A,进而参与β氧化,进行能量代谢[7]。
2 TB对动物生长的作用及其作用机制
2.1 TB促进动物生长
饲粮中添加不同水平的TB能够促进动物的生长,详见表1。在陆生动物上的研究发现,每千克饲粮中添加5 g TB能够使1~28日龄断奶仔猪的平均日增重(ADG)提高13.64%[8];每千克饲粮中添加1 g TB能够使7~21日龄子宫发育迟缓(IUGR)仔猪[3]和断奶仔猪[9]的ADG分别提高237.93%和10.65%;每千克饲粮中添加2 g TB能够使1~42日龄肉鸡[10]和艾维茵肉鸡[11]的ADG分别提高6.47%和6.67%。在水生动物上的研究也同样发现,每千克饲料中添加1 g TB能够使建鲤的增重百分比(PWG)提高13.2%[4];每千克饲料中添加0.1 g TB能够使菊黄东方鲀的PWG提高28.12%[2]。
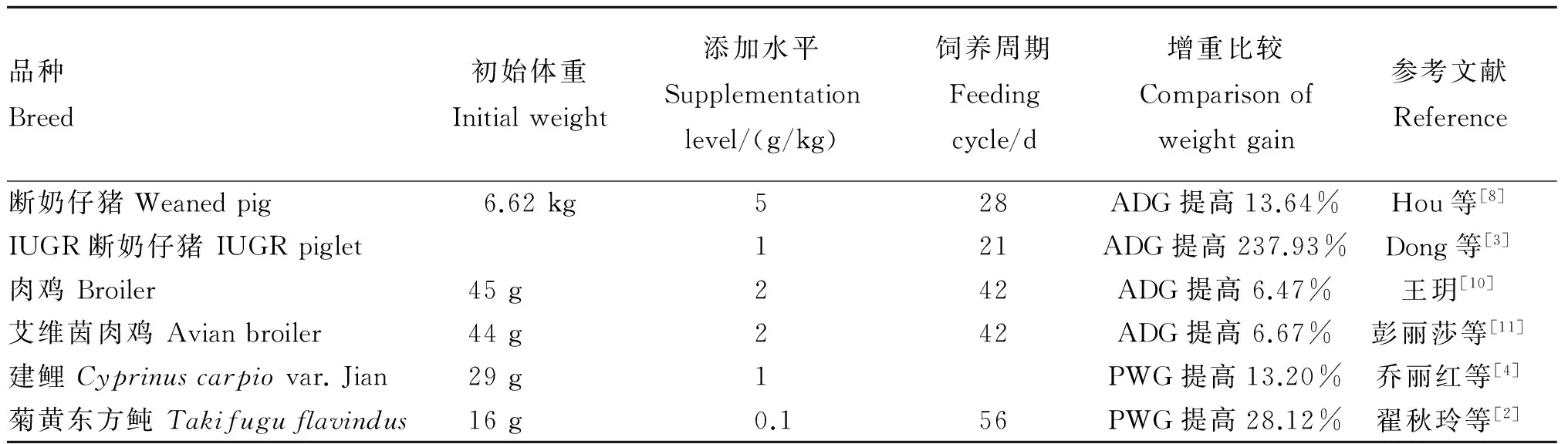
表1 TB对动物生长性能的影响
2.2 TB促进动物生长的可能作用机制
动物的生长与肠道消化营养物质的能力密切相关[12-13]。在猪[14]、鸡[15]以及鱼[16]上的研究显示,淀粉酶、蛋白酶和脂肪酶是重要的消化酶,增加这些酶的活力能够提高动物肠道的消化能力。在猪[3]和菊黄东方鲀[2]上研究的发现,饲粮中添加TB能够增加回肠脂肪酶活力、空肠和回肠胰蛋白酶活力,增加肠道淀粉酶活力。此外,动物肠道的消化能力受到肠道生长发育的调控,而肠道的生长发育与肠绒毛高度和隐窝深度密切相关[17]。研究发现,TB的添加能够增加断奶仔猪回肠绒毛高度[18];增加肉鸡十二指肠和空肠绒毛高度,但对隐窝深度无显著影响[10];增加1~14日龄肉鸡十二指肠和空肠绒毛高度,降低隐窝深度[19];增加菊黄东方鲀前肠和后肠绒毛高度[2];降低脂多糖(LPS)处理后肉鸡回肠的隐窝深度[20]。TB促进动物肠道生长发育进而促生长的机理目前尚不明确,但我们推测可能与其代谢物作为肠道上皮细胞主要能量来源有关。肠道黏膜的快速生长和发育需要有效的能量来源。Macfarlane等[6]报道,丁酸极易被结肠黏膜上皮细胞吸收,进而被氧化成酮体,参与合成ATP,为肠道细胞的生长发育提供能量。
以上资料说明:TB可以通过促进肠道的生长发育,进而提高消化能力,最终发挥促进动物健康生长的作用。
3 TB维持动物肠道屏障功能
肠道既是营养物质消化吸收的重要场所,也是动物抵御外界环境刺激(环境和食物中有毒有害物质、细菌等)的重要屏障。动物的肠道屏障主要包括微生物屏障、物理屏障、化学屏障以及免疫屏障[21]。当动物的肠道屏障功能受到破坏,会导致免疫系统紊乱,进而易遭受病原菌侵袭,最终导致生产性能下降。
3.1 TB维持动物肠道微生物屏障功能
数以亿计的微生物定植在动物的胃肠道内,其含量的变化在维持胃肠道健康稳态方面至关重要[22-23]。外界因素如饲粮组成的变化、生活方式的改变以及环境中有毒有害物质的入侵均会影响肠道微生物的组成,进而打破菌群平衡,引发疾病[24-25]。在肉鸡上的研究发现,饲粮中添加TB能够增加盲肠有益菌乳酸菌数量和减少有害菌大肠杆菌数量[7],增加十二指肠和盲肠乳酸菌数量,降低大肠杆菌数量[10],降低盲肠沙门氏菌数量[19]。TB在水生动物肠道菌群影响上的研究较少,目前仅见1篇在菊黄东方鲀上的报道,该研究发现饲粮中添加TB能够增加肠道需氧异养细菌和乳酸菌数量,降低弧菌数量[2]。TB调节肠道菌群的机理目前尚不明确,但我们推测可能与氢离子的累积导致pH改变有关。研究报道,TB在胰脂肪酶的作用下,可缓慢分解为丁酸和甘油,进入肠道后端的丁酸会被分解为丁酸根离子和氢离子,高浓度的氢离子累积会导致pH降低,进而使得有害菌如大肠菌杆菌和沙门氏菌等死亡,而有益菌如乳酸杆菌,因其耐酸性则可大量增殖,进而调整肠道菌群的组成[26]。
以上资料说明:TB可以通过增加有益菌数量和降低有害菌数量来调节肠道菌群组成,进而维持动物肠道的微生物屏障功能。
3.2 TB维持动物肠道物理屏障功能
动物肠道的物理屏障功能与上皮细胞间的紧密连接密切相关[21]。紧密连接是由多种蛋白组成的复合体,主要包括跨膜蛋白(claudin家族和occludin)和细胞质蛋白[紧密连接蛋白(ZOs)],在维持肠道黏膜上皮细胞的极性以及调节肠道屏障的通透性方面发挥着重要作用[27]。增加ZOs的表达,可以增强细胞间紧密连接的形成,进而可以阻止细菌、毒素等大分子进入体内,维持肠道的物理屏障功能[28]。研究报道,饲料中添加TB能够增强小鼠回肠和结肠ZO-1和occludin的蛋白表达[29]。而饲料中丁酸钠的添加也能增加金头鲷(Sparusaurata)前肠occludin的基因表达[30]和肉鸡肠道claudin-1和occludin的基因表达[31]。
以上资料说明:TB可以通过促进ZOs的表达,进而维持细胞间的紧密连接,加强动物肠道的物理屏障功能。
3.3 TB维持动物肠道化学屏障功能
动物肠道的化学屏障主要由覆盖在肠道上皮的黏液层组成[21]。黏蛋白(mucin,Muc)是存在于黏液层中最主要的分子,是由专门的上皮细胞分泌的,能够阻止大分子物质(如细菌、毒素等)进入上皮细胞层[32]。研究报道,饲料中添加丁酸钠能够增加金头鲷肠道Muc13和Muc2的基因表达[30]、增加草鱼肠道[33]和肉鸡[31]肠道中Muc2的基因表达。而三丁酸甘油酯的酶解产物——丁酸,其能够增加小鼠结肠中Muc1、Muc2、Muc3和Muc4的基因表达[34]。
以上资料说明:TB可以通过促进Muc的分泌,加强动物肠道的化学屏障功能。
3.4 TB维持动物肠道免疫屏障功能
3.4.1 TB增强动物肠道的免疫力
动物免疫力的发挥依赖于一系列免疫物质,如补体因子、免疫球蛋白和抗菌肽等[35]。Zhang等[36]的研究发现,增加草鱼肠道补体因子3(C3)和补体因子4(C4)的含量以及上调抗菌肽铁调素(hepcidin)和β-防御素(β-defensin)的基因表达能够增强草鱼的免疫力。研究表明,饲粮中添加TB能够增加IUGR仔猪回肠免疫球蛋白G(IgG)的基因表达、回肠分泌型免疫球蛋白A(sIgA)和IgG含量[3]、增加断奶仔猪血清免疫球蛋白A(IgA)、免疫球蛋白M(IgM)和IgG含量[9];饲粮中添加丁酸钠能够增加仔猪血清C3、IgG和IgM含量以及肠道黏膜浆细胞IgA+含量[37],增加断奶仔猪血清IgG和空肠IgA+含量[38],增加草鱼肠道溶菌酶(LZ)和酸性磷酸酶(ACP)活力、C3和C4含量、hepcidin和β-defensin 1的基因表达[33]。此外,饲粮中添加丁酸还能够增加小鸡空肠和回肠cathelicidin B1、β-defensin 9和β-defensin 14的基因表达[39]。TB调节肠道免疫物质的机理可能与其促进免疫细胞的生长有关。研究报道,动物体内含有大量与黏膜相关的淋巴组织,其中含有丰富的免疫细胞,如淋巴细胞、巨噬细胞、中性粒细胞和嗜酸性粒细胞等[40]。免疫细胞能够分泌LZ、补体因子和免疫球蛋白等免疫物质[41-44]。在鼠和猪上的研究发现,TB能够增加鼠肠道巨噬细胞和T细胞数量以及盲肠单核细胞和B细胞数量[45],增加猪血液淋巴细胞和中性粒细胞数量[46]。在肉鸡上的研究发现,饲粮中丁酸盐的添加能够增加十二指肠、空肠和回肠肥大细胞、淋巴细胞和杯状细胞[47]以及小肠肥大细胞的数量[48]。
3.4.2 TB通过缓解炎症反应增强动物肠道的免疫力
研究显示缓解肠道炎症反应能够增强动物的免疫力[36]。Wang等[49]报道,炎症反应主要由一系列细胞因子介导,包括促炎和抗炎细胞因子。已有研究表明,促炎细胞因子含量的升高和抗炎细胞因子含量的降低能够加剧炎症反应,进而破坏肠道健康稳态[33,50]。在葡聚糖硫酸钠(DSS)诱导的鼠肠炎模型中,TB能够增加转化生长因子-β(TGF-β)和白介素-10(IL-10)的含量[45]。Li等[20]用LPS诱导肉鸡肠道损伤,再用添加TB的饲粮进行饲喂,发现其能够降低十二指肠和空肠中白介素-1β(IL-1β)和白介素-6(IL-6)的含量,降低回肠中IL-1β的含量。给小鼠长期投喂高脂饲粮后,TB的再添加能够降低巨噬细胞肿瘤坏死因子-α(TNF-α)、IL-1β和IL-6的含量[51]。张勇等[9]在断奶仔猪上的研究发现TB能够增加血清中白介素-2(IL-2)的含量。此外,丁酸钠能够降低草鱼肠道TNF-α、干扰素-γ2(IFN-γ2)、IL-6和IL-8,增加白介素-4/13A(IL-4/13A)和白介素-4/13B(IL-4/13B)的基因表达[33];降低鲤鱼肠道IL-1β和TNF-α,增加TGF-β1的基因表达[1]。在人外周血单核细胞中的研究发现丁酸能够抑制LPS诱导的肿瘤坏死因子(TNF)的产生,降低TNF-α、TNF-β和IL-6的基因表达[52]。TB抑制肠道炎症反应的机理可能与核转录因子-κB(NF-κB)信号途径有关。NF-κB在调控炎症细胞因子的表达中发挥重要作用[53]。抑制NF-κB能够下调促炎细胞因子IL-6和IL-8[54]和上调抗炎细胞因子TGF-β和IL-10的基因表达[55]。在人外周血单核细胞[52]和鼠中性粒细胞上[56]的研究发现丁酸能够抑制LPS诱导的NF-κB核转录。此外,IκB激酶(IKK)能够通过磷酸化核因子κB抑制蛋白(IκBα),进而使其与NF-κB解离,NF-κB得以转录入核,调控下游靶基因的表达[57]。研究发现丁酸能够促进Caco-2细胞[58]和HT-29细胞[59]中IκBα的磷酸化。Tian等[33]研究发现丁酸钠能够降低草鱼肠道中IKKβ和IKKγ以及上调IκBα的基因表达。以上资料说明,TB可以通过抑制NF-κB的核转录,进而降低促炎细胞因子的表达,增加抗炎细胞因子的表达,缓解动物肠道炎症反应。
3.4.3 TB通过提高抗氧化损伤功能增强动物肠道的免疫力
研究发现氧化应激会破坏动物肠道的免疫力[50]。丙二醛(MDA)含量的变化是评判脂质过氧化的敏感指标[60]。饲粮中添加TB能够降低IUGR仔猪肝脏MDA含量[61],能够降低肉鸡十二指肠、空肠和回肠MDA含量[20]。此外,Zhang等[62]报道,动物机体为了抵御氧化应激,形成了自身的抗氧化系统,主要包括一系列酶性抗氧化物质和非酶性抗氧化物质。在IUGR仔猪上的研究发现TB能够增加肝脏超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、还原型谷胱甘肽(GSH)活力和总抗氧化能力(T-AOC)以及肝脏线粒体锰-超氧化物歧化酶(Mn-SOD)活力[61]。Leonel等[45]在DSS诱导的肠炎模型中发现TB能够增加SOD和过氧化氢酶(CAT)活力,降低氢过氧化物含量。在肉鸡上的研究发现,TB能够增加十二指肠、空肠和回肠CAT以及空肠GPx活力[20]。灌注100 mmol/L的丁酸能够增加人结肠黏膜中GSH含量[63]。TB提高肠道抗氧化损伤的作用机理可能与抗氧化基因表达水平的升高有关。Song等[50]研究报道,抗氧化酶的活力部分依赖于抗氧化酶的基因表达,其受到信号途径Kelch绑定蛋白1(Keap1)/核因子相关因子2(Nrf2)的调控。研究报道,丁酸能够增加金头鲷肠道谷胱甘肽还原酶(GR)的基因表达[30],能够增加人肺癌细胞谷胱甘肽硫转移酶P1(GSTP1)的基因表达[64],增加人结肠黏膜GPx1、GPx3和GR的基因表达[63,65],增加人结肠癌细胞GSTP1、GSTA4、GSTM2和GSTM5的基因表达[66],增加Caco-2细胞GSTA1和GSTA2的基因表达[67];丁酸钠能够抑制RAW264.7细胞中Keap1的表达[68],能够促进IEC-6细胞[69]和HepG2细胞[70]中Nrf2的入核。
以上资料说明:TB一方面可以通过抑制NF-κB的转录激活进而调控细胞因子的表达,缓解炎症反应;另一方面可以通过促进Nrf2信号途径,上调抗氧化酶GST等的基因表达进而增加抗氧化酶活力,缓解氧化损伤,共同达到增强动物肠道免疫屏障的作用。
4 小 结
以上资料表明:饲粮中添加TB可以通过提升肠道消化能力、改善菌群平衡、增强紧密连接、促进Muc分泌、提高免疫力,进而增强肠道屏障功能,最终达到促进动物生长的目的。TB提升肠道消化能力与增加淀粉酶、蛋白酶和脂肪酶等消化酶的活力和促进肠道绒毛生长发育有关;增强微生物屏障功能与促进有益菌如乳酸菌生长和抑制有害菌如大肠杆菌生长有关;增强物理屏障功能与增加肠道ZOs的表达,维持细胞间的紧密连接有关;增强化学屏障功能与增加肠道Muc的分泌有关;增强免疫屏障功能与抑制NF-κB信号途径缓解炎症反应和促进Nrf2信号途径增强抗氧化损伤能力有关。TB作为一种新型、绿色的饲料添加剂已经受到广泛关注,具有广阔的市场应用前景。但目前的研究仅局限在仔猪、肉鸡和部分水产动物上,研究不够系统和深入,有待进一步开展相关研究。
参考文献:
[1] LIU W S,YANG Y O,ZHANG J L,et al.Effects of dietary microencapsulated sodium butyrate on growth,intestinal mucosal morphology,immune response and adhesive bacteria in juvenile common carp (Cyprinuscarpio) pre-fed with or without oxidised oil[J].British Journal of Nutrition,2014,112(1):15-29.
[2] 翟秋玲,张春晓,孙云章等.三丁酸甘油酯和甘露寡糖对菊黄东方鲀生长性能、体组成及肠道健康指标的影响[J].动物营养学报,2014,26(8):2197-2208.
[3] DONG L,ZHONG X,HE J T,et al.Supplementation of tributyrin improves the growth and intestinal digestive and barrier functions in intrauterine growth-restricted piglets[J].Clinical Nutrition,2016,35(2):399-407.
[4] 乔丽红,洑琴,温超,等.三丁酸甘油酯对建鲤生长、体组成、肠道免疫功能的影响[J].江苏农业科学,2014,42(12):275-278.
[5] HAMER H M,JONKERS D,VENEMA K,et al.Review article:the role of butyrate on colonic function[J].Alimentary Pharmacology & Therapeutics,2008,27(2):104-119.
[6] MACFARLANE G T,MACFARLANE S.Fermentation in the human large intestine:its physiologic consequences and the potential contribution of prebiotics[J].Journal of Clinical Gastroenterology,2011,45(Suppl.):S120-S127.
[7] ROEDIGER W E W.Famine,fiber,fatty Acids,and failed colonic absorption:does fiber fermentation ameliorate diarrhea?[J].Journal of Parenteral and Enteral Nutrition,1994,18(1):4-8.
[8] HOU Y Q,LIU Y L,HU J,et al.Effects of lactitol and tributyrin on growth performance,small intestinal morphology and enzyme activity in weaned pigs[J].Asian-Australasian Journal of Animal Sciences,2006,19(10):1470-1477.
[9] 张勇,王萌,李方方等.三丁酸甘油酯和牛至油对断奶仔猪生长性能、血清生化指标和营养物质表观消化率的影响[J].动物营养学报,2016,28(9):2786-2794.
[10] 王玥.三丁酸甘油酯对肉鸡生长效果及其安全性评价[D].硕士学位论文.杭州:浙江大学,2012.
[11] 彭丽莎,孙健栋,史艳云,等.三丁酸甘油酯对肉鸡生长性能、养分表观消化率、屠宰性能、肠道形态及微生物菌群的影响[J].动物营养学报,2014,26(2):466-473.
[12] HABTE-TSION H M,REN M C,LIU B,et al.Threonine affects digestion capacity and hepatopancreatic gene expression of juvenile blunt snout bream (Megalobramaamblycephala)[J].British Journal of Nutrition,2015,114(4):533-543.
[14] XU Z R,ZOU X T,HU C H,et al.Effects of dietary fructooligosaccharide on digestive enzyme activities,intestinal microflora and morphology of growing pigs[J].Asian-Australasian Journal of Animal Sciences,2002,15(12):1784-1789.
[15] XU Z R,HU C H,XIA M S,et al.Effects of dietary fructooligosaccharide on digestive enzyme activities,intestinal microflora and morphology of male broilers[J].Poultry Science,2003,82(6):1030-1036.
[16] HE W,ZHOU X Q,FENG L,et al.Dietary pyridoxine requirement of juvenile Jian carp (Cyprinuscarpiovar.Jian)[J].Aquaculture Research,2009,15(4):402-408.
[17] KROGDAHL Å,BAKKE-MCKELLEP A,BAEVERFJORD G.Effects of graded levels of standard soybean meal on intestinal structure,mucosal enzyme activities,and pancreatic response in Atlantic salmon (SalmosalarL.)[J].Aquaculture Nutrition,2003,9(6):361-371.
[18] 胡杰.几种物质对早期断奶仔猪生长性能、肠道结构与功能及血液指标的影响[D].硕士学位论文.武汉:华中农业大学,2004.
[19] 曹阳.三丁酸甘油酯对肉鸡生产性能和肠道发育影响的研究[D].硕士学位论文.泰安:山东农业大学,2016.
[20] LI J L,HOU Y Q,YI D,et al.Effects of Tributyrin on intestinal energy status,antioxidative capacity and immune response to lipopolysaccharide challenge in broilers[J].Asian-Australasian Journal of Animal Sciences,2015,28(12):1784-1793.
[21] 呙于明,刘丹,张炳坤.家禽肠道屏障功能及其营养调控[J].动物营养学报,2014,26(10):3091-3100.
[22] SERINO M,LUCHE E,CHABO C,et al.Intestinal microflora and metabolic diseases[J].Diabetes & Metabolism,2009,35(4):262-272.
[23] ROUND J L,MAZMANIAN S K.The gut microbiota shapes intestinal immune responses during health and disease[J].Nature Reviews Immunology,2009,9(5):313-323.
[24] SONNENBURG E D,SMITS S A,TIKHONOV M,et al.Diet-induced extinctions in the gut microbiota compound over generations[J].Nature,2016,529(7585):212-215.
[25] MIMA K,OGINO S,NAKAGAWA S,et al.The role of intestinal bacteria in the development and progression of gastrointestinal tract neoplasms[J].Surgical Oncology,2017,26(4):368-376.
[26] GUILLOTEAU P,MARTIN L,EECKHAUT V,et al.From the gut to the peripheral tissues:the multiple effects of butyrate[J].Nutrition Research Reviews,2010,23(2):366-384.
[27] CAMILLERI M,MADSEN K,SPILLER R,et al.Intestinal barrier function in health and gastrointestinal disease[J].Neurogastroenterology & Motility,2012,24(6):503-512.
[28] XU J,WU P,JIANG W D,et al.Optimal dietary protein level improved growth,disease resistance,intestinal immune and physical barrier function of young grass carp (Ctenopharyngodonidella)[J].Fish & Shellfish Immunology,2016,55:64-87.
[29] CRESCI G,NAGY L E,GANAPATHY V.LactobacillusGG and tributyrin supplementation reduce antibiotic-induced intestinal injury[J].Journal of Parenteral and Enteral Nutrition,2013,37(6):763-774.
[30] ESTENSORO I,BALLESTER-LOZANO G,BENEDITO-PALOS L,et al.Dietary butyrate helps to restore the intestinal status of a marine teleost (Sparusaurata) fed extreme diets low in fish meal and fish oil[J].PLoS One,2016,11(11):e0166564.
[31] SONG B C,LI H X,WU Y Y,et al.Effect of microencapsulated sodium butyrate dietary supplementation on growth performance and intestinal barrier function of broiler chickens infected with necrotic enteritis [J].Animal Feed Science and Technology,2017,232:6-15.
[32] JOHANSSON M E V,PHILLIPSON M,PETERSSON J,et al.The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria[J].Proceedings of The National Academy of Sciences of the United States of America,2008,105(39):15064-15069.
[33] TIAN L,ZHOU X Q,JIANG W D,et al.Sodium butyrate improved intestinal immune function associated with NF-κB and p38MAPK signalling pathways in young grass carp (Ctenopharyngodonidella)[J].Fish & Shellfish Immunology,2017,66:548-563.
[34] GAUDIER E,RIVAL M,BUISINE M P,et al.Butyrate enemas upregulateMucgenes expression but decrease adherent mucus thickness in mice colon[J].Physiological Research,2009,58(1):111-119.
[35] NI P J,JIANG W D,WU P,et al.Dietary low or excess levels of lipids reduced growth performance,and impaired immune function and structure of head kidney,spleen and skin in young grass carp (Ctenopharyngodonidella) under the infection ofAeromonashydrophila[J].Fish & Shellfish Immunology,2016,55:28-47.
[36] ZHANG L,FENG L,JIANG W D,et al.Vitamin A deficiency suppresses fish immune function with differences in different intestinal segments:the role of transcriptional factor NF-κB and p38 mitogen-activated protein kinase signalling pathways[J].British Journal of Nutrition,2017,117(1):67-82.
[37] 钮海华.丁酸钠对断奶仔猪生长、免疫及肠道功能的影响及其机理研究[D].硕士学位论文.杭州:浙江大学,2010.
[38] FANG C L,SUN H,WU J,et al.Effects of sodium butyrate on growth performance,haematological and immunological characteristics of weanling piglets[J].Journal of Animal Physiology and Animal Nutrition,2014,98(4):680-685.
[39] SUNKARA L T,ACHANTA M,SCHREIBER N B,et al.Butyrate enhances disease resistance of chickens by inducing antimicrobial host defense peptide gene expression[J].PLoS One,2011,6(11):e27225.
[40] REBL A,KORYTT,KÖBIS J M,et al.Transcriptome profiling reveals insight into distinct immune responses toAeromonassalmonicidain gill of two rainbow trout strains[J].Marine Biotechnology,2014,16(3):333-348.
[41] TRICHET V V.Nutrition and immunity:an update[J].Aquaculture Research,2010,41(3):356-372.
[42] DEZFULI B S,BOSI G,DEPASQUALE J A,et al.Fish innate immunity against intestinal helminths[J].Fish & Shellfish Immunology,2016,50:274-287.
[43] KOENDERMAN L,BUURMAN W,DAHA M R.The innate immune response[J].Immunology Letters,2014,162(2):95-102.
[44] CASTRO R,TAFALLA C.Overview of fish immunity[M]//BECK B H,PEATMAN E.Mucosal health in aquaculture.Amsterdam:Academic Press,2015:3-54.
[45] LEONEL A J,TEIXEIRA L G,OLIVEIRA R P,et al.Antioxidative and immunomodulatory effects of tributyrin supplementation on experimental colitis[J].British Journal of Nutrition,2013,109(8):1396-1407.
[46] HOU Y Q,WANG L,YI D,et al.Dietary supplementation with tributyrin alleviates intestinal injury in piglets challenged with intrarectal administration of acetic acid[J].British Journal of Nutrition,2014,111(10):1748-1758.
[47] 王继凤,李芙燕,陈耀星,等.丁酸钠对肉鸡小肠黏膜免疫相关细胞的影响[J].动物营养学报,2008,20(4):469-474.
[48] 李芙燕,陈耀星,王子旭,等.三种饲料添加剂对肉鸡小肠肥大细胞数量分布的影响[J].动物医学进展,2006,27(2):65-68.
[49] WANG T H,SECOMBES C J.The cytokine networks of adaptive immunity in fish[J].Fish & Shellfish Immunology,2013,35(6):1703-1718.
[50] SONG Z X,JIANG W D,LIU Y,et al.Dietary zinc deficiency reduced growth performance,intestinal immune and physical barrier functions related to NF-κB,TOR,Nrf2,JNK and MLCK signaling pathway of young grass carp (Ctenopharyngodonidella)[J].Fish & Shellfish Immunology,2017,66:497-523.
[51] VINOLO M A R,RODRIGUES H G,FESTUCCIA W T,et al.Tributyrin attenuates obesity-associated inflammation and insulin resistance in high-fat-fed mice[J].American Journal of Physiology:Endocrinology and Metabolism,2012,303(2):E272-E282.
[52] SEGAIN J,DE LA BLÉTIRE D R,BOURREILLE A,et al.Butyrate inhibits inflammatory responses through NFκB inhibition:implications for Crohn’s disease[J].Gut,2000,47(3):397-403.
[53] LI Q T,VERMA I M.NF-κB regulation in the immune system[J].Nature Reviews Immunology,2002,2(10):725-734.
[54] GEORGANAS C,LIU H T,PERLMAN H,et al.Regulation ofIL-6 andIL-8 expression in rheumatoid arthritis synovial fibroblasts:the dominant role for NF-κB but not C/EBPβ or c-Jun[J].The Journal of Immunology,2000,165(12):7199-7206.
[55] TAHER Y A,VAN ESCH B C,HOFMAN G A,et al.1α,25-dihydroxyvitamin D3potentiates the beneficial effects of allergen immunotherapy in a mouse model of allergic asthma:role for IL-10 and TGF-β[J].The Journal of Immunology,2008,180(8):5211-5221.
[56] VINOLO M A R,RODRIGUES H G,HATANAKA E,et al.Suppressive effect of short-chain fatty acids on production of proinflammatory mediators by neutrophils[J].The Journal of Nutritional Biochemistry,2011,22(9):849-855.
[57] PUEL A,PICARD C,KU C L,et al.Inherited disorders of NF-κB-mediated immunity in man[J].Current Opinion in Immunology,2004,16(1):34-41.
[58] WENG M Q,WALKER W A,SANDERSON I R.Butyrate regulates the expression of pathogen-triggered IL-8 in intestinal epithelia[J].Pediatric Research,2007,62(5):542-546.
[59] YIN L,LAEVSKY G,GIARDINA C.Butyrate suppression of colonocyte NF-κB activation and cellular proteasome activity[J].Journal of Biological Chemistry,2001,276(48):44641-44646.
[60] LYKKESFELDT J,SVENDSEN O.Oxidants and antioxidants in disease:oxidative stress in farm animals[J].The Veterinary Journal,2007,173(3):502-511.
[61] 何进田,董丽,白凯文,等.三丁酸甘油酯对宫内发育迟缓哺乳仔猪肝脏抗氧化和线粒体功能的影响[J].食品科学,2016,37(3):191-196.
[62] ZHANG W B,CHEN Q Y,MAI K S,et al.Effects of dietary α-lipoic acid on the growth and antioxidative responses of juvenile abaloneHaliotisdiscushannaiIno[J].Aquaculture Research,2010,41(11):781-787.
[63] HAMER H M,JONKERS D M A E,BAST A,et al.Butyrate modulates oxidative stress in the colonic mucosa of healthy humans[J].Clinical Nutrition,2009,28(1):88-93.
[64] JOSEPH J,MUDDULURU G,ANTONY S,et al.Expression profiling of sodium butyrate (NaB)-treated cells:identification of regulation of genes related to cytokine signaling and cancer metastasis by NaB[J].Oncogene,2004,23(37):6304-6315.
[65] VANHOUTVIN S A,TROOST F J,HAMER H M,et al.Butyrate-induced transcriptional changes in human colonic mucosa[J].PLoS One,2009,4(8):e6759.
[66] POOL-ZOBEL B L,SELVARAJU V,SAUER J,et al.Butyrate may enhance toxicological defence in primary,adenoma and tumor human colon cells by favourably modulating expression of glutathione S-transferases genes,an approach in nutrigenomics[J].Carcinogenesis,2005,26(6):1064-1076.
[67] RUSSO I,LUCIANI A,DE CICCO P,et al.Butyrate attenuates lipopolysaccharide-induced inflammation in intestinal cells and croh’s mucosa through modulation of antioxidant defense machinery[J].PLoS One,2012,7(3):e32841.
[68] WANG B,ZHU X L,KIM Y T,et al.Histone deacetylase inhibition activates transcription factor Nrf2 and protects against cerebral ischemic damage[J].Free Radical Biology and Medicine,2012,52(5):928-936.
[69] YAKU K,ENAMI Y,KURAJYO C,et al.The enhancement of phase 2 enzyme activities by sodium butyrate in normal intestinal epithelial cells is associated with Nrf2 and p53[J].Molecular and Cellular Biochemistry,2012,370(1/2):7-14.
[70] ENDO H,NIIOKA M,KOBAYASHI N,et al.Butyrate-producing probiotics reduce nonalcoholic fatty liver disease progression in rats:new insight into the probiotics for the gut-liver axis[J].PLoS One,2013,8(5):e63388.

