不同菌种(G+,G-)所致脓毒症患者凝血系统功能评价
赵延辉,陈雪阳,许 航
调查显示,全球每年住院患者约有25%死于感染,不及时或不当的感染诊断治疗所造成的严重脓毒症/脓毒性休克患者病死率高达80%[1-3]。临床上脓毒症是指机体受到明确病原微生物感染后所引起的全身炎性反应综合征(systemic inflammatory response syndrome,SIRS),如得不到及时有效的治疗可发展成严重脓毒症,多器官功能衰竭(multiple organ failure,MOF)及脓毒性休克[4]。凝血功能异常伴随整个脓毒症病程,特别是凝血激活亢进,极易引起全身弥散性血管内凝血(disseminated or diffuse intravascular coagulation,DIC),进而导致机体凝血功能障碍等[5,6]。目前,关于不同菌种(G+,G-)所致脓毒症患者凝血系统功能评价文献鲜有报道,为此本研究收集新疆石河子大学第一附属医院急诊重症监护室(intensive care unit,ICU)及重症医学科收治的细菌感染脓毒症患者62例的临床资料,旨在通过监测细菌感染脓毒症患者凝血功能指标的变化,为临床上脓毒症早期应用抗生素治疗提供新的参考依据。
1 资料与方法
1.1资料按照资料筛选标准,收集我院2016-10至2017-07收治的已明确诊断为脓毒症且临床资料完整的62例患者的临床资料为研究对象,其中女28例,男34例,平均年龄(65.79±14.17)岁。根据痰标本培养和血培养结果将其分为革兰阳性球菌(gram-positive bacteria,G+)组(n=28)和革兰阴性杆菌(gram-negative bacteria,G-)组(n=34),分组标准:(1)诊疗过程中血培养连续2次提示同种致病菌者;(2)连续2次痰培养提示同种致病菌者;(3)当血培养与痰培养结果不一致时,以有效血培养所得菌种为致病菌。另选同时期来我院体检的30例非感染但有其他基础疾病者为对照组,即非感染患者无任何感染指征,观察期间未使用抗生素,病情平稳。
1.2细菌感染脓毒症患者资料筛选标准 纳入标准:(1)脓毒症3.0标准明确诊断脓毒症,序贯器官衰竭评分(sepsis-related organ failure assessment,SOFA)≥2分者[7];(2)可通过细菌培养得到致病菌者。排除标准:(1)感染发生之前存在各种脏器功能不全者;(2)良、恶性肿瘤病史,免疫功能缺陷、应用免疫药物治疗者;(3)连续2次痰培养、血培养均阴性者;(4)连续2次血培养阴性并多次痰培养出现不同菌种者;(5)妊娠或哺乳期妇女。
1.3方法所有标本取材均按微生物技术学的标准,操作遵循卫生部医政司《全国临床检验操作规程(第4版)》[8]。
1.3.1痰标本收集由经过专门培训的两名护士于每日清晨同一时间点收集痰标本,每名护士将取得的痰液标本分成两份,一份痰涂片筛查,另一份行痰培养,两名护士收集的痰液均送检,痰培养结果相同者可视作致病菌。任何可疑污染的标本均未送检,连续送检3 d结果为同一细菌视作致病菌。情况允许者,推荐痰液收集方式依次为:纤维支气管镜>肺泡灌洗>吸引器中段位置集痰器,为防止口腔定植菌污染,不采用患者深咳痰液。分离菌株鉴定采用法国生物梅里埃公司VITEK微生物鉴定系统,药敏应用K-B纸片扩散法,按美国临床实验室标准化委员会(national committee for clinical laboratory,NCCLS)(2002年版)标准进行[4]。
注意事项:入院时在抗生素应用前采集痰标本;送检时间最好在0.5 h内,不得超过2 h;延迟送检或待处理标本应置于4 ℃冰箱保存。
1.3.2血培养标本收集由专门培训的固定护士在脓毒症患者入住ICU时行常规采集、运送血培养标本,检验科采用全自动血培养仪进行血细菌培养。血培养次数和采血时间:采血培养应尽量在使用抗生素之前,在24 h内采集2~3次做血培养(一次静脉采血注入到多个培养瓶中视为单份血培养),每次采集2份。采血部位:通常为肘静脉,疑为细菌性心内膜炎时以肘动脉或股动脉采血为宜,切忌在静滴抗生素的静脉处采血。若疑有导管相关的血流感染时,不宜从留置静脉或动脉导管取血。采血量:成人8~10 ml,儿童1~5 ml;血培养时血液和肉汤之比为 1∶5~1∶10。
注意事项:严格执行皮肤消毒程序、培养瓶消毒程序、静脉穿刺和培养瓶接种程序。
1.4观察指标(1)一般资料:收集三组的年龄、性别、基础疾病情况。(2)凝血功能指标:收集凝血功能四项[凝血酶原时间(prothrombintime,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)和纤维蛋白原(fibrinogen,FIB)] 及血小板计数(platelet count,PLT)、D-二聚体(D-Dimer,D-D)、抗凝血酶Ⅲ(Antithrombin Ⅲ,AT Ⅲ)检测数据,按试剂盒说明操作。
1.5统计学处理采用SPSS 19.0统计软件进行数据处理,计量资料以x±s表示,三组间比较时采用单因素方差分析,进一步两两比较采用LSD-t检验;计数资料以频数和构成比表示,组间比较采用Pearsonχ2检验。以双侧P<0.05为差异有统计学意义。
2 结 果
2.1一般资料三组在性别、年龄、基础疾病(冠心病、糖尿病、高血压、慢性阻塞性肺病及其他)方面比较,差异均无统计学意义(P>0.05,表1),具有可比性。
2.2致病菌分析62例脓毒症患者中,G+感染45.2%(28/62),其中金黄色葡萄球菌39.3%、耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)28.6%、肺炎链球菌21.4%;G-感染54.8%(34/62),其中大肠埃希菌35.3%、铜绿假单胞菌23.6%、鲍曼不动杆菌14.7%,见表2。
2.3凝血功能分析 三组患者凝血功能四项(PT、APTT、TT、FIB)及PLT、D-D、AT Ⅲ指标比较,差异均具有统计学意义(P<0.001);进一步两两比较显示,与对照组比较,G-菌组和G+菌组血液中PLT、FIB和AT Ⅲ水平均显著降低,而PT、APTT和TT时间明显延长,D-D水平显著升高,差异均具有统计学意义(P<0.001);与G+菌组比较,G-菌组血液中PLT、FIB和AT Ⅲ水平均显著降低,而PT和APTT时间延长明显,D-D水平显著升高,差异均具有统计学意义(P<0.001,表 3)。

表2 62例脓毒症患者中致病菌种数量及比例
3 讨 论
脓毒症最常见的致病原因为细菌性血流感染,流行病学调查显示与G+菌感染比较,G-菌感染的脓毒症患者病情更为严重、进展更快速[9-13]。因此,降低脓毒症病死率的关键是对致病菌类型进行早期诊断、识别,以便尽早采取适宜手段控制病情。随着对脓毒症发病机制研究的不断深入,凝血功能异常与脓毒症病情严重程度的关系逐渐受到研究界重视[14-16]。有研究显示,在炎性反应被激活的同时,也伴随着血管内凝血途径的激活,大部分脓毒症患者存在凝血功能障碍,其机制主要是炎性反应所释放的细胞因子具有诱导促凝血作用,损害主要抗凝途径的功能,导致凝血激活和级联反应[17-20];凝血级联又可反过来调节炎性反应。当机体血液处于高凝状态,导致微血管内微血栓形成和微循环障碍,引起组织器官缺血,进而发展为严重脓毒症、脓毒性休克、甚至多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[21-24]。凝血异常者常见FIB、D-D及AT Ⅲ等生物指标水平改变[25,26]。
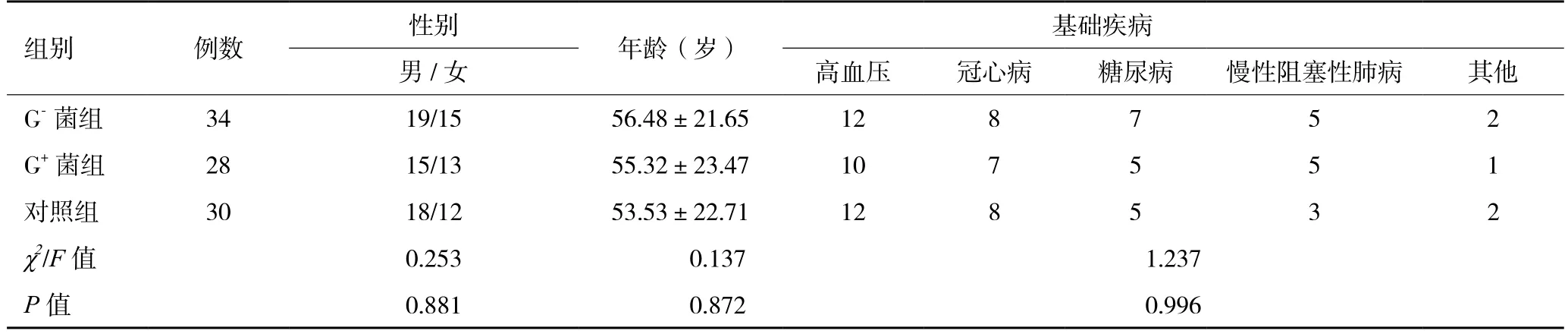
表1 三组患者一般资料比较(例数)
本研究通过监测细菌感染的脓毒症患者凝血功能指标的变化,旨在为临床上脓毒症患者针对凝血系统治疗而提供新的参考依据。本研究血培养显示,细菌性血流感染所致的脓毒症患者中G-菌感染以大肠埃希菌(35.3%)为主,G+菌感染以金黄色葡萄球菌(39.3%)感染为主,提示在选用抗菌药物时,重点考虑这几种细菌感染。凝血功能指标检测显示,与健康对照组比较,G-菌组和G+菌组血液中PLT、FIB和AT Ⅲ水平均显著降低,而PT、APTT和TT时间得到明显延长,D-D水平显著升高,差异均具有统计学意义;与G+菌组比较,G-菌组血液中PLT、FIB和AT Ⅲ水平均显著降低,而PT和APTT时间延长明显,D-D 水平显著升高,差异均具有统计学意义。以上结果表明,细菌性血流感染所致的脓毒症患者存在凝血和纤溶活性异常;G-菌和G+菌感染的脓毒症患者之间各凝血指标水平差异显著,G-菌引起的凝血功能障碍较G+菌更为严重,该结果与杨辉等[22]的研究结果相一致。另外,由于G-菌和G+菌均可引起凝血功能障碍,因此凝血各指标可能无法有效鉴别细菌感染类型,但可用于同种菌感染患者病情严重程度的判断。但本研究不足之处为回顾性的单中心研究,且样本量偏少,今后应增加样本量,开展多中心的前瞻性研究,以更好为临床细菌所致脓毒症诊疗提供参考。
总之,细菌性血流感染所致脓毒症患者存在显著的凝血功能障碍,其中凝血功能四项及PLT、D-D、AT Ⅲ水平变化与感染的细菌类型及病情严重程度存在密切关系,在临床治疗脓毒症时,应密切关注凝血系统功能给予相关干预,并综合患者实际情况采用抗菌药物进行针对性的治疗。

表3 G-菌组与G+菌组脓毒症患者凝血功能情况比较(x±s)
【参考文献】
[1]邢利峰,姬晓伟,谢 波,等. 脓毒症患者凝血功能变化与APACHEⅡ评分的相关性研究 [J].中华医院感染学杂志, 2013, 23(20): 4880-4882.
[2]李军尧,李力军,刘利波 . 不同细菌感染与脓毒症患者病情及预后的临床研究[J].华南国防医学杂志,2017, 31(5): 309-312. DOI: 10.13730/j.issn.1009-2595.2017.05.006.
[3]邹秀丽,吴铁军,崔玉静,等. 革兰阳性菌、革兰阴性菌血流感染致脓毒症患者血清降钙素原水平变化及意义[J].山东医药,2016, 56(28): 75-77. DOI:10.3969/j.issn.1002-266X.2016.28.027.
[4]Brodská H, Malícková K, Adámková V,et al. Significantly higher procalcitonin levels could differentiate Gramnegative sepsis from Gram-positive and fungal sepsis [J].Clin Exp Med, 2013, 13(3): 130-146.
[5]王 红,张淑文,任爱民,等.重度脓毒症凝血功能紊乱与病情严重度及预后的关系[J].中华急诊医学杂志, 2005, 14(10): 804-806.
[6]司 宇,马瑞爽,邓瑞娟,等.脓毒症致凝血异常发生机制的研究进展[J].现代生物医学进展,2015, 15(11): 2148-2149. DOI: 10.13241/j.cnki.pmb.2015.11.041.
[7]刘阳桦,吴 敏. 细菌性血流感染所致脓毒症患者凝血-炎症生物标志物水平变化的临床意义[J].中国病原生物学杂志, 2017, 12(3): 270-273. DOI: 10.13350/j.cjpb.170317.
[8]陈海英,陈 艳. 延迟抗菌治疗与增加儿童严重脓毒症病死率和器官功能紊乱风险的临床分析[J].临床急诊杂志, 2016, 17(3): 193-197. DOI: 10.13201/j.issn.1009-5918.2016.03.009.
[9]刘慧琳, 刘桂花, 马青变.降钙素原对急诊脓毒症患者早期诊断的价值[J].中国危重病急救医学 , 2012, 24(5): 298-301. DOI: 10.3760/cma.j.issn.1003-0603.2012.05.011.
[10]苏应仙,林 翀,陈少文,等. 血液中炎性指标与脓毒血症细菌感染患者病情的相关性研究[J].中国现代医学杂志, 2016, 26(9): 97-100. DOI: 10.3969/j.issn.1005-8982.2016.09.021.
[11]Wacker C, Prkno A, Brunkhorst F M,et al. Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis [J]. Lancet Infec Dis, 2013, 13(5):426-435.
[12]郑 江,郑新川.以细菌主要病原体相关分子为靶标的脓毒症防治策略[J].第三军医大学学报, 2016, 38(4): 323-329. DOI: 10.16016/j.1000-5404.201512204.
[13]Stortz J A, Mira J C, Raymond S L,et al. Benchmarking clinical outcomes and the immunocatabolic phenotype of chronic critical illness after sepsis in surgical intensive care unit patients [J]. J Trauma Acute Care Surg, 2018, 84(2): 342-349. DOI: 10.1097/TA.0000000000001758.
[14]吴志恒, 郭玉霞, 卜 婧,等.革兰阴性菌和革兰阳性菌血流感染危重患者中致炎症反应的比较[J].中国感染与化疗杂志, 2012, 12(1): 27-31. DOI: 10.16718/j.1009-7708.2012.01.022.
[15]Dellinger R P, Levy M M, Rhodes A,et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock, 2012 [J]. Intensive Care Med, 2013, 39(2): 165-228.
[16]周海琪,裴颖皓,陈明祺,等. 多项指标联合检测在脓毒症患者革兰阴性菌血流感染的临床价值分析[J].中华医院感染学杂志, 2016, 26(24): 5557-5559.DOI: 10.11816/cn.ni.2016-162449.
[17]Parks T, Hill A V, Chapman S J. The perpetual challenge of infectious diseases [J]. N Engl J Med, 2012, 367(1):90. DOI: 10.1056/NEJMc1204960#SA2.
[18]Maeda M, Takuma T, Seki H,et al. Effect of interventions by an antimicrobial stewardship team on clinical course and economic outcome in patients with bloodstream infection [J]. J Infect Chemother, 2016, 22(2): 90-95.DOI: 10.1016/j.jiac.2015.11.004.
[19]Moore M S, McCarroll M G, McCann C D,et al. Direct screening of blood by PCR and pyrosequencing for a 16S rRNA gene target from emergency department and intensive care unit patients being evaluated for bloodstream infection [J]. J Clin Microbiol, 2016, 54(1): 99-105.DOI: 10.1128/JCM.02394-15.
[20]Akcay I, Okoh A K, Yalav O,et al. The prognostic value of procalcitonin, CRP and thyroid hormones in secondary peritonitis: a single-center prospective study [J]. Ulus Travma Acil Cerrahi Derg, 2014, 20(5): 343-352. DOI:10.5505/tjtes.2014.98354.
[21]Anand D, Das S, Ray S,et al. Interrelationship between procalcitonin and organ failure in sepsis [J]. Indian J Clin Biochem, 2014, 29(1): 93-96. DOI: 10.1007/s12291-013-0326-z.
[22]杨 辉,罗 倩,陈君灏,等. 血清PCT、CRP 及内毒素在细菌性血流感染所致脓毒症患者中的早期诊断价值[J]. 现代生物医学进展, 2017, 17(2): 338-341.DOI: 10.13241/j.cnki.pmb.2017.02.035.
[23]Ye Q, Xu X,Zheng Y,et al.Etiology of septicemia in children with acute leukemia: 9 year experience from a children' s hospital in China [J]. Pediatr Hematol Oncol, 2011, 33(5): e186-e191. DOI: DOI: 10.1097/MPH.0b013e31821ba92c.
[24]Shimo T, Adsch Y, Umezawa K,et al. Dpoplysaccharide-injected mice,resulting in rescuing mice from death in vivo [J]. Clin Exp Immunol, 2011, 166(2): 299-306.DOI: 10.1111/j.1365-2249.2011.04475.x.
[25]Vandijck D M, Hoste E A,Blot S I,et al. Dynamics of C-reactive protein and white blood cell count in critically ill patients with nosocomial Gram positive vs Gram negative bacteremi-a: a historical cohort study [J]. BMC Infect Dis,2007(7):106. DOI: 10.1186/1471-2334-7-106.
[26]Li H Y , Yao Y M , Shi Z G,et al. The potential role of Staphylococcal enterotoxin B in rats with postburn aerues sepsis [J]. Shock, 2003(20): 257-263.

