CT表现为T1期高、低量化混合性磨玻璃样变肺癌肺内周围区淋巴结清扫意义
曾奇峰,白雄雄,王浩宇,孔庆龙,李 军,许 凝
(大连市中心医院 胸外科,辽宁 大连 116033)
非小细胞肺癌(non-small cell lung cancer, NSCLC)患者病情分期与淋巴结转移情况及肿瘤的远处转移密切相关。2015中国原发性肺癌诊疗指南[1]指出cⅠ期NSCLC首选手术治疗,完全性手术切除仍然是早期NSCLC患者获得长期生存的唯一手段。但手术中对淋巴结的清扫方式却存在争议。研究证实,亚实性肺结节(subsolid pulmonary nodule,SSPN)与早期肺癌的关系密切,随着胸部螺旋CT的普及使用,尤其是低剂量螺旋CT(low-dose spiral CT,LDCT)取代胸部X线扫描检查,成为早期肺癌筛查的最有效工具,并在临床上广范应用。SSPN的检出率日益增高。SSPN在CT上可表现为局限性磨玻璃样变(focal ground glass opacity,fGGO),按照GGO的实性成份含量不同可再分为纯磨玻璃结(pure ground glass opacity,pGGO)和伴有实性成份的混合磨玻璃结节(mixed ground glass opacity,mGGO)。根据Oda等[2]提出的GGO量化计算及Suzuki等[3]研究的标准将mGGO量化分型为低量化(10%≤实性成份<50%)mGGO,高量化(实性成份50%~90%)mGGO。对于pGGO,国内外大量研究表明其恶性程度低,一般不发生淋巴转移,预后良好[4],而CT表现为实性结节的小肺癌由于肿瘤中心纤维增生及肺泡,网状结构断裂,浸润和转移的可能性增大,预后较差[5]。mGG介于pGGO和实性结节之间,所以对于T1期HRCT下表现为mGGO病变的NSCLC,研究其淋巴结的转移规律、可切除性、清扫范围后具有重要意义。而国内外学者普遍认为肺癌胸内淋巴引流遵循由下至上,由近及远,由肺内经过肺门向纵膈引流[6-7]。多数病例是顺序转移。因此,周围型肺癌在肿瘤生长过程中首先侵犯周围的第12、13、14组淋巴结。通过分组比较CT下表现为高量化、低量化mGGO的T1 (直径≤3 cm)的早期肺癌的淋巴结转移情况,特别是第12、13、14组肺内周围区淋巴结的转移情况,能为术前判断病情,指导术中淋巴结清扫策略,划定肿瘤分期,选择合理的肺癌综合治疗方案提供依据。
1 资料与方法
1.1 临床资料
选取2015年1月至2016年6月期间于大连医科大学附属大连市中心医院胸外科行肺癌根治术患者60例,其中男24例,女36例,年龄34~76(58.40±7.93)岁,作淋巴结转移情况分析。
1.2 入组标准
(1)全数患者在常规体检时发现病灶。(2)所有患者肿瘤均为原发性,HRCT提示为孤立性病灶。(3)患者术前HRCT测量肿物直径均≤3 cm,且术后病理均确诊为直径也≤3 cm的NSCLC。(4)所有患者术前均未行辅助放化疗。(5)所有患者均行胸腔镜下全肺叶切除术+纵隔淋巴结清扫术,同时对残余标本肺内的第12、13、14组淋巴结进行摘取。(6)所有患者术后均无重大并发症,无死亡病例。
1.3 分组标准
所有患者术前均在本院行全肺薄层高分辨率CT(high-resolution computed tomography,HRCT)扫描,且均使用本院同一CT机(Siems sensation 64),均采用1 mm的层厚。所得影像学资料请两位具有20年以上胸部影像诊断经验的医师采用双盲法进行阅片诊断,于CT肺窗下测量mGGO病灶的最大直径,于CT纵隔窗下测量mGGO病灶内实性成份直径,并采用二者测量平均值作为分组计算依据,若两位医师存在分歧,则请第3位高年资医师进行评估,所得测量数据根据Oda等[2]提出的GGO量化计算及Suzuki等[3]研究的标准mGGO量化分型为10%≤实性成份<50%的mGGO低量化组和50%≤实性成份<90%的mGGO高量化组,共两组。归入mGGO高量化组患者共计28例,其中男性患者16例,女性患者12例;归入mGGO低量化组患者共计32例,其中男性患者8例,女性患者24例。
1.4 淋巴结清扫及观察指标
本次研究参照IASLC第7版肺癌分期系统[8]的肺癌淋巴结分布情况对肺内周围区第 12、13、14组淋巴结进行取材、标记并送检,作病理诊断。术后根据病理结果回报进行TNM分期。分析肿物HRCT成像中mGGO密度与胸内纵膈淋巴结及肺内淋巴结转移率的关联性。NSCLC病理分型按照WHO标准分类,TNM分期按照IASLC 2016[9](第八版)作为标准。
1.5 统计学方法
应用SPSS 19.0统计学软件进行数据分析,率的比较选用卡方检验,取P<0.05为差异有统计学意义。
2 结 果
2.1 病理结果
全组60例患者发生淋巴结转移者共计8例,转移率为13.33%。共清扫淋巴结1038枚,其中第12、13、14组肺内周围区淋巴结365枚,第1~11组纵隔+肺门淋巴结673枚,平均每例清扫并送病理分析淋巴结(18.54±7.62)枚。术后病理结果提示为转移淋巴结共计40枚,总体转移率为3.85%,其中mGGO高量化组共清扫淋巴结共计456枚,转移淋巴结31枚,转移率为6.80%;mGGO低量化组共清扫淋巴结共计582枚,转移淋巴结9枚,转移率为1.55%。单纯的N1淋巴结转移患者3例,转移淋巴结共计12枚,单纯N2淋巴结转移患者0例,转移淋巴结共计0枚,N1+N2淋巴结转移患者5例 ,转移淋巴结共计28 枚。其中病理检验结果提示单纯肺内周围区第12和(或)13和(或)14组淋巴结转移者3例,其中高量化组2例,低量化组1例。二者检出率分别为7.14%和3.13%,见表1。
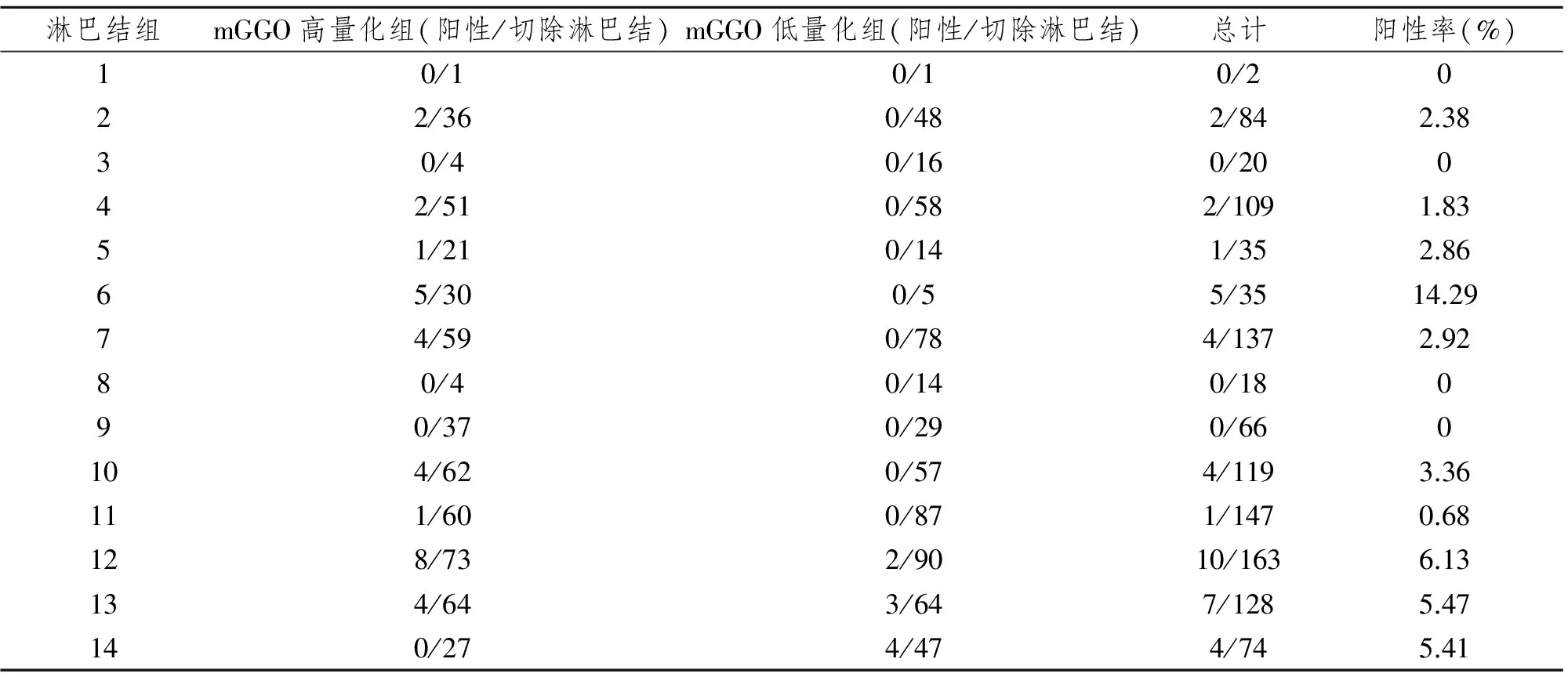
表1 60例患者术后病理各组淋巴结的转移情况Tab 1 Lymph nodes Metastasis detected by postoperative pathology in 60 patients
2.2 mGGO高量化组、低量化组肺癌患者淋巴结转移情况
60例患者中,常规淋巴结清扫术后淋巴结转移水平的纵隔+肺门区/叶间区淋巴结,即第1~11组淋巴结的总体转移率为2.82%(19/673),取材的肺内周围区淋巴结(第12+13+14组)总体阳性率为5.75%(21/365),转移率差异亦有统计学意义(χ2=5.49,P<0.05),见表2。在50%≤实性成份<90%的mGGO高量化组中第1~11组淋巴结转移率6.51%(19/292);第12~14组淋巴结转移率为7.32%(12/164),两者差异无统计学意义(χ2=0.93,P>0.05)。而在10%≤实性成份<50%的mGGO低量化组中,第1~11组淋巴结转移率为0(0/381),第12~14组淋巴结转移率为4.48%(9/201),两者差异有统计学意义(χ2=14.52,P<0.01)。横向比较在50%≤实性成份<90%的mGGO高量化组和10%≤实性成份<50%的mGGO低量化组第1~11组纵隔+肺门淋巴结转移率,分别为6.51%、0%,差异有统计学意义(χ2=25.51,P<0.01),见表3。比较两组第12~14组肺内周围区淋巴结转移率分别为7.32%、4.48%,差异无统计学意义(χ2=1.34,P>0.05)。
表2第1~11组淋巴结转移率与第12~14组肺内周围区淋巴结转移率关系在mGGO高量化、mGGO低量化组中的情况
Tab 2 Lymph node metastasis of No.1-11 and No.12-14 lymph nodes in the mGGO high-quantification and mGGO low-quantitative group

mGGO性质纵隔+肺门区/叶间区淋巴结转移率(%)(第1~11组)肺内周围区淋巴结转移率(%)(第12、13、14组)χ2P高量化组5.107.320.93>0.05低量化组0.004.4814.52<0.01总计2.825.755.49<0.05
高量化组:50%≤实性成份占比<90%;低量化组:10%≤实性成份占比<50%
表3 mGGO高量化与mGGO低量化组第1~11组淋巴结转移率的关系
Tab 3 Relationship between mGGO high quantitative and mGGO low quantitative group in patients with No.1-11 lymph node metastasis

mGGO性质发生转移淋巴结数目(枚)未发生转移淋巴结数目(枚)转移率(%)χ2P高量化组192736.51低量化组03810.0025.51<0.01
高量化组:50%≤实性成份占比<90%;低量化组:10%≤实性成份占比<50%
2.3 mGGO高量化组、低量化组肿物病理类型差异
28例mGGO高量化组(50%≤实性成份占比<90%)患者中,4例术后病理诊断为鳞癌,其中1例淋巴结转移阳性;2例诊断为腺鳞癌,其中1例淋巴结转移阳性;22例诊断为腺癌,其中1例为浸润性黏液型腺癌,该例患者淋巴结转移阳性;15例为浸润性腺癌,其中3例发生淋巴结转移;6例为微浸润性腺癌,均无淋巴结转移。32例mGGO低量化组(10%≤实性成份占比<50%)患者术后病理诊断均为腺癌,其中8例为浸润性腺癌, 1例淋巴结转移阳性;24例为浸润性腺癌,均无淋巴结转移。23例浸润性腺癌患者总体淋巴结转移率为17.39%(4/23),30例微浸润性腺癌患者总体淋巴结转移率为0(0/30),两者差异具有统计学意义(χ2= 17.05,P<0.01)。
3 讨 论
作为危害人类健康的主要疾病之一,肺癌的早期诊断和综合治疗成为医学研究的重要范畴。近年来,随着以外科手术为主导的肺癌多学科综合治疗模式的不断发展完善,肺癌的生存率和生存期得到了一定程度的改善,但其总体术后生存率仍不理想。Pisters等[10]报道,约有 50%的完全性切除的 NSCLC 患者因远处转移及其相关并发症而导致治疗失败。随着低剂量螺旋CT的普及并被广泛应用在肺癌的筛查上,越来越多的T1期肺癌被筛查发现,而在这些患者当中又以局限性磨玻璃影为影像学特点的早期肺癌居多,这些病变中大部分影像学表现为原发性周围型孤立病灶。根据NCCN2015[11]版年肺癌诊疗指南,以ⅠA期为主的早期肺癌的治疗手段应以手术为主,Ⅰ期肺癌行手术治后10年预期生存率约为92%,而未进行治疗的Ⅰ期肺癌患者多数将在5年内死亡。因此肺癌的早期诊断、早期治疗成为改善肺癌患者远期预后的重点。在肿瘤未发生远处转移的情况下,区域淋巴结的转移情况是决定NSCLC病理分期的最主要因素,对于判断患者预后,制定治疗方案具有重要意义。随着影像学技术的发展,临床上对肺内fGGO病灶的诊断更为精准和细致。根据fGGO病灶的性质可分为单纯pGGO和mGGO两种。
研究表明T1期(肿瘤直径≤3 cm)影像学表现为mGGO改变的肺癌总体淋巴结转移率较低,总体转移率为3.85%。肺癌根治术常规清扫的纵隔淋巴结(第1~11组)总体转移率为2.82%,结果与章智荣等[12]270 例 T1 期NSCLC 实验得出的mGGO患者纵隔淋巴结转移率为 2.1%结果接近。但对比mGGO高量化和mGGO低量化组,在mGGO高量化组中转移率为6.51%,在32例mGGO低量化组NSCLC患者中共清扫出纵隔淋巴结381枚,术后病理均未发有阳性淋巴结。mGGO高量化和mGGO低量化两组纵隔淋巴结转移率的差异有统计学意义(χ2=25.51,P<0.01),结果与Henschke等[13]提出的“mGGO在HRCT 上表现为部分实性结节。其中混杂的软组织成分越多, 其倍增时间越短, 浸润和转移的可能性越大。”观点相一致。因此我们认为对于术前HRCT上直径≤3 cm的孤立周围型mGGO改变病灶,若术前测量计算其为实性成份占比<50%的mGGO,其纵隔淋和肺门巴结转移率较低,可不作系统的纵隔淋巴结清扫术,或仅作纵隔淋巴结采样。对于直径≤3cm,50%≤实性成份占比<90%的mGGO,此类患者发生纵隔及肺门淋巴结转移的几率较实性成份占比<50%的mGGO高(两组纵隔及肺门淋巴结转移率分别为6.71%、0,差异有统计学意χ2=25.51,P<0.01),此类患者应根据肿瘤的病理类型决定统淋巴结清扫方式。本次研究取样的肺内周围区淋巴结(第12、13、14组)总体转移率为5.75%与常规淋巴结清扫术清扫并行病理诊断的纵隔淋+肺内区/叶间区淋巴结(第1~11组)2.82%的总体转移率相比差异有统计学意义(χ2=4.88,P<0.05),尤其在mGGO低量化组当中,纵隔淋巴结和肺内淋巴结阳性率分别为0和5.75%,两者差异显著(χ2=14.52,P<0.01)。因此我们认为在NSCLC中肺内周围区淋巴结(第12、13、14组)淋巴结转移的检出率较反映传统淋巴结清扫术淋巴结转移情况的第1~11组纵隔+肺门/叶间淋巴结高。因此我们建议对术中切除的肺叶标本应尽量解剖并摘除肺内第 12、13、 14 组淋巴结作病理诊断,尤其在mGGO低量化(10%≤实性成份<50%)中,要警惕单纯的肺内淋巴结转移,避免淋巴结转移假阴性诊断。在本组60例患者当中,3例患者仅存在肺内周围区第12~14组的淋巴结转移,而不存在纵隔淋+肺门区/叶间区第1~11组巴结转移,假阴性检出率达5.00%。由此可见,对肺内周围区第12、13、14组淋巴结进行病理检测对于T1期NSCLS患者较为重要,尤其对于10%≤实性成份占比<50%的mGGO患者,其结果关系到患者肿瘤分期以及术后是否需要接受常规化疗。
本研究60例肺癌患者中有4例患者术后病理诊断为鳞状细胞癌,4例患者术前HRCT均表现为高量化的mGGO改变。4例患者中1例发生淋巴结转移,转移率较腺癌高。作者认为可能是鳞癌在临床上多表现为以中央型病灶,未被纳入本次研究,同时也与鳞癌患者例数过少有关。60例患者中有2例术后病理诊断为腺鳞癌,其中1例淋巴结转移阳性。结果与李鉴等[14]提出腺鳞癌恶性程度较高的观点相吻合。60例患者当中有54例术后诊断为腺癌,其中30例为恶性程度较低的微浸润腺癌,均无淋巴结结转移阳性,因此对于微浸润腺癌,无论患者术前HRCT表现为50%≤实性成份<90%的高量化或10%≤实性成份<50%的低量化,其纵隔、肺门/叶间以及肺内周围区淋巴结转移率均较低,此类患者可不行系统纵隔淋巴结清扫,特别对于高龄及心肺功能欠佳的患者,可考虑不行标准的肺叶切除术而改行大楔形切除术或肺段切除术,术后对切除的肺标本进行解剖,取样肺内淋巴结进行病理检测,以明确肿瘤分期。
4 结 论
综上所述,对于术前HRCT表现为混合性磨玻璃样变的T1期NSCLC,均可发生单纯的肺内周围区的12、13、14组淋巴结转移,因此对于术中切除的病理标本,建议尽量解剖并取样此三组淋巴结进行病理活检,从而发现潜在的淋巴结转移“假阴性”。术前HRCT表现为实性成份<50%的低量化mGGO样变的T1期NSCLC很少发生纵隔淋巴结的转移,此类患者可建议不行系统的纵隔淋巴结淋巴结清扫。术前HRCT表现为实性成份≥50%的高量化mGGO样变的T1期NSCLC,此类患者若术中病理诊断为微浸润腺癌,其纵隔淋巴结转移率较低,亦可不行系统的纵隔淋巴结淋巴结清扫。若术中诊断为浸润性腺癌、浸润性粘液腺癌、鳞癌、腺鳞癌,则建议行肺叶切除和系统的纵隔淋巴结清扫。
参考文献:
[1] 支修益, 石远凯, 于金明. 中国原发性肺癌诊疗规范(2015年版)[J].中华肿瘤杂志,2015,37(1):67-78.
[2] Oda S, Awai K, Murao K, et al. Volume-doubling time of pulmonary nodules with ground glass opacity at multidetector CT: Assessment with computer-aided three-dimensional volumetry[J]. Academic Radiology, 2011, 18(1):63-69.
[3] Suzuki K, Kusumoto M, Watanabe S, et al. Radiologic classification of small adenocarcinoma of the lung: radiologic-pathologic correlation and its prognostic impact[J]. Ann Thorac Surg, 2006, 81(2):413-419.
[4] Ohta Y, Shimizu Y, Kobayashi T, et al. Pathologic and biological assessment of lung tumors showing ground-glass opacity[J]. Ann Thorac Surg, 2006,81(4):1194-1197.
[5] Zhong W, Yang X, Bai J, et al. Complete mediastinal lymphadenectomy: the core component of the multidisciplinary therapy in resectable non-small cell lung cancer[J]. Eur J Cardiothorac Surg, 2008, 34(1): 187-195.
[6] 孙即昆. 肺外科学[M]. 北京:人民卫生出版社, 1987.
[7] Takahashi K, Stanford W, Van Beek E, et al. Mediastinal lymphatic drainage from pulmonary lobe based on CT observations of histoplasmosis: implications for minimal N2 disease of non-small-cell lung cancer[J]. Radiat Med, 2007, 25(8): 393-401.
[8] Rusch VW, Asamura H, Watanabe H, et al. The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2009, 4(5): 568-577.
[9] Goldstraw P, Crowley JJ. The International Association for the Study of Lung Cancer International Staging Project on Lung Cancer[J]. J Thorac Oncol, 2006, 1(4): 281-286.
[10] Pisters KMW, Chevalier TL. Adjuvant Chemotherapy in Completely Resected Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2005, 23(14):3270-3278.
[11] Izbicki JR, Passlick B, Pantel K, et al. Effectiveness of radical systematic mediastinal lymphadenectomy in patients with resectable non-small cell lung cancer: results of a prospective randomized trial[J]. Ann Surg, 1998, 227(1): 138-144.
[12] 章智荣, 毛友生, 赫捷, 等. 临床Ⅰ期非小细胞肺癌淋巴结转移规律和清扫方式的探讨[J]. 中华肿瘤杂志, 2014, 36(7): 536-540.
[13] Henschke CI, Yankelevitz DF, Mirtcheva R, et al. CT screening for lung cancer: frequency and significance of part-solid and nonsolid nodules[J]. Am J Roentgenol, 2002, 178(5): 1053-1057.
[14] 李鉴,张杜超,赫捷,等.肺腺鳞癌临床病理特点和外科治疗预后研究[J].中国现代手术学杂志,2009,13(4):241-244.

