紫杉醇联合顺铂化疗对口腔癌患者外周血细胞免疫的影响
李向春 邸瑞玲 张 鑫 张素欣
口腔鳞状细胞癌是常见的恶性肿瘤,全世界每年新发病例超过30万[1],而我国则属于口腔癌的高发区之一。目前临床上治疗口腔癌的标准方案为伴有或不伴有术后辅助治疗的原发肿物手术切除[2]。尽管手术技术及放化疗治疗方案的不断进步,但口腔癌的存活率在过去几十年中基本保持不变,同时手术及化疗会对患者造成创伤和并发症,复发率及转移率高。而肿瘤免疫治疗没有典型的耐药性,且产生的疗效持久,还可以根据个体肿瘤的特征设计相应的靶向治疗契合精准医学的理念[3]。因此,在对口腔癌患者进行治疗时,同时改善患者的免疫功能具有重要意义[4]。本文在前期研究的基础上通过流式细胞术检测化疗对口腔癌患者外周血T淋巴细胞各表型的影响,并通过ELISA法检测细胞因子IL-2、IL-4及INF-γ的变化,分析化疗前后口腔癌患者免疫功能的变化,以期为口腔癌的免疫治疗提供进一步的理论依据。
资料和方法
一、资料和方法
1.一般资料
选取2015年6月至2017年8月间于秦皇岛市第一医院口腔科和河北医科大学第四医院口腔科住院的30例口腔鳞状细胞癌(经活检病理证实)患者作为实验组,其中男性16例,女性14例,平均年龄58.2岁,30名健康志愿者为对照组,两组间性别及年龄差异无统计学意义(P>0.05)。本研究符合医学伦理学规定,全部患者均签署知情同意书并自愿配合研究。
2.纳入标准
按照国际抗癌协会(UICC)口腔癌分期标准[5]选取临床分期为Ⅲ期和Ⅳ期的口腔癌患者,发病部位包括舌、颊、牙龈、口底等部位。经临床综合评估后认为均不适宜行手术切除或者已经做姑息手术后又出现复发;卡氏体力状态(karnofsky performance status,KPS)评分均>60分,预测生存时间>3个月;对化疗药物无严重不良反应;均完成预定的化疗疗程[6]。入院前未接受任何治疗,均无糖尿病、高血压等系统性疾病,无自身免疫性疾病及免疫抑制药物服药史。
3.实验试剂及仪器
异硫氰酸荧光素FITC标记的CD3单克隆抗体(6604623,Beckman Coulter,美国)、FITC 标记的CD4单克隆抗体(A07750,Beckman Coulter,美国),藻红蛋白(PE)标记的CD8单克隆抗体(A07757,Beckman Coulter,美国),PE标记的INF-γ单克隆抗体(IM2717U,Beckman Coulter,美国)及 PE 标记的 CD56 单克隆抗体(A07788,Beckman Coulter,美国),红细胞裂解液(215233583,Sigma,美国)。IL-4(DKW12-1040-096, 达 科 为 , 深 圳 );IL-2(DKW12-1020-096,达科为,深圳)ELISA检测试剂盒;INF-γ(DKW12-1000-096,达科为,深圳)ELISA检测试剂盒,Epics-XLⅡ型流式细胞仪(Beckman Coulter,美国)。
4.实验方案
所采用具体化疗方案为紫杉醇150mg/m2IV,第1天;顺铂100mg/m2IV,第1天。实验组化疗前5天及化疗后30天采取新鲜外周血2ml,其中1ml肝素抗凝行流式细胞检测,另1ml离心取上清行Elisa检测。对照组常规采取静脉血,样本处理后备用。
二、检测指标与方法
1.T淋巴细胞各表型分布的测定
T淋巴细胞表型检测中每份样本分为4组,每管取抗凝静脉血100μl,第一组加入FITC标记的CD3抗体,PE标记的CD56抗体;第二组加入FITC标记的CD4抗体,PE标记的CD8单克隆抗体;第三组加入FITC标记的CD4抗体及PE标记的INF-γ抗体;第四组加入FITC标记的CD4抗体及PE标记的IL-2抗体,各组中每种抗体的加入量均为10μl,室温下避光孵育1h,向其内加入红细胞裂解液,裂解红细胞并静置10min,1000rpm离心5min,去上清,重悬于1mlPBS中,以Epics-XLⅡ型流式细胞仪检测各淋巴细胞的比例,并计算CD4/CD8的比值。
2.ELISA法检测细胞因子
取离心后的外周血上清,按照制造商的说明使用IL-4(DKW12-1040-096,达科为,深圳)、IL-2(DKW12-1020-096,达科为,深圳)ELISA检测试剂盒、INF-γ(DKW12-1000-096,达科为,深圳)ELISA检测试剂盒检测IL-4,IL-2,INF-γ含量。
3.统计学处理
实验数据均采用均数±标准差(±s)表示,使用SPSS22.0软件进行统计学分析,实验组内比较采用配对t检验,实验组与对照组间比较采用方差分析,以P<0.05为有统计学意义。
结 果
1.化疗前后口腔癌患者外周血T细胞表型表达的变化
对照组与化疗前后口腔癌患者CD3+、CD4+、CD8+、CD56+T淋巴细胞所占比例以及CD4/CD8比值见表 1,代表性图像见图 1a,d,g,b,e,h。与对照组比较化疗前口腔癌患者外周血中CD3+、CD4+T淋巴细胞的表达降低,CD8+T淋巴细胞的表达增加,差别均有统计学意义,CD4/CD8比值下降或倒置(P<0.05),而口腔癌患者CD56+T淋巴细胞的表达与正常对照人群无明显差别;经紫杉醇+顺铂化疗后30天再次采集病人外周血测定外周血内T淋巴细胞表型,可以发现CD4+T淋巴细胞的表达在低于对照组的情况下与化疗前相比有了一定的改善,CD8+T细胞的比例较化疗前有所下降,但与正常对照组比较差别无显著性,CD4/CD8比值有所提高。尽管经统计学分析CD56+T淋巴细胞的表达有不同程度的下降,但化疗前后差异无显著性(P>0.05),但可以看到其下降幅度较大。
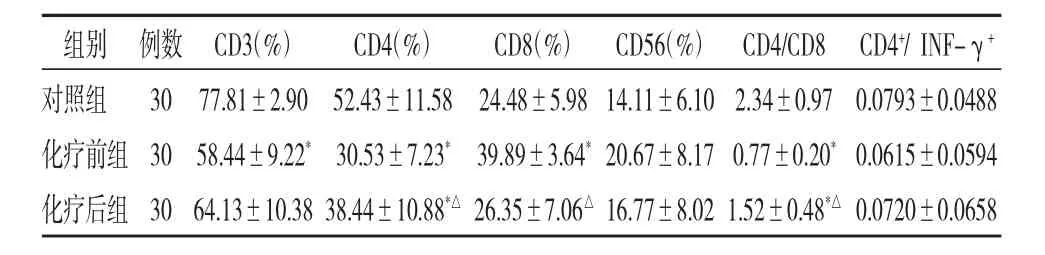
表1 化疗前后口腔癌患者T淋巴细胞表达的变化

图1 健康志愿者及口腔癌患者化疗前后外周血T淋巴细胞表型变化
经紫杉醇+顺铂化疗后口腔癌患者外周血中CD4+/INF-γ+、INF-γ+、CD4+/IL-2+、IL-2+T 淋 巴 细胞所占比例较化疗前变化结果见表1,代表性图像见图1c,f,i。其中化疗后INF-γ+T淋巴细胞比例较对照组与化疗前均有明显的提高,差异具有显著性(P<0.05)。其余各组虽然化疗后水平较化疗前均有所提高,但其差异无显著性。
2.化疗前后口腔癌患者外周血血清细胞因子的变化
健康志愿者及口腔癌患者化疗前后外周血血清IL-4,INF-γ以及IL-2的检测结果如图2及表2所示。同健康志愿者相比,口腔癌患者外周血INF-γ及IL-2含量则较健康人群明显下降(P<0.01),而 IL-4含量明显升高(P<0.01),经紫杉醇 +顺铂化疗后 INF-γ(P<0.01)及 IL-2(P<0.05)含量较化疗前均明显提升,但IL-4含量较化疗前无明显变化(P>0.05)。
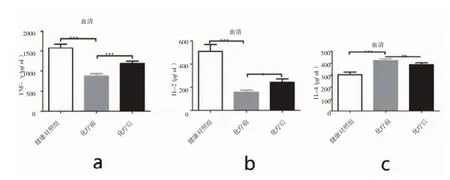
图2 健康志愿者及口腔癌患者化疗前后外周血血清中a.IL-4;b.INF-γ以及c.IL-2的含量
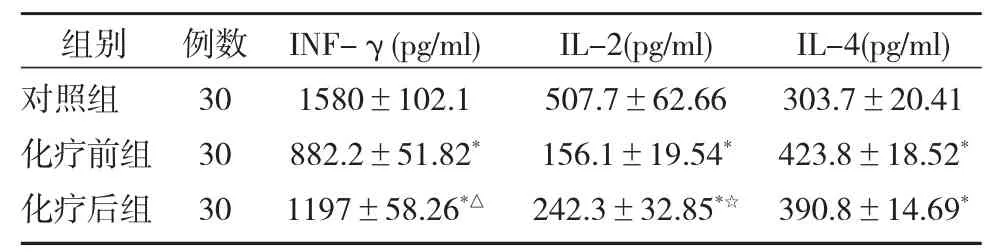
表2 化疗前后口腔癌患者外周血INF-γ、IL-2、IL-4 含量变化
讨 论
口腔和口咽癌是世界上第六位最常见的癌症,口腔癌每年全球新发病例超过30万[1]。目前针对口腔癌的治疗仍是以手术切除为主,同时配合以放疗或化疗为辅助的综合治疗。得益于肿瘤学、免疫学、影像学研究的飞速发展,近十年来肿瘤免疫治疗无论在基础研究还是临床试验方面都取得了令人瞩目的进展,成为继化学治疗、手术治疗及放射治疗之后的又一种重要的肿瘤治疗方法[7]。
肿瘤免疫主要是细胞免疫,Th1细胞诱导的免疫应答抑制了恶性肿瘤增生,肿瘤患者体内如果Th2细胞处于优势,机体细胞免疫功能会受到抑制,从而促进肿瘤发生、进展[8]。有研究表明,Th2细胞因子IL-10及IL-6在喉癌、膀胱癌等恶性肿瘤中表达明显升高,而Th1细胞因子IFN-γ、IL-2的表达显著降低,细胞免疫受到抑制[9,10]。
目前在抗肿瘤临床中常用的化疗药物主要有烷化剂类、抗代谢类、抗生素类、植物类抗癌药、铂类等。笔者在之前的研究中[11]通过MTT法检测了上述五类24种化疗药物在体外对口腔癌细胞的抑制率,发现紫杉醇具有较强的肿瘤细胞抑制率。童武松[12]等研究发现顺铂联合紫杉醇同步放化疗治疗宫颈癌,可有效改善患者的免疫功能。笔者的研究发现口腔癌患者外周血中CD4+辅助性T淋巴细胞比例较健康人群显著下降,且患者Th1型细胞因子分泌量下降,Th2型细胞因子的分泌量显著增加,出现Th1向Th2的漂移,细胞免疫功能处于抑制状态。经紫杉醇联合顺铂化疗后CD4+辅助性T淋巴细胞比例均较化疗前显著提高,CD8+细胞毒T细胞比例下降,CD4/CD8比例倒置情况得以逆转。有文献表明恶性肿瘤患者CD56+细胞较健康人群显著升高,具有淋巴细胞毒性作用,从而抑制细胞免疫[13],笔者的研究发现口腔癌患者CD56+T细胞比例高于健康人群,而化疗后其比例有不同程度的下降。
同时,除免疫细胞直接识别及杀伤肿瘤细胞外,免疫系统在抗肿瘤中的作用还通过T细胞分泌细胞因子发挥免疫调节作用,与T淋巴细胞进行相互协作,能够维持机体的免疫平衡[14]。因此,机体外周血中T细胞分泌细胞因子的水平也可以反映机体的抗肿瘤免疫状态。通过回顾文献,肿瘤病人[14,15]及肿瘤动物模型[16]的IL-2、INF-γ水平较正常人群水平下降,而血清IL-4水平较健康人群明显提高[6]。本次研究结果表明,口腔癌患者外周血中IL-2、INF-γ含量明显较健康志愿者下降,化疗后口腔癌患者外周血中INF-γ以及IL-2水平较化疗前均有了明显的提升,差别具有统计学意义; IL-4的含量则较健康志愿者明显升高,而化疗则可使其含量不同程度下降,上述口腔癌患者化疗前后T淋巴细胞及细胞因子的变化表明经诱导化疗使肿瘤体积缩小,减轻肿瘤负荷的同时,使得肿瘤宿主的细胞免疫功能得以恢复。
传统化疗药物对肿瘤患者免疫系统的影响可以作为前期研究基础,为后期临床应用提供指导。本次研究通过检测口腔癌患者经紫杉醇联合顺铂化疗前后外周血T细胞表型及产生IL-2、INF-γ等免疫因子的变化情况表明临床晚期口腔癌患者细胞免疫处于抑制状态。通过化疗使肿瘤体积缩小,肿瘤负荷减轻后使得其细胞免疫功能得以恢复,同时细胞分泌细胞因子的水平也得以升高,从而提高了机体的免疫应答能力,达到延长患者生存期的目的。关于药物促进细胞因子IL-2、INF-γ产生的具体机制有待于进一步研究。
参考文献
1 Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012.International Journal of Cancer, 2015,136(5):E359-386.
2 Montero PH,Patel SG.Cancer of the oral cavity.Surgical Oncology Clinics of North America,2015,24(3):491-508.
3 陈健,陈敏,吴海涛.头颈部鳞状细胞癌免疫治疗的研究进展.中华耳鼻咽喉头颈外科杂志,2017,52(2):143-147.
4 Kalavrezos N,Scully C.Mouth cancer for clinicians.Part 11:cancer treatment (radiotherapy).Dental update,2016,43(5):472-474,476-477,479-481.
5 Wittekind C,Oberschmid B.TNM classification of malignant tumors 2010.Pathologe 2010:25-29.
6 申婧,曹海英.紫杉醇联合顺铂治疗晚期卵巢癌患者的疗效及对免疫功能的影响.中国肿瘤临床与康复,2016,(7):790-793.
7 郭晓轶,刘菲,韩雪迪,等.分子影像引导肿瘤免疫治疗新进展.肿瘤防治研究,2018,(1):47-51.
8 王丽华,王亮亮,张競,等.卵巢癌患者外周血Th1/Th2及Treg/Th17细胞平衡关系.南方医科大学学报,2017,37(8):1066-1070.
9 Xu X,Wang R,Su Q,et al.Expression of Th1-Th2-and Th17-associated cytokines in laryngealcarcinoma.Oncology Letters,2016,12(3):1941-1948.
10 Satyam A,Singh P,Badjatia N,et al.A disproportion of TH1/TH2 cytokines with predominance of TH2,in urothelial carcinoma of bladder.Urologic Oncology,2011,29(1):58-65.
11 李向春,邸瑞玲,董立新.MTT法检测化疗药物对口腔癌细胞体外抑制率的结果分析.中国煤炭工业医学杂志,2017,(4):402-405.
12 童武松,王松林,潘金华.顺铂联合紫杉醇同步放化疗对中晚期宫颈癌患者免疫功能及血清CY-FRA21-1、SCC-Ag的影响.海南医学院学报,2016,22(23):2866-2868.
13 冯伟华,王兰兰,武永康,等.外周血CD3+CD56+T细胞在恶性肿瘤患者中的表现及临床意义.免疫学杂志,2001,17(1):47-49.
14 蒳荷芽,刘文艳,刘祎华.顺铂、5-氟尿嘧啶持续动脉灌注化疗对口腔癌患者免疫功能的影响.癌症进展,2017,15(4).
15 吴维光,赵燕,张积仁,等.化疗对肝癌患者T淋巴细胞内IL-2、IFN-γ 的影响.实用癌症杂志,2001,16(1):76-77.
16 刘炜,易鑫,李江,等.清解益肺汤及胶囊对lewis肺癌小鼠血清 IL-2、INF-γ 含量的影响. 贵州医药,2016,40(2):153-155.

