臭牡丹通过促炎细胞因子和NF-κB缓解大鼠神经病理性疼痛 *
江 茜 王 英 黄 诚
(1赣南医学院护理学院,赣州341000;2赣南医学院,赣州341000;3赣南医学院生理教研室,赣州341000)
神经病理性疼痛 (neuropathic pain,NP) 是由外周或中枢神经系统的疾病、损伤及功能障碍所导致的疼痛[1]。其临床表现特点为痛觉过敏、痛觉超敏和炎症区域持续性的自发痛[2]。它是临床上的常见病和慢性病,在人群中患病率约为6.9%~10%[3]。神经病理性疼痛发病机制至今未完全明了,目前仍无有效的治疗手段。临床上多数NP病人未能有效缓解疼痛,这给病人及其家庭带来了沉重的心理、生理及经济负担[4]。有证据表明促炎细胞因子如interleukin-6 (IL-6)、interleukin-1β (IL-1β) 和 tumor necrosis factor-α (TNF-α)等在神经病理性疼痛的发生发展过程中发挥重要作用,最终引起中枢敏化,形成持续性疼痛[5,6]。此外,在促炎因子 (TNF-α、IL-1β、IL-6等)、细菌和病毒等刺激下,NF-κB被激活,活化的 NF-κB 可调控 IL-1β、IL-6和 TNF-α等基因的表达[7,8],两者构成一种反馈机制共同促进神经病理性疼痛的维持与发展。
臭牡丹 (clerodendron bungei steud,CBS) 是传统中草药,属马鞭草植物,具有活血散瘀,消肿解毒等功用[9]。研究表明臭牡丹根提取液具有较强的镇痛作用[10];但它的作用机制仍不甚清楚,目前国内外尚无探讨臭牡丹治疗NP机制的研究报道。我们的前期实验结果提示,剂量为30 g/kg的臭牡丹缓解神经病理性疼痛模型大鼠所致的机械痛敏效果最明显[11]。根据文献报道和我们的前期结果,推测臭牡丹可能是通过抑制致炎细胞因子激活的NF-κB信号途径来发挥镇痛作用。因此,本实验拟从细胞因子及NF-κB信号通路入手,采用SNI大鼠模型,选择30 g/kg的CBS浓度持续灌胃治疗28天,应用Von-Frey设备测定大鼠机械缩足反射阈值,观察CBS能否缓解SNI大鼠的机械痛敏;通过qPCR和Western blot等实验探讨臭牡丹干预神经病理性疼痛的作用机制。
方 法
1.实验动物
SPF级雄性成年SD大鼠,体重180~220 g,购自湖南斯莱克景达实验动物有限公司[动物中心许可证号:SCXK (湘) 2013-0004]。动物饲养环境为每天12小时光照/12小时黑暗,50%~55%湿度,23 ± 1℃。实验期间所有大鼠均自由摄食饮水。大鼠实验和饲养符合相关规定。
2.药材提取
参考王春娟等[12]的方法提取药材。800 g臭牡丹根(购自亳州市安东药业有限责任公司)剪碎,加3 200 ml 80%乙醇(药材和水1:4比例),用恒温电热套100℃煮沸后调低温度至60℃ 煮30分钟,倒出药液并用四层纱布过滤;臭牡丹根残渣按照第一遍提取方法再分别提取2次;合并三次滤液,用旋转蒸发仪浓缩并蒸发滤液中的乙醇至无醇味,加适量生理盐水配置成6 g/ml (即30 g/kg) 浓度。药液提取成功后分装置于冰箱-20℃保存。
3.实验试剂
NF-κB p65亚基多克隆抗体(货号:4767S)、组蛋白H 3 (D1H2) 抗体(货号:4499S)购自美国CST公司,TNF-α多克隆抗体 (货号:ab6671)、IL- 1β多克隆抗体(货号:ab9722)和β-actin抗体(货号ab49900)购自英国Abcam公司,IL-6多克隆抗体(货号:SC-7884)购自美国Santa Cruz公司,HRP标记兔二抗(货号:7074)购自美国CST公司,亚细胞蛋白质组抽提试剂盒(货号:539790)和PVDF膜购自美国Millipore公司,青霉素(货号:16051411)购自江西东风药业股份有限公司,A SYBR® Select Master Mix(货号:4472908)购自美国Life technologies公司。
4.实验仪器
2390型Electronic Von Fery触觉测痛仪(TC美国),Western Blot(电泳、电转移)系统(美国Bio-Rad),Lightcycler 480IIReal-Time PCR仪(德国Roche),MK3型酶标仪(美国Thermo),ZNHW-Ⅱ型恒温电热套 (上海科雳仪器有限公司),SB-1000旋转蒸发仪 (上海爱郎仪器有限公司)。
5.神经病理性疼痛大鼠模型制备
参照Decosterd和Woolf等[13]方法制备SNI模型。1%戊巴比妥钠 (按0.5 ml/100 g注射)腹腔麻醉后,左大腿侧边剪毛,酒精棉球消毒皮肤,划开皮肤,钝性分离股二头肌,暴露出坐骨神经分支:腓肠神经,腓总神经和胫神经,用5.0丝线把胫神经和腓总神经紧紧结扎(结扎松紧以结扎的大鼠左后肢微微抽搐为宜),在脊髓远侧端剪断,保留大约2~4 mm的远侧残端,注意术中保持腓肠神经完整,伤口局部撒射青霉素粉末预防感染,肌肉和皮肤分两层缝合。
假手术组(Sham组)只暴露坐骨神经,不进行结扎剪断处理,其他手术操作同前;正常对照组(Ctrl组)不接受手术。
6.实验分组及给药
将符合实验要求的大鼠按随机数字表法随机分为四组 (n = 8):① Ctrl组;② Sham组;③ SNI组;④ SNI+CBS组。从术后第7天开始,SNI + CBS治疗组大鼠灌胃给予30 g/kg 的CBS,连续灌胃28天,Ctrl组、Sham组和SNI组大鼠则均给予同体积生理盐水。于术前1 天和术后第7、14、21、28和35天分别测定其行为学变化。并于灌胃28天后,处死大鼠,立即取材。
7.机械缩足反射阈值(机械痛敏)测量
在安静环境下,将实验大鼠放置于透明的有机玻璃箱中(底为1 cm×1 cm的铁丝网),使大鼠适应15 min。待其安静后,采用测痛仪由下往上垂直刺激大鼠足底正中皮肤(SNI大鼠术后则刺激大鼠足底外侧皮肤),逐渐加大刺激强度,大鼠出现缩足反应(如舔足、抬腿等)时屏幕上自动显示探针所施压力大小。该压力值即为机械缩足反射阈值 (paw withdrawal threshold,PWT)。最大刺激强度不超过90 g,每只大鼠重复5次,每次间隔5 min,取平均值。实验环境要求温度22±1℃,湿度55%~65%。
8.蛋白提取及Western blot检测蛋白表达
30 g/kg CBS灌胃给药4周后处死大鼠,快速取手术侧L4、L5DRG和脊髓腰膨大部分。按照亚细胞蛋白质组抽提试剂盒说明书提取蛋白:将样本组织 (50 mg) 剪切成小块,加入预冷的1 ml BufferⅠ后匀浆,4℃旋转混合10 min后4℃离心,1 000 ×g,10 min,小心吸取上清液,此为细胞质蛋白;加入预冷的1 ml BufferⅡ,最大转速涡旋剧烈振荡10 s后,4℃旋转混合30 min,4℃离心,6 000×g,10 min,小心吸取上清液,此为细胞膜蛋白;加入预冷的500 μl Buffer Ⅲ,最大转速涡旋剧烈振荡10 s后,4℃旋转混合10 min,4℃离心,7 000 × g,10 min,小心吸取上清液,即得到核蛋白。提取蛋白后,应用BCA方法测量总蛋白浓度。将分装的蛋白样本 (50 μg) 进行SDS-PAGE (10%、12%) 电泳,电转移至PVDF膜上,5%脱脂牛奶室温封闭约1 h,按1:200比例稀释一抗孵育过夜;1:1 000比例稀释用辣根过氧化物酶标记的与一抗对应的二抗,室温孵育2 h。最后,使用化学成像发光成像系统照相,通过Image tool图像分析软件读取目的以及内参条带在PVDF膜上测得的光密度值,计算出目的蛋白量。
9.qPCR检测mRNA表达
各引物序列由上海生工生物工程公司合成。采用A SYBR® Select Master Mix试剂盒提取总RNA并配制20 μl逆转录体系合成cDNA。反转录条件:65 ℃ 5 min,37 ℃ 2 min,37℃ 10 min×5 个循环,70 ℃ 15 min。采用qPCR法进行扩增,qPCR反应体系 20 μl:双蒸水 (ddH2O)7 μl,上、下游引物各1 μl,cDNA 1 μl,SYBR® Select Master Mix 10 μl。反应条件:变形95℃ 10 min;95℃ 10 s,退火61℃20 s,延伸72℃ 25 s,40个循环。PCR反应后,采用以下的程序进行熔解曲线分析:72 ℃~95 ℃,0.5 ℃,10 s/each。每组重复检测3次。采用2-ΔΔCt法分析NF-κB、TNF-α、IL-1β和IL-6的mRNA表达水平。引物序列如下:

基因Gene引物Primer sequence 5' to 3'TNF-α Forward CCACCACGCTCTTCTGTCTACTG Reverse GGGCTACGGGCTTGTCACTC IL-1β Forward CACCTCAATGGACAGAACATAAGC Reverse TCTTCTTTGGGTATTGTTTGGGA IL-6 Forward AAGACAAAGCCAGAGTCATTCAGAG Reverse GTTGGATGGTCTTGGTCCTTAGC NF-κB p65 Forward CTGTGCGAGTGTCCATGCAG Reverse TTCTTCATGATGCTCTTGAAGGTC Actin Forward CCAACCGTGAAAAGATGACC Reverse ACCAGAGGCATACAGGGACA
10.数据处理与统计分析
应用SPSS 17.0、GraphPad Prism 5.0软件对数据进行处理并统计分析;计量资料以均数±标准差(±SD)表示,qPCR和Western blot的结果采用one-way ANOVA检验,机械缩足反射阈值 (PWT)的结果采用two-way ANOVA和Bonferroni' s post hoc 检验。P< 0.05认为差异有统计学意义。
结 果
1.CBS对SNI模型大鼠PWT的影响
实验结果显示,Ctrl组、Sham组、SNI组和SNI + CBS组在造模前的PWT差异无显著性。与Sham组相比,SNI组在造模后第7天出现PWT下降 (P< 0.001),提示造模成功,且在造模后的第14、21、28和35天内均持续低于Sham组 (P< 0.001)。与SNI组相比,给予剂量为30 g/kg CBS干预后的第 14、21和28天,PWT显著上升 (P< 0.05,见图1)。
2.CBS对SNI模型大鼠脊髓和DRG的NF-κB mRNA表达的影响
在CBS (30 g/kg) 灌胃治疗28天后,与Sham组比较,SNI组大鼠脊髓和DRG中NF-κB p65 mRNA表达明显增加(P< 0.05);与SNI组比较,SNI +CBS组大鼠脊髓和DRG中NF-κB p65 mRNA表达明显减少 (P< 0.05,见图 2)。
3.CBS对SNI模型大鼠脊髓及DRG的IL-1β、IL-6和TNF-αmRNA表达的影响
在CBS (30 g/kg)灌胃治疗28天后,与Sham组相比,SNI组大鼠脊髓和DRG中IL-1β、IL-6和TNF-α的mRNA表达均明显增加 (P< 0.05,P< 0.01);与SNI组相比,SNI + CBS组脊髓及DRG的IL-1β、IL-6和TNF-α的 mRNA表达显著降低 (P< 0.05,P< 0.01,见图 3)。
4.CBS对SNI模型大鼠脊髓和DRG核内NF-κB蛋白表达的影响
在CBS (30 g/kg) 灌胃治疗28天后,与Sham组比较,SNI组大鼠脊髓及DRG中NF-κB蛋白表达明显增加 (P< 0.05);与SNI组相比,SNI + CBS组脊髓及背根神经节的NF-κB蛋白表达均显著下降(P< 0.05,P< 0.01,见图 4)。
5.CBS对SNI模型大鼠脊髓及DRG的IL-1β、IL-6和TNF-α蛋白表达的影响
CBS (30 g/kg)灌胃治疗28天后,与Sham组相比,SNI组大鼠脊髓和DRG中IL-1β、IL-6和TNF-α蛋白表达均明显增加 (P< 0.05,P< 0.01);与 SNI组相比,SNI + CBS组脊髓及DRG的IL-1β、IL-6和 TNF-α蛋白表达显著降低 (P< 0.05,P< 0.01,见图 5)。
讨 论
神经病理性疼痛是临床常见病,其病因多样,发病机制复杂,临床治疗并无有效根治方法。进一步阐明神经病理性疼痛的致痛信号转导机制,并以此研发新型有效治疗药物已成为目前国内外疼痛医学基础及临床研究亟待解决的难题。
臭牡丹是一种传统中草药,具有祛风解毒,消肿止痛的功效。已有实验显示臭牡丹根提取液具有较强的镇痛作用,且该作用不能被纳络酮所阻断,提示臭牡丹是通过非阿片受体来发挥镇痛效应的[10]。进一步研究发现臭牡丹正丁醇提取物可显著抑制佐剂性关节炎大鼠的急性和继发性足肿胀[14],且明显抑制NP大鼠IL-1β、TNF-α的表达[11]。因此,我们在SNI所致的神经病理性疼痛模型上探讨臭牡丹对其痛敏行为的影响及可能的作用机制。
SNI模型是外周神经损伤所诱导神经病理性疼痛的经典模型之一,该模型因可高度反映临床疼痛综合征的一些特点而得到广泛运用[13]。我们实验发现SNI术后动物均存在术侧后肢明显的痛觉超敏,表现为对机械刺激的异常敏感。给予30 g/kg CBS持续灌胃28 天后PWT显著上升,提示CBS可缓解SNI所致的神经病理性疼痛大鼠机械痛敏。
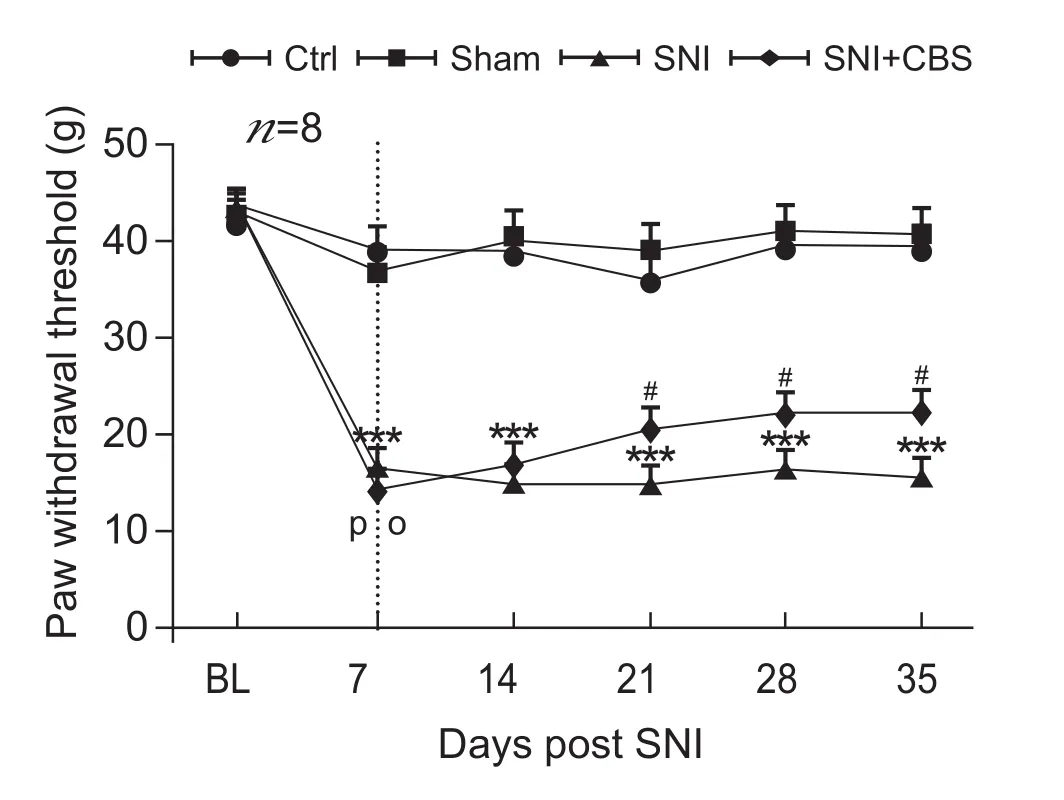
图1 CBS对SNI模型大鼠机械缩足反射阈值 (PWT) 的影响(±SD)与Sham组比较,***P < 0.001;与SNI组比较,#P < 0.05Fig.1 Effects of CBS on mechanical paw withdrawal threshold (PWT) in rats with spared nerve injury (SNI)(±SD)***P < 0.001,compared to Sham group,#P < 0.05,compared to SNI group.
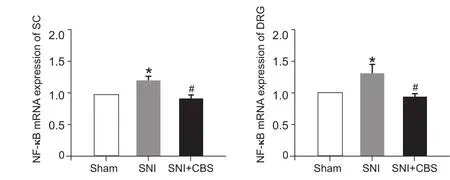
图2 CBS对SNI大鼠脊髓及DRG中NF-κB mRNA表达的影响 (n = 5,±SD)与Sham组比较,*P < 0.05;与SNI组比较,#P < 0.05Fig.2 qPCR analysis of NF-κB mRNA expression in the L4-L6 spinal cord and DRG (n = 5,±SD)*P < 0.05,compared to Sham group,#P < 0.05,compared to SNI group.
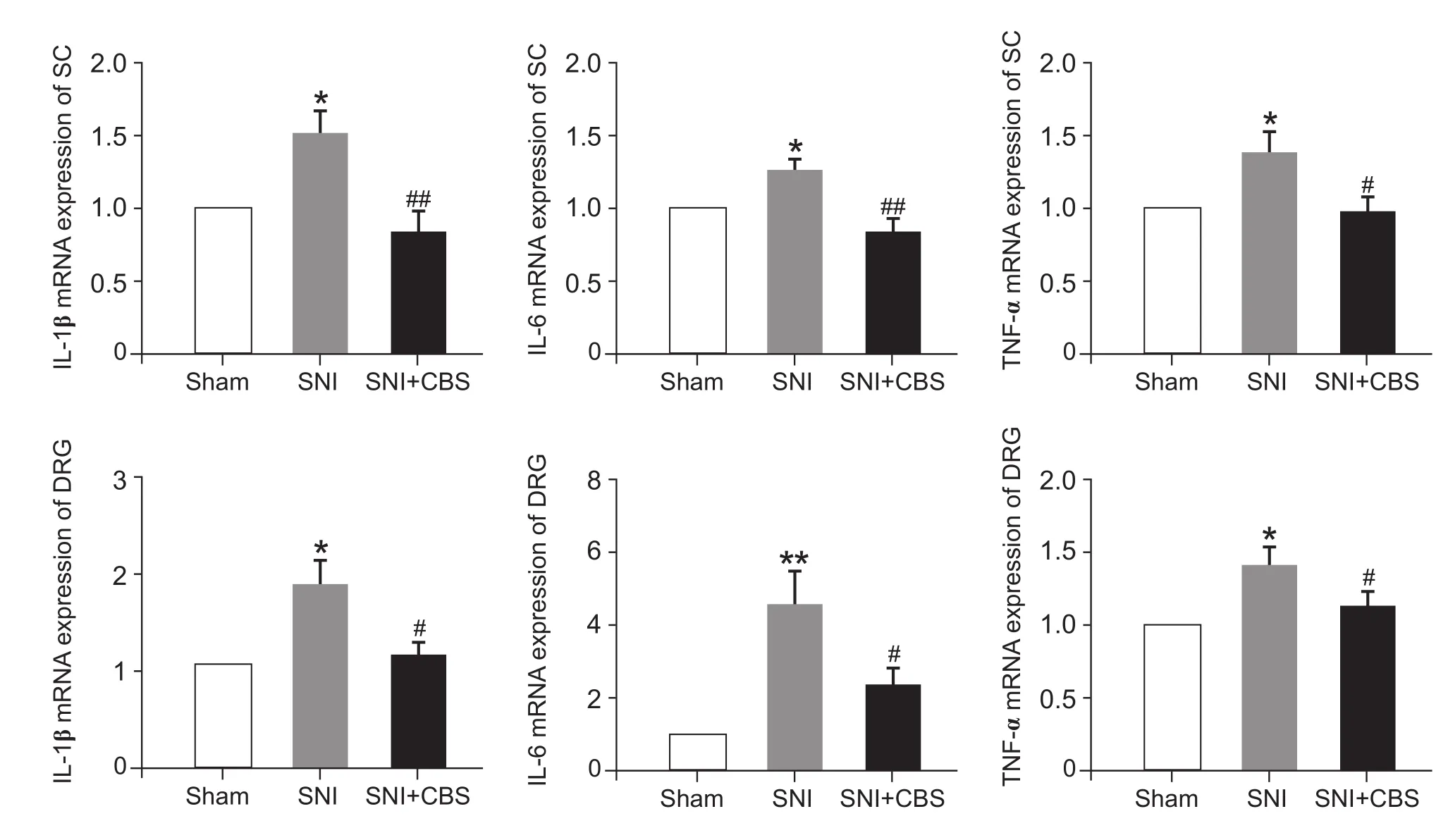
图3 CBS对SNI大鼠脊髓及DRG中IL-1β、IL-6和TNF-α mRNA表达的影响 (n = 5,±SD)与 Sham 组比较 ,*P < 0.05,**P < 0.01;与 SNI组比较 ,#P < 0.05,##P < 0.01Fig.3 qPCR analysis of IL-1β,IL-6 and TNF-α mRNA expression in the L4-L6 spinal cord and DRG (n = 5,±SD)*P < 0.05,**P < 0.01,compared to Sham group,#P < 0.05,##P < 0.01,compared to SNI group.
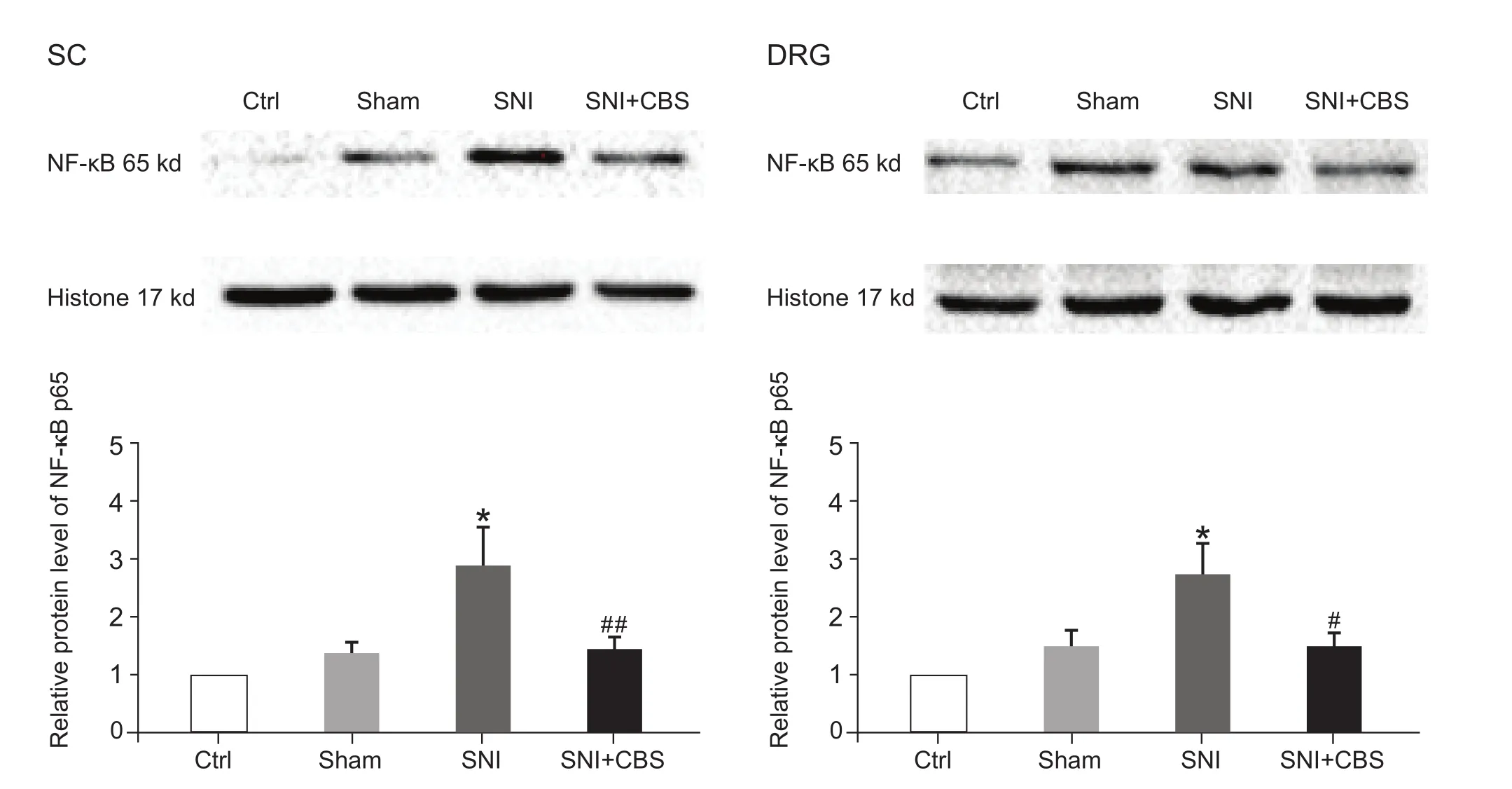
图4 CBS对SNI大鼠脊髓及DRG中核内NF-κB蛋白表达的影响(n = 8,±SD)与 Sham 组比较 ,*P < 0.05;与 SNI组比较 ,#P < 0.05,##P < 0.01Fig.4 Western blot analysis of NF-κB protein expression in the L4-L6 spinal cord and DRG (n = 8,±SD)*P < 0.05,compared to Sham group,#P < 0.05,##P < 0.01,compared to SNI group.
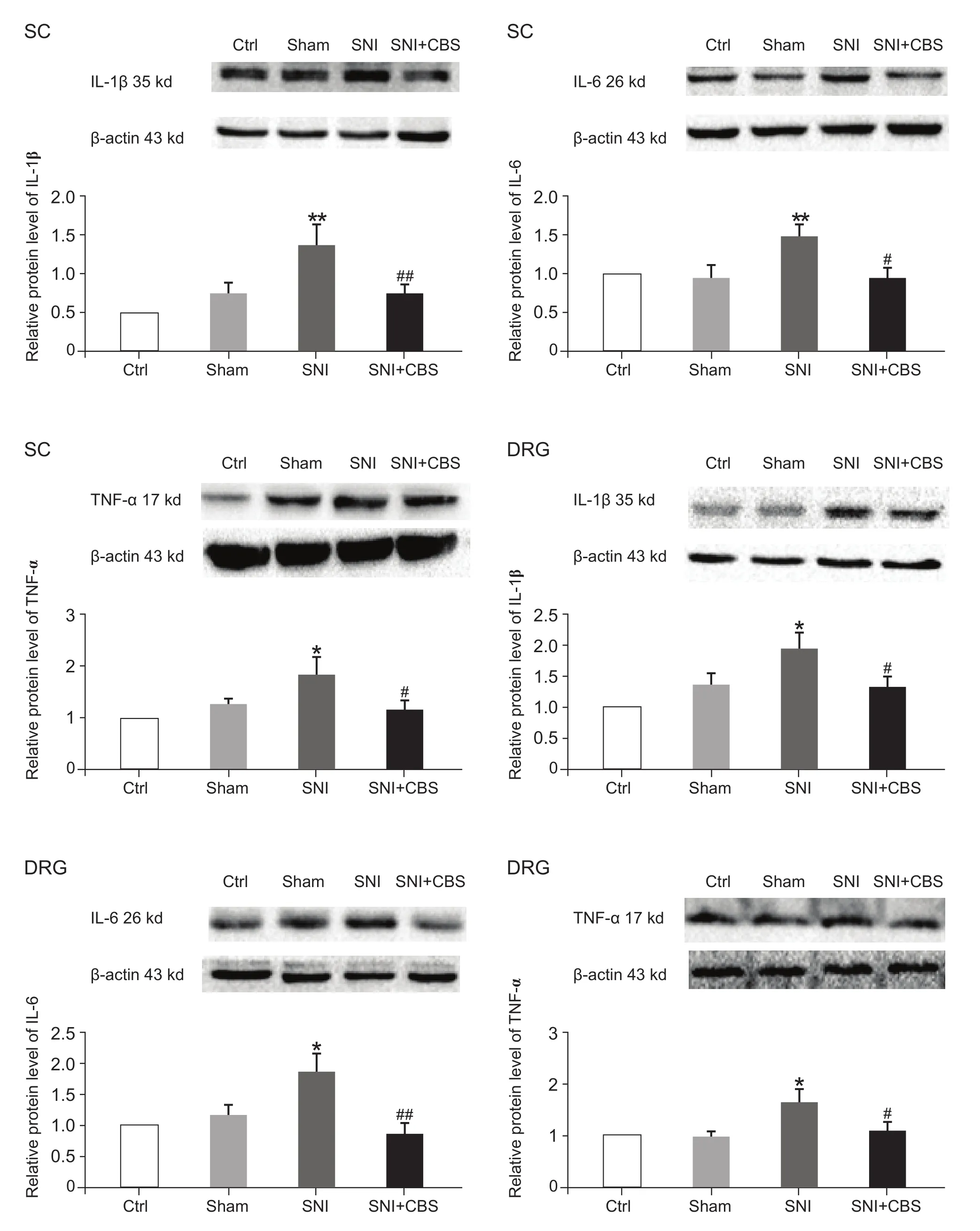
图5 CBS对SNI大鼠脊髓及DRG中核内IL-1β,IL-6和TNF-α蛋白表达的影响 (n = 8,±SD)与 Sham 组比较 ,*P < 0.05,**P < 0.01;与 SNI组比较 ,#P < 0.05,##P < 0.01Fig.5 Western blot analysis of IL-1β、IL-6 and TNF-αprotein expression in the L4-L6 spinal cord and DRG (n = 8,±SD)*P < 0.05,**P < 0.01,compared to Sham group,#P < 0.05,##P < 0.01,compared to SNI group.
神经病理性疼痛的形成和发展是多个因素相互级联的复杂过程。多重证据表明促炎细胞因子参与神经病理性疼痛的发生与维持过程,其中IL-1β、IL-6、TNF-α与疼痛关系尤为密切[5]。研究表明,在伤害性刺激作用下,组织受损伤后神经胶质细胞激活后释放相应促炎细胞因如IL-1β、IL-6和TNF-α的表达显著升高[15~17],在实验研究中我们观察到SNI大鼠脊髓和DRG中 IL-1β、IL-6和TNF-α的mRNA表达水平均明显升高;而给予30 g/kg CBS持续28天灌胃后可显著降低IL-1β、IL-6 和TNF-α的mRNA及蛋白的表达,这与Wang X、Gopalsamy等学者的研究结果具有一致性[15~17]。以上我们的研究结果提示CBS可能通过下调IL-1β、IL-6以及TNF-α的基因和蛋白表达来抑制外周和中枢炎症反应,减轻中枢敏化,从而缓解NP的痛敏行为。
此外,在促炎细胞因子(TNF-α、IL-1β、IL-6等)、细菌和病毒等刺激下,NF-κB被激活,活化的NF-κB又可调控IL-1β、IL-6和TNF-α等基因的表达[7,8],两者构成一种反馈机制共同促进神经病理性疼痛的维持与发展[18,19]。为观察CBS对SNI诱导的神经病理性疼痛大鼠NF-κB的变化影响,我们采用qPCR和Western Blot方法检测大鼠脊髓和DRG NF-κB的mRNA及细胞核内蛋白表达变化情况。实验结果表明经大鼠术侧坐骨神经分支部分结扎剪断后,脊髓和DRG NF-κB的mRNA及蛋白表达均显著增加,而CBS灌胃给药28天后,NF-κB的mRNA及蛋白表达显著下调,为此,我们认为CBS可能是通过抑制NF-κB信号通路来发挥对NP的镇痛作用。缘由神经病理性疼痛的发病机制是多因素、多条信号通路相互级联的复杂过程,要完全明确CBS对神经病理性疼痛的镇痛机制,仍需进一步的实验研究加以证实。
综上所述,基于文献报道和我们的实验结果,提示CBS作用于神经病理性疼痛的可能机制是通过抑制NF-κB信号途径,进而抑制NF-κB信号分子所诱导的炎症介质致炎细胞因子(TNF-α,IL-1β,IL-6)的mRNA和蛋白表达来实现的。
参 考 文 献
[1]邢国刚.神经病理性疼痛的新定义.中国疼痛医学杂志 ,2011,17(10): 595 ~ 596.
[2]JensenTS,FinnerupNB.Allodynia and hyperalgesia in neuropathic pain: Clinical manifestations and mechanisms.Lancet Neurol,2014,13: 924 ~ 935.
[3]van Hecke O,Austin SK,Khan RA,et al.Neuropathic pain in the general population: a systematic review of epidemiological studies.Pain,2014,155:654 ~ 662.
[4]Attal N,Bouhassira D.Pharmacotherapy of neuropathic pain: Which drugs,which treatment algorithms? Pain,2015,156: S104 ~ S114.
[5]Hung AL,Lim M,Doshi TL.Targeting cytokines for treatment of neuropathic pain.Scand J Pain,2017,17:287 ~ 293.
[6]Nadeau S,Filali M,Zhang J,et al.Functional recovery after peripheral nerve injury is dependent on the proinflammatory cytokines IL-1β and TNF: implications for neuropathic pain.J Neurosci,2011,31:12533-12542.
[7]Su P,Liu X,Pang Y,et al.The archaic roles of the lamprey NF-κB (lj-NF-κB) in innate immune responses.Mol Immunol,2017 ,92: 21 ~ 27.
[8]Zhang Q,Yu J,Wang J,et al.The Red Nucleus TNF-a Participates in the Initiation and Maintenance of Neuropathic Pain Through Different Signaling Pathways.Neurochem Res,2015,40:1360 ~ 1371.
[9]中国科学院中国植物志编辑委员会.中国植物志.科学出版社,2004,65: 176.
[10]刘建新,周俐,周青,等.臭牡丹根正丁醇提取物镇痛作用的研究.中国疼痛医学杂志,2007,13(6): 349 ~ 352.
[11]邹晓琴,欧阳娟,黄诚,等.臭牡丹根提取物对神经病理性疼痛的镇痛作用.时珍国医国药,2013,24(1):12 ~ 14.
[12]王春娟,左国营,王根春,等.26种云南中草药的体外抗菌活性筛选.中华中医药杂志,2014,29:113 ~ 116.
[13]Decosterd I,Woolf CJ.Spared nerve injury: an animal model of persistent peripheral neuropathic pain.Pain,2000,87:149 ~ 158.
[14]刘建新,周青,周俐,等.不同剂量臭牡丹根对大鼠佐剂性关节炎不同时点的干预效应: 与氢化可的松相比较.中国临床康复,2005,9: 144 ~ 145.
[15]Wang X,Zhang G,Qiao Y,et a1.Crocetin attenuates spared nerve injury-induced neuropathic pain in mice.J Pharmacol Sci,2017,135:141 ~ 147.
[16]Gopalsamy B,Farouk AAO,Tengku Mohamad TAS,et a1.Antiallodynic and antihyperalgesic activities of zerumbone via the suppression of IL-1β,IL-6,and TNF-α in a mouse model of neuropathic pain.J Pain Res,2017,10: 2605 ~ 2619.
[17]Carballo-Villalobos AI,González-Trujano ME,Pellicer F,et al.Central and peripheral anti-hyperalgesic effects of diosmin in a neuropathic pain model in rats.Biomed Pharmacother,2018,97: 310 ~ 320.
[18]Quintão NL,Balz D,Santos AR,et al.Long-lasting neuropathic pain induced by brachial plexus injury in mice: Role triggered by the pro-in fl ammatory cytokine,tumour necrosis factor alpha.Neuropharmacology,2006,50: 614 ~ 620.
[19]St Jacques B,Ma W.Role of prostaglandin E2 in the synthesis of the pro-in fl ammatory cytokine interleukin-6 in dorsal root ganglion neurons: an in vivo and in vitro study.J Neurochem,2011,118: 841 ~ 854.

