盐酸鲁拉西酮片的溶出研究
王文娣 刘文丽


摘 要 目的:比较自制盐酸鲁拉西酮片与原研药溶出行为。方法:分别测定自制盐酸鲁拉西酮片和原研药在pH 1.2盐酸溶液、pH 3.8 Mcllvaine缓冲溶液、水、pH 6.8磷酸盐缓冲溶液中的溶出曲线,并计算相似因子(f2)。结果:自制盐酸鲁拉西酮片与原研片剂在pH 1.2的盐酸溶液和水中的溶出相似因子f2分别为60、64,在pH 3.8的稀释的Mcllvaine缓冲溶液中15 min的累积溶出度均大于85%、而两者在pH 6.8的磷酸盐缓冲溶液中几乎都不溶出。结论:自制盐酸鲁拉西酮片与原研片剂的溶出行为相似。
关键词 精神分裂症 盐酸鲁拉西酮 累积溶出度 相似因子
中图分类号:R927.11; R971.41 文献标志码:A 文章编号:1006-1533(2018)07-0073-04
Study on dissolution of lurasidone hydrochloride tablets
WANG Wendi*,LIU Wenli
(Shanghai Pharmaceuticals Holding Co., Ltd., Shanghai 201203,China)
ABSTRACT Objective: To compare the dissolution behavior of home-made and original lurasidone hydrochloride tablets. Methods: The dissolution curves of lurasidone hydrochloride in different dissolution media such as hydrochloric acid solution(pH 1.2), diluted Mcllvaine buffer solution (pH 3.8), water and phosphate buffer solution (pH 6.8) were drawn after HPLC determination and the similarity factor (f2) was calculated. Results: The similarity factors of home-made and original lurasidone hydrochloride tablets in hydrochloric acid solution (pH 1.2) and water were 60 and 64 and their accumulative dissolutions at 15 min were over 85% in diluted Mcllvaine buffer solution (pH 3.8). However, both tablets were hardly dissolved in pH 6.8 phosphate buffer solution. Conclusion: The dissolution behavior of home-made lurasidone hydrochloride tablets is similar to that of the original tablets.
KEy WORDS schizophrenia; lurasidone hydrochloride; accumulative dissolution; similarity factor
精神分裂癥(schizophrenia)是一种常见的病因未完全阐明的精神疾病,多起病于青壮年,常有知觉、思维、情感和行为等方面的障碍,一般无意识及智能障碍。病程多迁延,约占精神科住院患者的一半以上,最终结局约一半左右患者出现精神残疾,为社会以及患者和家属带来严重的负担。盐酸鲁拉西酮(lurasidone hydrochloride,商品名:Latuda)是由日本住友制药公司开发的一种新型有双重作用的非典型抗精神病药,由美国FDA于2010年10月29日批准上市,用于治疗精神分裂症[1-3]。已有相关文献报道关于盐酸鲁拉西酮片的溶出及HPLC测定方法,但未见自制普通片剂与原研片剂在不同溶出介质中的溶出行为的全面比较[4-6]。本研究旨在全面比较仿制盐酸鲁拉西酮片与原研片剂在各溶出介质中的溶出行为。
1 材料和方法
1.1 仪器与试药
AT7 smart型智能自动溶出仪(Sotax公司);BSA224S型电子天平(Sartorius公司);安捷伦1260型高效液相色谱仪(Agilent公司);DP301型单冲压片机(北京国药龙立科技有限公司)。
1.2 样品与试剂
盐酸鲁拉西酮原料及对照品(常州制药厂,纯度:99.6%);原研盐酸鲁拉西酮片40 mg(批号:J0390130,日本住友制药有限公司);甘露醇(法国罗盖特公司);淀粉(上海卡乐康包衣技术有限公司);交联羧甲基纤维素钠、硬脂酸镁(安徽山河药用辅料股份有限公司);微粉硅胶(Evonik Industries AG);羟丙甲纤维素E5(陶氏化学公司);其余试剂均为化学纯,购自国药集团化学试剂有限公司。
1.3 方法
1.3.1 自制盐酸鲁拉西酮片
取气流粉碎后的原料药盐酸鲁拉西酮(处方比例25%,粒径分布:d(0.1)0.572 μm、d(0.5)1.892 μm、d(0.9)4.498 μm)与处方量的填充剂甘露醇(60%)、淀粉(9%),崩解剂交联羧甲基纤维素钠(3%)过80目筛混合均匀,加入适量3%(w/v)羟丙甲纤维素E5水溶液作为粘合剂制软材,30目不锈钢筛网制粒,流化床干燥,30目不锈钢筛网整粒,加入助流剂微粉硅胶、润滑剂硬脂酸镁混合均匀,压片即得。
1.3.2 溶液配制
1)对照品溶液 取盐酸鲁拉西酮对照品,精密称定,加适量甲醇超声溶解并用相应溶出介质定量稀释制成每1 ml中约含50 μg盐酸鲁拉西酮的溶液,作为对照品溶液。
2)供试品溶液 取本品片剂,照1.3.4制备方法,取溶出续滤液作为供试品溶液。
3)溶出介质溶液 按照《普通口服固体制剂溶出曲线测定与比较的指导原则》中的溶出介质配制。
4)pH 1.2盐酸溶液 量取盐酸7.65 ml,加水定容至1 000 ml,摇匀即得。
5)pH 3.8的Mcllvaine缓冲溶液 将1 000 ml 0.1 mol/L柠檬酸溶液与625 ml 0.1 mol/L磷酸氢二钠溶液混合,将pH调至3.8。
6)pH 6.8磷酸盐缓冲溶液 称取磷酸二氢钾7.8 g、氢氧化钠0.9 g,加水稀释至1 000 ml,即得。
1.3.3 色谱条件
采用高效液相色谱法,用十八烷基硅烷键合硅胶为填充剂,以甲醇-0.06% TFA水=60∶40为流动相,柱温30 ℃,检测波长为230 nm,加样量为10 ml,注入液相色谱仪测定并记录色谱图。按外标法以峰面积计算每片的溶出量及累积溶出百分率。
1.3.4 溶出度实验
取自制盐酸鲁拉西酮片6片,照溶出度测定法浆法测定[7],分别以pH 1.2的盐酸溶液、pH 3.8的稀释的Mcllvaine缓冲溶液、水、pH 6.8的磷酸盐缓冲溶液各900 ml作为溶出介质,转速为50 r/min,依法操作,在10、15、20、30、45、60 min时取溶液适量滤过,取续滤液进行液相色分析;另取盐酸鲁拉西酮对照品,精密称定,加适量甲醇超声溶解并用相应溶出介质定量稀释成50 μg/ml的溶液,同法测定,计算每片的累积溶出度。原研片剂同上述操作。
2 结果
2.1 HPLC方法测定溶出度的验证
2.1.1 线性与范围
线性验证范围定为样品溶液浓度的20%~120%,以满足溶出曲线的测定范围,在此范围内制备5个浓度水平的溶液,分别注入液相色谱仪测定并记录色谱图。在4.96~59.52 mg/ml浓度范围内,以盐酸鲁拉西酮浓度为横坐标,峰面积为纵坐标,求得线性方程为y=230 738 429.8x+36 283.0,相关系数r2=0.999 9,表明在该浓度范围内,线性关系良好。
2.1.2 准确度
向空白辅料中加入已知量的对照品,配制三个浓度水平、每个浓度水平三份溶液进行测定,并计算其回收率。
三个浓度水平的9份准确度样品溶液的回收率均在98%~101%之间,RSD为0.4%,表明方法的准确度符合要求。
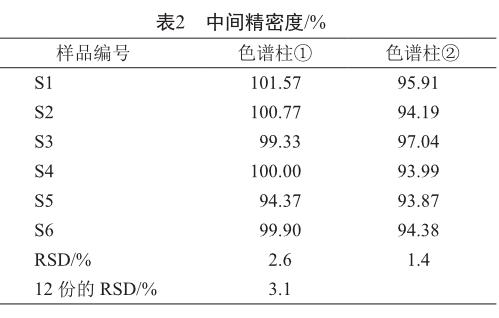
2.1.3 重复性及中间精密度
平行配制6个供试品溶液进行测定,不同的仪器、色谱柱在不同时间进行测定,结果表明重复性及中间精密度良好(表2)。
2.1.4 稳定性
考察对照品溶液和样品溶液随时间变化的规律,在自然环境下,将容量瓶中的对照溶液和测试溶液放置一定时间后,再用新鲜配制的对照溶液考察其检测结果的变化。
对照溶液及样品溶液室温放置3 d,由测定结果得出RSD分别为0.35%和0.26%,表明两者在3 d内稳定性良好(表3)。
2.2 不同介质中的溶出曲线
1)pH 1.2的盐酸溶液 自制鲁拉西酮片与原研片在该溶出介质中的累积溶出度(n=6)见图1A,经过计算f2=60,大于50,可认为两者溶出行为相似。
2)pH 3.8的稀释的Mcllvaine缓冲溶液 自制鲁拉西酮片与原研片在该溶出介质中的溶出累积溶出度见图1B,在15 min内均大于85%,可认为两者溶出行为相似。
3)水溶液 自制鲁拉西酮片与原研片在水溶液中的累积溶出度(n=6)见图1C,经过计算f2=64,大于50,可认为两者溶出行为相似。
4)pH 6.8的磷酸盐缓冲溶液 自制鲁拉西酮片与原研片在该介质中的都几乎不溶出(n=6,图1D),可认为两者溶出行为相似。
3 讨论
由于盐酸鲁拉西酮是难溶性药物[9-10],原研药物生产公司在中国申请了专利CN101184489B[11]并得到了授权。专利内容着重对处方中预胶化淀粉的使用申请了专利保护,并在实施例中强调了必须包含预胶化淀粉,如果用普通淀粉代替之溶出度将无法达到要求。但我们设计的处方没有使用预胶化淀粉而是使用了普通淀粉。我们发现,采用未微粉化處理的原料制备的制剂溶出速度确实较慢于原研制剂,尤其以pH 3.8的稀释的Mcllvaine缓冲溶液作为溶出介质的溶出曲线区分力更强。然后,将原料药通过气流粉碎机进行了微粉化,并通过对淀粉用量及其他辅料的筛选优化确定了处方,这样制备的片剂改善了制剂的溶解度及溶出度,达到了和原研制剂同样的溶出行为,同时避开了专利保护内容。但发现原料微粉化后静电较大,在处理过程中易产生损失,在后续研究中可尝试研究消除静电的技术或其他可改善难溶性药物溶解度及溶出度的方法,比如制备固体分散体[12]或口崩片[13]等新剂型、新技术。
通过对原料微粉化后自制的盐酸鲁拉西酮片外观光滑,硬度适中,该处方及工艺简单可行,自制片剂的溶出行为与原研药相似,具有较稳定的质量可控性,这为以后开发盐酸鲁拉西酮的新剂型提供了更多的参考。
参考文献
[1] 封宇飞. 抗精神病新药鲁拉西酮的药理与临床研究进展[J]. 中国新药杂志, 2011, 20(10): 853-856.
[2] 董佳丽, 常艳玲, 黄震, 等. 新型非典型抗精神病药物的应用及研究进展[J]. 上海医药, 2015, 36(7): 53-56.
[3] Jaeschke RR, Sowa-Ku?ma M, Pańczyszyn-Trzewik P, et al. Lurasidone: The 2016 update on the pharmacology, efficacy and safety profile[J]. Pharmacol Rep, 2016, 68(4): 748-755.
[4] 楊旭红, 韦永吉, 曹丽芸. HPLC法测定盐酸鲁拉西酮片中有效成分的含量[J]. 化学试剂, 2015, 37(11): 1015-1017.
[5] 刘翠艳, 李清娟, 樊俊红, 等. HPLC法测定盐酸鲁拉西酮片的含量[J]. 中国药师, 2014, 17(9): 1483-1485.
[6] 樊俊红, 郭文敏, 刘峰, 等. 盐酸鲁拉西酮片的溶出度研究[J]. 中国药房, 2014, 25(9): 837-839.
[7] 国家药典委员会. 中华人民共和国药典2015版四部[M].中国医药科技出版社, 2015: 121-124.
[8] 谢沐风. 对“口服固体制剂仿制药质量一致性评价技术手段——多条溶出曲线”的理解[J]. 中国药物评价, 2013, 30(2): 65-66, 69.
[9] 刘艳红, 唐维, 郭芬, 等. 盐酸鲁拉西酮在不同溶剂及不同温度下的溶解度测定[J]. 中国现代药物应用, 2015, 9(10): 265-267.
[10] Shah S, Parmar B, Soniwala M, et al. Design, optimization, and evaluation of lurasidone hydrochloride nanocrystals[J]. AAPS PharmSciTech, 2015, 17(5): 1150-1158.
[11] 富士原和之. 药物组合物: CN101184489[P]. 2008-05-21.
[12] 赵海涛, 宋光西, 殷学治, 等. 盐酸鲁拉西酮固体分散体的制备、表征及体外溶出行为研究[J]. 中国药房, 2017, 28(34): 4876-4878.
[13] 朱强, 刘浪, 张启余, 等. 盐酸鲁拉西酮口崩片与普通片的体外溶出对比研究[J]. 中国新药杂志, 2016, 25(14): 1636-1640.

