腺病毒介导的RNA干扰ERCC1基因表达对卵巢癌顺铂化疗的增敏作用
田丽娜,瞿全新,盛晓滨,徐福强
卵巢癌在所有妇科肿瘤中发病率最高,危害较大。顺铂是卵巢癌化疗的一线药物,在卵巢癌综合治疗中占有重要地位。目前普遍认为,DNA损伤是癌症发病的重要机制,顺铂细胞毒作用主要是形成铂-DNA加合物,ERCCl基因是DNA损伤修复途径的关键基因,其表达升高与卵巢癌顺铂耐药的发生密切相关。RNA干扰能够作为一种简单、有效地代替基因敲除的遗传工具,哺乳动物中起作用的是小干扰RNA(siRNA),在卵巢癌细胞中成功调控ERCC1基因表达,hTERT启动子作为肿瘤特异性启动子已经被广泛用于靶向转录基因治疗研究中,本实验采用5型腺病毒基因重组而成的腺病毒载体,通过RNA干扰技术阻断ERCC1基因的表达来增强卵巢癌细胞的DDP敏感性,为基因治疗克服卵巢癌耐药提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 细胞系 人卵巢浆液性乳头状囊腺癌细胞株SKOV3,由天津医科大学免疫学试验室提供。
1.1.2 相关试剂及耗材 注射用顺铂(冻干型):齐鲁制药厂(批号H20023461)。重组腺病毒:Ad-hTERT-ERCCl-siRNA及只包含ERCC1启动子的重组腺病毒Ad-hTERT由本研究小组前期合成[1]。RPMI-1640培养基:天津圣东生物科技发展公司(批号BW12014)。小牛血清:中美合资兰州民海生物工程有限公司(批号200110203)。
1.2 实验方法
1.2.1 细胞培养条件 卵巢癌细胞株SKOV3细胞用含10%牛血清的RPMIl640培养液培养,在37 ℃、5%CO2、相对湿度90%的培养箱中培养,细胞为贴壁生长细胞,按1∶2或1∶3传代。
1.2.2 药物配置 顺铂用生理盐水配成1 mg/ml的贮存液,腺病毒置于-20 ℃冰箱保存。
1.2.3 台盼蓝排斥试验 取2×104/ml的SKOV3细胞接种于24孔板,每孔l ml,根据台酚蓝试剂盒染色操作方法,每隔24 h染色3个孔内细胞,计数活细胞数, 求平均值,连续计数7 d,绘制细胞生长曲线。根据阮和云等[2]的实验方法计算细胞倍增时间。
1.2.4 MTT法测定SKOV3细胞顺铂IC50值 实验组取对数生长期SKOV3细胞,经消化后以4.4×104/ml的细胞浓度加入到96孔板中,每孔180 pl。培养24 h后,顺铂(DDP)等比稀释后分别加入96孔板中,分为6个浓度,其终浓度分别为50、25、12.5、6.25、3.125、1.5625 μg/ml。每一浓度设4个平行孔,同时设立阴性对照组(只含等体积细胞悬液,不加药物)、空白调零孔(只含等体积完全培养基,不加药物)。培养72 h后,MTT法测573 nm处OD值。顺铂对SKOV3细胞的抑制率=[1-(实验组OD-空白调理组OD)/(阴性对照组OD-空白调零组OD)]×100%。实验重复3遍,取平均值。根据刘国艳等[3, 4]的方法计算IC50。
1.2.5 MTT法测定不同感染复数的腺病毒对SKOV3细胞的影响 实验组取对数生长期SKOV3细胞,经消化后以8×104/ml的细胞浓度加入到96孔板中,每孔100 μl。培养24 h后,分别用0、1、10、20、30、40、50、60、70感染复数(multiplicity of infection, MOI)的重组腺病毒感染细胞,设4个复孔,同时阴性对照组按照上述方法加入腺病毒(Ad-hTERT)。培养2 d后,MTT法测573 nm处OD值。腺病毒对SKOV3细胞生长的抑制率=(1-实验组OD值/MOI 0组OD值)×100%。实验重复3遍,取平均值[3, 5]。
1.2.6 MTT法测定不同感染复数腺病毒对SKOV3细胞顺铂IC50值的影响 实验组取对数生长期SKOV3细胞,经消化后以8×104/ml浓度加入到96孔板中,每孔100 μl。培养24 h后,分别用l、10、50、80感染复数的重组腺病毒感染细胞,每孔180 μl。同时阴性对照组(只含等体积细胞悬液,不加药物)、空白调零孔(只含等体积完全培养基,不加药物)。每组设24个复孔。12 h后,每组细胞分别加入不同浓度DDP,每组最终设4个复孔。培养72 h,计算不同感染复数腺病毒作用下SKOV3顺铂IC50值。实验重复3遍,取平均值。
1.2.7 细胞凋亡的形态学观察 取1×105/ml浓度、对数生长期SKOV3细胞,每孔500 μl接种于24孔板内,培养24 h后,分别用1、10、50、80感染复数的腺病毒感染细胞,同时阴性对照组(只含等体积细胞悬液,不加病毒)。每一感染复数设2个复孔,分为2组。培养4 h后,其中一组细胞加入顺铂,调整终浓度为4 μg/ml,培养24 h后,按照Hoechst试剂盒方法固定染色[5],于荧光显微镜下观察并拍照。实验重复3遍。
1.2.8 流式细胞技术测定DDP及不同浓度腺病毒作用的细胞周期与凋亡 将生长良好的SKOV3细胞,以1.6×105/ml浓度6 ml传代至新培养瓶中,共11瓶,培养24 h后,加入治疗药物,分组方法为:(1)Ad-HTERT-ERCCl-siRNA组,添加重组腺病毒MOI 0、1、10、50、80;(2)病毒联合顺铂组,在(1)的基础上添加终浓度为4 μg/ml的顺铂;(3)空载体病毒(Ad-HTERT)联合顺铂组,在顺铂终浓度为4 μg/ml的基础上添加空载体病毒MOI 50。以上各组细胞培养24 h后终止,收集细胞处理后,按流式细胞试剂盒操作方法,测定细胞凋亡和周期分布[6]。
1.3 统计学处理 采用SPSS 19.0统计软件进行统计学分析,生长曲线图采用折线图方法绘制,回归方程及IC50值采用回归分析计算,均数比较采用单因素方差分析。顺铂浓度与抑制率关系及腺病毒浓度与细胞对顺铂的敏感性关系采用相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 SKOV3细胞培养 SKOV3细胞培养前5 d逐渐增多,5 d后趋于平缓(图1)。

图1 SKOV3细胞生长曲线及形态
A.对数生长期细胞生长曲线;B.SKOV3细胞对数生长期形态(台酚蓝,×400)
2.2 顺铂和腺病毒对SKOV3细胞的影响 SKOV3细胞给予顺铂处理后,随着顺铂浓度的增加,SKOV3细胞的存活数量进行性下降,细胞抑制率逐渐升高,顺铂浓度与SKOV3细胞抑制率呈线性正相关(图2,A),相关系数r=0.9905(P<0.05),顺铂IC50值为(7.76±0.37)μg/ml。而SKOV3细胞给予腺病毒处理后,对照组(Ad-HTERT)SKOV3细胞的存活数量无明显改变。而实验组中,随着感染复数的逐渐增加,SKOV3细胞的存活数量逐渐减少,细胞抑制率逐渐升高(图2,B),两组间具有统计学差异(P<0.05)。

图2 顺铂和腺病毒对SKOV3细胞的影响
A.顺铂对SKOV3细胞的抑制率;B.对照组与试验组对SKOV3细胞抑制率
2.3 腺病毒对SKOV3细胞顺铂敏感性的影响 对照组中SKOV3在感染了空载体腺病毒(Ad-HTERT)后,IC50无明显变化(图3A)。对顺铂的敏感性无明显增加(图3B)。实验组中SKOV3细胞在感染了抑制ERCCl基因表达的腺病毒后,IC50进行性下降,并且呈浓度相关性(r=0.9943,P<0.05)(图3A)。SKOV3细胞对顺铂的敏感性随病毒浓度的增加而增加,分别增加了9.4%(t=5.060,P<0.05)、16.4%(t=10.763,P<0.05)、23.2%(t=23.175,P<0.05)、33.5%(t=16.809,P<0.05)(图3B)。

图3 腺病毒对SKOV3细胞顺铂敏感性的影响
A.两组病毒感染SKOV3细胞后DDP的IC50变化;B.对照组与试验组对SKOV3 DDP敏感性的影响
2.4 细胞凋亡和周期测定 本实验测得SKOV3细胞G1、S和G2/M期细胞分别为28.12%、58.02%和13.87%,凋亡率为15.34%(图4和图5A)。
对于SKOV3细胞,不同感染复数的Ad-HTERT-ERCCl-siRNA感染SKOV3细胞后,细胞周期左移,G1期比例增加,S期比例减少,G2/M期比例减少,细胞凋亡率有所增高(图4、5)。
单纯顺铂作用组的细胞周期明显右移,G1期细胞比例减少, S期细胞比例增高,G2/M期比例减少,细胞凋亡率增高,结果均具有统计学差异(P<0.05)。Ad-HTERT-ERCCl-siRNA联合顺铂作用下,细胞周期变化与单纯顺铂作用组相似,细胞凋亡率最高达对照组的2.66倍(40.76/15.34),结果均具有统计学差异(P<0.05)(图4、5)。空载体病毒(Ad-hTERT)联合顺铂作用下,与单独顺铂治疗组相比,细胞周期分布相近,细胞凋亡率无明显改变(图6),结果无统计学差异。

图4 单纯顺铂作用组与对照组SKOV3细胞不同细胞周期比例及凋亡率 A.G1期细胞比例;B.S期细胞比例; C.G2/M期细胞比例; D. 凋亡率
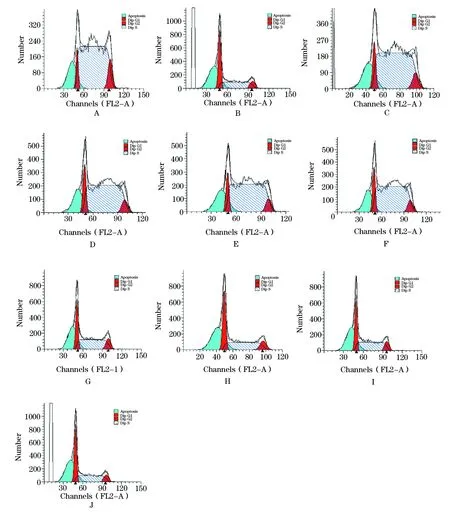
图5 Ad-HTERT-ERCCl-siRNA联合顺铂作用流式细胞结果
A.正常SKOV3细胞;B. 重组腺病毒MOI 1; C. 重组腺病毒MOI 10; D. 重组腺病毒MOI 50; E. 重组腺病毒MOI 80; F.DDP 4 μg; G. DDP 4 μg+重组腺病毒MOI 1; H. DDP 4 μg+重组腺病毒MOI 10; I. DDP 4 μg+重组腺病毒MOI 50; J. DDP 4 μg+重组腺病毒MOI 80

图6 空载体病毒联合顺铂与单独顺铂治疗组SKOV3细胞凋亡率
3 讨 论
顺铂是一种临床常用的肿瘤化疗药物,已经使用了近30年,可以抑制多种人类肿瘤[7]。顺铂的细胞毒作用主要是形成铂-DNA复合物,铂-DNA复合物能阻碍DNA的模板作用,抑制DNA的复制和转录,导致DNA的断裂和错误编码[8, 9]。顺铂等抗癌药物引起的DNA损伤主要通过NER途径修复,肿瘤细胞的顺铂敏感性与DNA损伤修复能力有关[10]。核苷酸切除修复是正常的细胞针对DNA链上较大损伤的主要修复过程,是清除铂类药物所致的DNA螺旋扭曲的主要机制,在NER过程中,铂类耐药的最为关键的因子是ERCC1[11],也是目前研究较多的DNA修复基因之一。ERCC1位于人类19号染色体上,参与了DNA链的切割和损伤识别。体内和体外研究表明,ERCC1的mRNA或者蛋白质表达水平的升高于卵巢肿瘤、膀胱肿瘤、消化道肿瘤、乳腺癌及肺癌等多种肿瘤的耐药性及化疗反应性密切相关[12-16]。因此针对DNA损伤修复途径采取策略为降低细胞的DNA损伤修复能力,可以增加肿瘤细胞的药物敏感性[17, 18]。
本试验采用本实验室前期合成的携带hTERT启动子的重组腺病毒载体感染卵巢癌细胞SKOV3,MTT实验结果表明空载体病毒对细胞生长无明显抑制作用,而重组腺病毒载体具有抑制细胞生长的作用,具有剂量依赖性,通过观察细胞形态变化发现,与正常细胞和空载体病毒组细胞相比,重组腺病毒载体感染的细胞变圆,体积稍大,细胞间的连接较疏松。提示抑制ERCCl基因表达,使肿瘤细胞生长受到一定的抑制,抑制率为1%~30%,表明ERCCl基因蛋白在维持肿瘤细胞生长中发挥一定的作用[1,3]。
通过体外药敏试验证实,感染空载体腺病毒的细胞IC50无明显改变,肿瘤细胞对顺铂的敏感性无明显增加,增加剂量后亦无明显改变。重组腺病毒可增加SKOV3的顺铂敏感性,且随着病毒感染复数的增加,肿瘤细胞杀伤作用增强。与感染空载体腺病毒的细胞相比,SKOV3细胞在感染了逐渐增加感染复数的重组腺病毒后,肿瘤细胞IC50逐渐下降,肿瘤细胞对顺铂的敏感性分别增加了9.4%、16.4%、23.2%、33.5%,提示重组腺病毒对SKOV3具有顺铂增敏作用,并且呈剂量依赖性。
流式细胞技术检测单纯重组腺病毒处理后,SKOV3细胞周期和凋亡率发生改变,G1期比例增大,S期比例减小,G2/M期比例减小,细胞凋亡率有所增高,表明腺病毒具有G1期阻滞和促进SKOV3细胞凋亡的作用,重组腺病毒联合DDP处理SKOV3细胞后,与单纯顺铂处理组相比,G1期细胞比例明显减少,S期细胞比例明显增加;G2/M期比例减少,细胞凋亡率显著增高,表明重组腺病毒可通过调节DDP对SKOV3的S期阻滞及促进肿瘤细胞凋亡等途径增强DDP的化疗敏感性。而空载体病毒联合顺铂作用下,与单独顺铂治疗组相比,细胞周期分布相近,不增加细胞凋亡。表明空载体病毒不影响顺铂对于SKOV3细胞周期的作用。
综上所述,重组腺病毒可以增加顺铂对肿瘤细胞的杀伤作用,其机制可能为重组腺病毒通过抑制DNA损伤的NER途径修复途径,增加了顺铂的S期阻滞作用,增强了顺铂的细胞DNA损伤效果,并同时促进细胞凋亡。并且本实验结果表明空载体腺病毒对于细胞周期及细胞凋亡无影响,是一种优良的基因载体。由此我们认为,以腺病毒为载体,以ERCCl为靶点进行基因治疗可提高卵巢癌顺铂化疗的敏感性,该方法可望成为提高卵巢癌化疗疗效的新方法。
【参考文献】
[1] 刘 微, 毕秋英,瞿全新,等.带hTERT启动子的腺病毒干扰ERCC1基因表达逆转卵巢癌顺铂耐药的研究[J]. 现代妇产科进展, 2012,21(4):246-249,254.
[2] 阮和云,黎丹戎,李 力,等.卵巢上皮性癌淋巴道定向高转移细胞系的建立及其生物学特性的鉴定[J].中华妇产科杂志, 2007,42(7):482-486.
[3] 刘国艳,瞿全新,糜若然,等.核苷酸切除修复交叉互补基因1与卵巢癌顺铂耐药的关系[J].中华肿瘤杂志, 2008,30(3):184-187.
[4] 刘萍萍,张灿珍,王羽丰.洛铂诱导顺铂耐药卵巢癌SKOV3/DDP细胞的凋亡[J].肿瘤防治研究, 2007,34(11):829-832.
[5] 刘素华.大黄素-8-O-β-D-葡萄糖苷对人卵巢癌细胞系SKOV3细胞凋亡及Bcl-2表达的影响[J].中华医学杂志, 2015, 95(43): 3541-3544.
[6] 陈 佳,王 琪,张 玮,等.下调MTRR基因表达对顺铂耐药的卵巢上皮性癌SKOV3细胞体内外生物学特性的影响[J].中华妇产科杂志, 2016,51(2):126-134.
[7] 王广洲,秦闫燕,卢 洁,等. miR-1271对卵巢癌SKOV3/DDP细胞顺铂耐药的影响及其机制[J].江苏大学学报(医学版), 2017, 27(2): 118-122.
[8] 马 焱,瞿全新,张秀艳. 腹腔热化疗中卵巢癌细胞对顺铂敏感性影响的体外研究[J].中国肿瘤临床, 2010, 37(20): 1153-1156.
[9] 李渊渊,何 华,曾 飚,等. 错配修复基因hMLH1和hMSH2的表达与人卵巢癌顺铂耐药的关系[J].中国肿瘤临床, 2011,38(15):875-881.
[10] 雷 婷,秦宜德,刘 琛,等.RNA干扰ERCC1基因表达对人卵巢癌耐药细胞 DDP、PGPIPN敏感性的影响[J].安徽医科大学学报, 2015,50(6):730-734.
[11] 刘晓玲,唐文如,罗 瑛.DNA修复与肿瘤的耐药[J].生命的化学, 2012,32(6):526-533.
[12] 郑国娜.ERCC1、ERCC2、ERBB1、ERBB2、P53在膀胱尿路上皮癌中的表达及意义[D],石家庄: 河北医科大学,2016.
[13] 王 娇,孙宏伟,柳 星,等.ERCC1和 TS 表达对胃癌术后患者改良FOLFOX7方案辅助化疗疗效的预测[J].实用肿瘤学杂志, 2014,28(3):233-238.
[14] 姚雯航,杨紫伟,郭科军.切除修复交叉互补基因1与卵巢癌发病的相关性[J].现代肿瘤医学, 2017, 25(11): 1767-1769.
[15] 徐向勇,许 平,王 旭,等. ERCC1基因多态性和蛋白表达与晚期非小细胞肺癌的TP化疗疗效关系的研究[J]. 检验医学与临床, 2017, 14(9): 1233-1235.
[16] Mathilde G B, Pierre R, Anne C. ERCC1 and telomere status in breast tumours treated with neoadjuvant chemotherapy and their association with patient prognosis[J]. J Pathol Clin Res, 2016, 2(4): 234-246.
[17] 王 凌.耐药相关性基因多态性与卵巢癌铂类药物关系及临床预后的研究[D].西宁: 青海大学,2016.
[18] 曾 超,张昌庆.结直肠癌ERCC1、TP及GADD45A 表达与新辅助化疗疗效的关系[J].现代医药卫生, 2017,33(11):1632-1634.
[19] Hamilton G, Rath B. Pharmacogenetics of platinum-based chemotherapy in non-small cell lung cancer: predictive validity of polymorphisms of ERCC1[J].Expert Opin Drug Metab Toxicol, 2018,14(1):17-24.

