多参数MRI对子宫平滑肌肉瘤及不典型子宫肌瘤的鉴别诊断
毕秋,吕发金,肖智博,邹春霞,沈逸青,刘筱霜
子宫肉瘤(uterine sarcoma)是一种恶性度高、预后差的子宫罕见肿瘤[1],最常见的病理类型为子宫平滑肌肉瘤(leiomyosarcoma,LMS)[2],其标准手术切除方式为子宫加双附件全切除[3]。子宫肌瘤(leiomyoma)是女性生殖系统最常见的良性肿瘤,预后好[1],患者可行激素及高强度聚焦超声(highintensity focused ultrasound,HIFU)等非手术方式治疗[4]。由此可见LMS与子宫肌瘤治疗方式差别很大,术前准确区分二者尤为重要。加之,LMS与子宫肌瘤患者的临床表现相似,术前误诊率高[5],所以单凭临床指标来区分二者比较困难,必须借助其他检查来鉴别。
磁共振成像(magnetic resonance imaging,MRI)是目前鉴别LMS与子宫肌瘤的有效手段之一[6],但仅通过MRI图像定性分析很难与不典型子宫肌瘤(atypical leiomyoma,ALM)相鉴别[7]。扩散加权成像(diffusion weighted imaging,DWI)及动态增强扫描(dynamic contrast-enhanced,DCE)是MRI的两种功能成像方式,之前已有其相关定性参数鉴别子宫肉瘤与变性子宫肌瘤的文章[8],但目前国内外尚无MRI定性及定量参数联合鉴别LMS与ALM的研究。本研究的目的是探索MRI定性图像特点、DWI及DCE定量参数对LMS与ALM的鉴别价值,为临床治疗方式提供更为丰富的依据。
1 材料与方法
1.1 研究对象
收集2011年6月至2016年12月间到我院并由病理证实的19例LMS和88例ALM(包括变性子宫肌瘤及细胞型子宫肌瘤)患者的临床资料,找出术前有完整MRI图像(包括DWI及DCE序列)并排除术前放化疗、激素治疗、介入治疗、HIFU 治疗患者、怀孕患者及国际妇产科联盟(Federation of Gynecology and Obstetrics,FIGO)分期的Ⅲ、Ⅳ期患者,最后纳入12例LMS和79例ALM患者的MRI图像进行分析。MRI定性指标包括病灶的部位、形态、T2WI边界、有无流空血管影、肿瘤实质T1WI/T2WI/DWI信号强度、肿瘤强化方式。MRI定量指标包括肿瘤最大径、平均表观扩散系数值(mean apparent diffusion coefficient,mADC)、早期强化率(early enhancement ratio,EER)、最大对比增强率(maximum contrast enhancement ratio,MCER)。
1.2 MRI检查
采用GE HDxt 3.0 T MRI扫描仪,八通道体部线圈,行盆腔平扫加增强检查。扫描系列包括:①轴位:T2WI[快速恢复快速自旋回波(fast relaxation fast spin echo,FRFSE),TR:4400 ms,TE:106.6 ms,视野:28 cm×22.4 cm,矩阵:288 mm×224 mm,层厚:5 mm,层间距:1.5 mm]、T1WI[快速自旋回波(fast spin echo,FSE),TR:175 ms,TE:1.8 ms,视野:40 cm×28 cm,矩阵:320 mm×224 mm,层厚:5 mm,层间距:1 mm]、DWI[自旋回波-回波平面成像(spin-echo echo planar imaging,SE-EPI),TR:4375 ms,TE:65.6 ms,视野:36 cm×27 cm,矩阵:128 mm×128 mm,层厚:5 mm,层间距:1.5 mm,b=0、800 s/mm2]、增强T1WI[肝脏快速容积采集(liver acceleration volume acquisition,LAVA),TR:4 ms,TE:1.9 ms,视野:40 cm×32 cm,矩阵:320 mm×224 mm,层厚:4 mm,层间距:0 mm];②矢状位:T2WI(FRFSE,TR:3040 ms,TE:107.5 ms,视野:28 cm×22.4 cm,矩阵:320 mm×224 mm,层厚:6 mm,层间距:1mm)、增强T1WI (LAVA,TR:3.9 ms,TE:1.8 ms,视野:35 cm×28 cm,矩阵:288 mm×224 mm,层厚:4 mm,层间距:0 mm)。动态增强扫描采用LAVA序列,包括轴位及矢状位采集,轴位增强扫描共4期,注药前先行一期mask蒙片平扫,注药后分别于30 s、47 s、64 s开始3期连续扫描;矢状位增强距离注药90 s左右开始扫描。对比剂采用马根维显,计量为0.2 ml/kg体质量,推注速率为2 ml/s。
1.3 图像分析
图像后处理采用GE后处理工作站(AW 4.6),采用Functool软件进行分析。ADC值:在ADC图上于病灶最大径层面划定尽可能大的圆形感兴趣区(region of interest,ROI),参考MRI其他系列,尽量避开子宫肌层、出血、囊变、坏死、变性及宫腔积液/黏液区域,记录下mADC值和minADC值,每个病灶测量3次,取平均值。DCE相关参数:病灶非均匀强化时,选择病灶早期强化最明显的部位画ROI,获得时间-信号强度曲线(time signal-intensity curve,TIC),根据TIC记录未增强信号强度(SI0)、增强第一期信号强度(SI1)、峰值信号强度(SIpeak),EER=(SI1-SI0)/SI0,MCER=(SIpeak-SI0)/SI0。
1.4 统计学处理
采用SPSS 20.0统计软件进行分析,所有计量资料均用±s表示,计量资料两两比较采用独立样本t检验,计数资料两两比较采用Fisher精确概率法,P<0.05表示差异有统计学意义。利用受试者工作特征(receiver operating characteristic,ROC)曲线确定差异具有统计学意义的计量资料的阈值。
2 结果
2.1 病理结果及患者一般信息
最后纳入MRI图像分析的有12例LMS和79例ALM患者的信息,12例LMS中有1例为子宫破骨样巨细胞平滑肌肉瘤,其余均为典型LMS;79例ALM包含59例变性肌瘤、15例细胞型肌瘤和5例混合型肌瘤,59例变性肌瘤中有15例玻璃样变、12例黏液样变、6例红色样变、1例囊性变、1例水肿变性、1例脂肪变性、1例钙化、3例坏死或梗死、19例混合变性。
12例LMS患者的平均年龄为(49±8)岁,体重指数(body mass index,BMI)为(22.5±3.8) kg/m2,1例无生育史,11例有流产史。12例LMS患者的临床表现中有3例为阴道流血、5例月经紊乱、2例腹痛、2例发现腹部包块。LMS患者的实验室检查中有5例癌抗原125(cancer antigen 125,CA125)及3例乳酸脱氢酶(lactate dehydrogenase,LDH)升高。12例LMS患者中有9例处于FIGO Ⅰ期,有3例处于FIGO II期。

图1 A~E:女性,45岁,病理诊断为子宫平滑肌肉瘤,病灶主要位于宫腔,边界不清,实质T2WI为混杂信号(A),实质DWI为混杂高信号(B),ADC图示扩散明显受限,平均ADC值为0.67×10-3 mm2/s (C),增强无强化区位于中央(D)。根据TIC曲线,病灶呈早期明显强化(E中1线),EER及MCER分别为3.35和3.35;F~J:女性,21岁,病理诊断为子宫肌瘤黏液样变,病灶主要位于肌壁间,边界清楚,实质T2WI为混杂信号(F),实质DWI为稍高信号(G),ADC图上平均ADC值为1.24×10-3 mm2/s (H),增强可见小片状无强化灶(I)。根据TIC曲线,病灶呈延迟强化(J中1线),EER及MCER分别为1.87和2.40Fig.1 A—E: A 45-year-old woman was diagnosed as uterine leiomyosarcoma by pathology, mainly located in the uterine cavity with an ill-defined margin,showed mixed signal on T2WI (A), the solid component of the lesion appeared heterogeneous hyperintensity on DWI (B), and the mean ADC values were 0.67×10-3 mm2/s (C), on axial contrast-enhanced image, the tumor showed central non enhancement (D). According to the TIC curves, the lesion displayed rapid and marked enhancement (line 1 in E), the EER and MCER were 3.35 and 3.35 respectively; F—J: A 21-year-old woman was diagnosed as uterine leiomyoma with mucinous degeneration by pathology, mainly located in the uterine cavity with a clear margin, showed mixed signal on T2WI (F), the solid component of the lesion appeared slight hyperintensity on DWI (G), and the mean ADC values were 1.24×10-3 mm2/s (H), on axial contrast-enhanced image, the tumor showed sporadic non enhancement (I). According to the TIC curves, the lesion displayed delayed enhancement (line 1 in J), the EER and MCER were 1.87 and 2.40 respectively.
2.2 MRI定性指标比较
12例LMS有4例位于宫腔、4例位于肌壁间、1例位于宫颈、3例位于宫外,ALM大部分位于肌壁间,仅部分位于宫腔,与ALM比较差异具有统计学意义(P=0.01)。所有LMS (100%)与94.9%的ALM为团块状或类圆形(P分别为0.32、0.50)。9例LMS(75%)在T2WI上边界不清,与ALM比较差异具有统计学意义(P<0.01)。9例LMS (75%)与54例ALM(68.4%)中均可见流空血管影,二者差异无统计学意义(P=0.75)。至于肿瘤实质信号强度,83.3%的LMS和77.2%的ALM在T1WI上表现为等信号(P=1.00);83.3%的LMS在T2WI上表现为混杂信号,而ALM则多表现为低信号(P<0.01);91.7%的LMS在DWI上为高信号,与ALM比较差异有统计学意义(P<0.01)。增强图像中,50%的LMS无强化区主要位于病灶中央,而ALM大多呈散在分布(P<0.01),见图1。
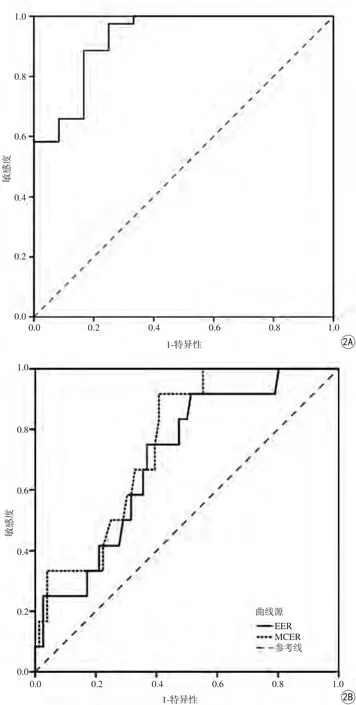
图2 A:平均ADC值的ROC曲线图;B:EER和MCER的ROC曲线图Fig.2 A: ROC curve of mADC values; B: ROC curve of EER and MCER.
2.3 MRI定量指标比较
LMS与A L M的平均肿瘤最大径分别为(73.1±30.5) mm、(83.3±49.4) mm,二者差异无统计学意义(P=0.68)。LMS与ALM的mADC值分别为(0.97±0.22)×10-3mm2/s、(1.44±0.27)×10-3mm2/s,差异具有统计学意义(P=0.00)。根据ROC曲线,当mADC以1.09×10-3mm2/s作为阈值时,敏感性及特异性分别为97.5%和75.0%。关于DCE定量参数,LMS和ALM的EER分别为2.11±2.13、0.93±0.99,MCER分别为3.31±2.46、2.00±0.77,二者在EER (P=0.02)及MCER (P=0.01)上差异均有统计学意义。根据ROC曲线,当EER以0.52作为阈值时,敏感性及特异性分别为91.7%、48.7%;当MCER以2.18作为阈值时,敏感性及特异性分别为91.7%、59.2%,见图2。
3 讨论
3.1 LMS的临床特征
子宫肉瘤是一种少见的间叶源性肿瘤,组织学上可分为LMS、子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)和子宫癌肉瘤(carcinosarcoma,CS)等,其中LMS最常见[2]。LMS好发于围绝经期及绝经期妇女,临床表现与肌瘤相似,可表现为异常阴道流血、触及盆腔包块及腹痛等[2]。与文献报道一致,本研究中LMS患者的平均年龄为49岁,临床表现并无特异性。有研究认为血清LDH和CA125升高有助于术前LMS的诊断[9-10],但细胞型子宫肌瘤及变性子宫肌瘤的LDH也可升高[9],并且子宫肌瘤和早期LMS的CA125有较多重叠[10],因此单靠临床特征难以准确区分LMS及子宫肌瘤(尤其是ALM),必须借助影像学检查来鉴别。
3.2 MRI常规定性指标对LMS及ALM的鉴别价值
LMS与ALM均来源于子宫肌层[7],但由于LMS具有高度恶性及侵袭性的生物学特征,容易侵犯邻近子宫内膜向宫腔内生长并形成模糊的边界[1]。和之前的报道一致[11],本研究发现LMS主要位于宫腔,且在T2WI上边界不清。LMS易发生囊变、坏死及出血,在T2WI上信号极不均匀,增强不均匀强化[11],这与变性子宫肌瘤难以鉴别,故本研究通过观察肿瘤实质信号来区分二者,观察发现LMS实性成分在T2WI上多为混杂信号,这可能和LMS实质是由子宫平滑肌纤维、间叶组织及内膜间质细胞等多种成分组成有关[12]。Lin等[6]认为“中央无强化”是LMS的特征性表现,本组结果也显示LMS增强的无强化区多位于中央,这是因为LMS恶性度高,生长较快,病灶中央容易缺血,进而发生凝固性坏死,故增强中央无强化[6]。
3.3 DWI及DCE-MRI定量指标对LMS及ALM的鉴别价值
DWI可反映水分子的扩散特性,其定量参数为ADC值,与传统MRI相比,DWI及ADC值更能准确区分子宫良恶性病变[6-8]。本研究中91.7%的LMS在DWI上为高信号,mADC值明显低于ALM,这是因为恶性肿瘤的细胞密度大,细胞外间隙小,核浆比高,水分子扩散受限,故ADC值较低[13]。DCE-MRI能够反映病灶强化程度的动态变化过程,从而反映病灶的血供情况。本研究中LMS的EER大于ALM,说明LMS具有早期强化的特点,其MCER大于ALM,说明LMS强化程度较高。Zhang等[14]的研究也认为85.7%的LMS具有快速明显强化的特点,这可能跟该肿瘤的高血管密度有关[15]。薛康康等[8]也认为子宫肉瘤是富血供的高度恶性肿瘤,瘤内及瘤周含有大量新生血管,且平滑肌纤维较少,故血流阻力小,强化较早。
本研究存在一些不足:①样本量较少,一方面是由于子宫肉瘤比较罕见,另一方面,部分LMS经超声检查误诊为子宫肌瘤,术前未行MRI检查。②只研究了LMS与ALM的鉴别,至于子宫肉瘤其他亚型(子宫内膜间质肉瘤、子宫癌肉瘤等)与子宫肌瘤或子宫内膜癌的鉴别将是笔者下一步的研究方向。
总之,LMS虽然罕见,但在MRI图像上仍有一定特点,通过观察病灶的部位、边界、实质信号、无强化区域等定性图像特点及测量mADC值、EER、MCER等定量参数能辅助区分LMS与ALM,术前对怀疑子宫肉瘤患者进行包括DWI及DCE在内的MRI检查尤为重要。
参考文献 [References]
[1]Piura B, Rabinovich A, Yanai-Inbar I, et al. Uterine sarcoma in the south of Israel: study of 36 cases. J Surg Oncol, 1997, 64(1): 55-62.
[2]Santos P, Cunha TM. Uterine sarcomas: clinical presentation and MRI features. Diagn Interv Radiol, 2015, 21(1): 4-9.
[3]Gadducci A, Cosio S, Romanini A, et al. The management of patients with uterine sarcoma: a debated clinical challenge. Crit Rev Oncol Hematol, 2008, 65(2): 129-142.
[4]Khan AT, Shehmar M, Gupta JK. Uterine fibroids: current perspectives. Int J Womens Health, 2014(6): 95-114.
[5]Zhao WC, Bi FF, Li D, et al. Incidence and clinical characteristics of unexpected uterine sarcoma after hysterectomy and myomectomy for uterine fi broids: a retrospective study of 10248 cases. Onco Targets Ther, 2015(8): 2943-2948.
[6]Lin G, Yang LY, Huang YT, et al. Comparison of the diagnostic accuracy of contrast-enhanced MRI and diffusion-weighted MRI in the differentiation between uterine leiomyosarcoma/smooth muscle tumor with uncertain malignant potential and benign leiomyoma. J Magn Reson Imaging, 2016, 43(2): 333-342.
[7]Barral M, Placé V, Dautry R, et al. Magnetic resonance imaging features of uterine sarcoma and mimickers. Abdom Radiol (NY),2017, 42(6): 1762-1772.
[8]Xue KK, Cheng JL, Bai J, et al. Value of DWI and dynamic contrastenhanced MRI in differentially diagnosing uterine sarcomas and degenrated leiomyomas. Chin L Med Imaging Technol, 2016, 32(2):274-278.薛康康, 程敬亮, 白洁, 等. DWI及动态增强MRI鉴别诊断子宫肉瘤与变性子宫肌瘤的价值. 中国医学影像技术, 2016, 32(2): 274-278.
[9]Goto A, Takeuchi S, Sugimura K, et al. Usefulness of Gd-DTPA contrast-enhanced dynamic MRI and serum determination of LDH and its isozymes in the differential diagnosis of leiomyosarcoma from degenerated leiomyoma of the uterus. Int J Gynecol Cancer,2002, 12(4): 354-361.
[10]Skorstad M, Kent A, Lieng M. Preoperative evaluation in women with uterine leiomyosarcoma. A nationwide cohort study. Acta Obstet Gynecol Scand, 2016, 95(11): 1228-1234.
[11]Lakhman Y, Veeraraghavan H, Chaim J, et al. Differentiation of uterine leiomyosarcoma from atypical leiomyoma: diagnostic accuracy of qualitative MR imaging features and feasibility of texture analysis. Eur Radiol, 2017, 27(7): 2903-2915.
[12]Feng W, Malpica A, Robboy SJ, et al. Prognostic value of the diagnostic criteria distinguishing endometrial stromal sarcoma, low grade from undifferentiated endometrial sarcoma, 2 entities within the invasive endometrial stromal neoplasia family. Int J Gynecol Pathol, 2013, 32(3): 299-306.
[13]Wu TI, Yen TC, Lai CH. Clinical presentation and diagnosis of uterine sarcoma, including imaging. Best Pract Res Clin Obstet Gynaecol, 2011, 25(6): 681-689.
[14]Zhang GF, Zhang H, Tian XM, et al. Magnetic resonance and diffusion-weighted imaging in categorization of uterine sarcomas:correlation with pathological findings. Clin Imaging, 2014, 38(6):836-844.
[15]Poncelet C, Fauvet R, Feldmann G, et al. Prognostic value of von Willebrand factor, CD34, CD31, and vascular endothelial growth factor expression in women with uterine leiomyosarcomas. J Surg Oncol, 2004, 86(2): 84-90.

