Mel-18、Notch-1及PLK-1在浸润性乳腺癌中的表达
陈 嬉,金海丽
(台州恩泽医疗中心(集团)恩泽医院 病理科,浙江 台州 318050)
乳腺癌是发生在乳腺腺上皮组织的恶性肿瘤,发病率高,已成为我国重大公共卫生问题[1]。乳腺癌的病因尚未完全清楚,有研究认为,乳腺癌的发生和发展是多种因素综合作用的结果,某些生物学标记物的表达可能与乳腺癌患者的预后有关[2]。Mel-18基因是多梳基因家族中的一员,在细胞增殖、衰老和肿瘤的发生中都具有重要的作用。Mel-18编码负性调控蛋白,抑制肿瘤的发生、发展[3];Notch-1的异常表达与多种肿瘤的发生发展密切相关[4];PLK-1是广泛存在于真核细胞中的丝/苏氨酸激酶,与细胞的有丝分裂密切相关,PLK-1可以参与细胞凋亡的调控,有利于肿瘤的靶向治疗[5]。浸润性乳腺癌是乳腺癌中常见的病理类型,本研究分析生物标记物Mel-18、Notch-1及PLK-1在浸润性乳腺癌中的表达情况,探讨三者在浸润性乳腺癌的发生发展中可能的作用。
1 材料与方法
1.1 材料收集 2014年11月—2016年9月我院病理科的乳腺组织89例,其中正常乳腺组织40例,浸润性乳腺组织49例。49例乳腺癌患者均为女性,年龄33~72岁,平均52.311.4岁。标本入选条件:术前未经任何抗癌治疗,无重大手术及外伤史,且组织类型均经病理检查证实。
1.2 主要试剂与设备 Mel-18鼠抗人单克隆抗体(Abcam公司,产品编号:ab203638)、Notch-1兔抗人抗体(博士德公司,产品编号:BA2743-2)、PLK-1兔抗人单克隆抗体(Abcam公司,产品编号:ab138496)、光学显微镜Nikon Eclipse E200(日本)。
1.3 操作方法 用4%中性甲醛溶液将所有标本固定,经过石蜡包埋并切片备用。Mel-18、Notch-1和PLK-1的工作浓度分别为1:200、1:100和1:200。采用罗氏全自动免疫组织化学染色仪进行染色,用PBS代替一抗做阴性对照。
1.4 阳性率判定 ①以着色细胞数占视野细胞总数(镜下随机取10个视野)的百分比计分。1分:≤10%的核阳性;2分:11%~50%;3分:51%~75%;4分:>75%。②根据染色强度进行计分。1分:阴性;2分:弱染色;3分:中度染色;4分:重度染色。将上述两种方法的计分结果进乘积,若乘积≥4分,便认为阳性,否则为阴性。Mel-18和PLK-1主要在细胞核内表达,呈现棕褐色或者棕黄色颗粒。Notch-l主要在细胞质内表达,呈现棕黄色或黄色颗粒。
1.5 统计学处理 应用SPSS 19.0统计软件分析数据,计数资料的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 Mel-18、Notch-1及PLK-1的表达 Mel-18、Notch-1、PLK-1在正常乳腺组织中的阳性率与在浸润性乳腺组织中的阳性率,差异均有统计学意义(P<0.05);见表1。
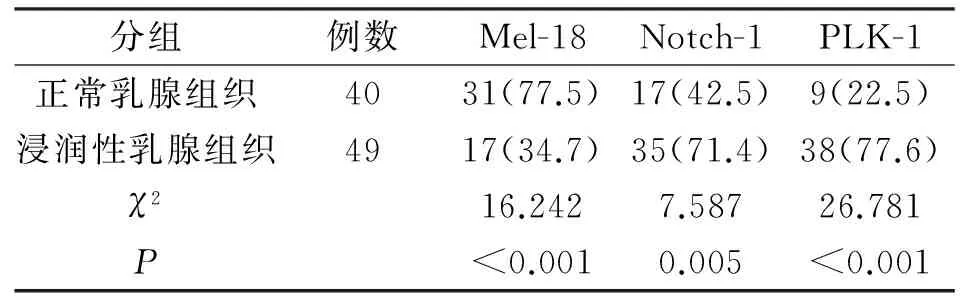
表1 Mel-18、Notch-1及PLK-1
2.2 Mel-18、Notch-1及PLK-1与浸润性乳腺癌临床病理参数的相关性 Mel-18的表达与淋巴结转移和临床分期有关(P<0.05),与患者年龄和组织学分级无关(P>0.05);Notch-1和PLK-1的表达均与组织学分级、淋巴结转移和临床分期有关(P<0.05),与患者年龄无关(P>0.05)。见表2。
3 讨论
乳腺癌是女性常见恶性肿瘤之一,发病率高,但死亡率却呈逐年下降趋势。究其原因,一是乳腺癌筛查工作的开展,二是乳腺癌综合治疗的开展。因此,乳腺癌的早期筛查或诊断是降低乳腺癌死亡率的关键。随着分子生物学的发展,乳腺癌生物标记物的研究也越来越深入。本研究对Mel-18、Notch-1及PLK-1在浸润性乳腺癌中的表达进行研究,以期为临床浸润性乳腺癌的研究和乳腺癌的预后提供有力支撑。
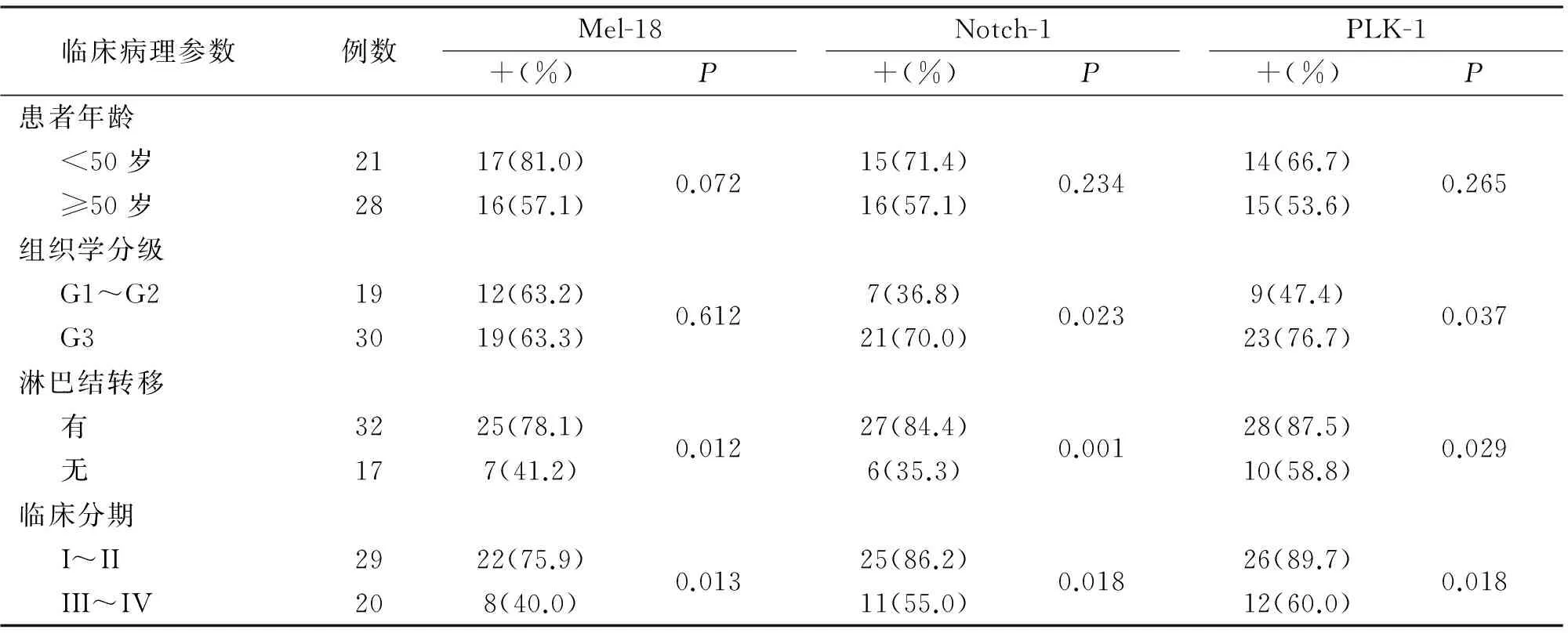
表2 Mel-18、Notch-1及PLK-1与浸润性乳腺癌临床病理参数的相关性
Mel-18定位于染色质17q12,由13个外显子组成,通过结合序列5'-GACTNGACT-3'起转录抑制作用,此序列位于c-myc,bcl-2,hox基因的非编码区或调控区。Mel-18基因通过下调c-myc基因的表达,调节细胞增殖,加速细胞衰老[6],从而抑制肿瘤生长。本研究结果发现,Mel-18在正常乳腺组织中的表达高于浸润性乳腺组织,且Mel-18的表达与淋巴结转移和临床分期有关,这与贠田等[7]研究结果相似,对于乳腺癌的预后具有重要的意义。
Notch-1定位于染色体9q34,是许多重要信号通路(调节细胞增殖)的交汇点,在细胞分化、发育中具有一定的作用,且影响其下游多种癌基因参与细胞的增殖、分化及凋亡过程[8]。本研究结果发现,Notch-1在浸润性乳腺组织中的表达高于正常组织,且Notch-1的表达与组织学分级、淋巴结转移和临床分期有关(P<0.05),表明在一定程度高表达Notch-1加剧了乳腺癌浸润和转移,预后不良。
人类的PLK基因定位于16p12.3,PLK-1是调节细胞周期的重要分子,位于细胞周期的中心环节。PLK-1稳定分裂细胞基因组,参与了细胞周期各个检测点功能,在细胞DNA修复后,进入有丝分裂,从而抑制细胞增殖,促进细胞凋亡[9]。本研究结果显示PLK-1在浸润性乳腺组织中的表达高于正常组织,且PLK-1的表达与组织学分级、淋巴结转移和临床分期有关,说明PLK-1在肿瘤中高表达与肿瘤的生物学行为及预后有密切关系,这与King等[10]研究结果相似。
综上所述,Mel-18、Notch-1及PLK-1在浸润性乳腺癌的发生发展中具有一定的作用,与淋巴结转移和临床分期密切相关,可能是影响浸润性乳腺癌预后的重要指标。
参考文献:
[1] 吴骥, 管小青, 顾书成, 等. 乳腺浸润性导管癌组织中COX-2和Ki-67的表达及相关性分析[J]. 中国普外基础与临床杂志, 2014, 21 (2): 197-201.
[2] 李庆霞, 邢雅军, 闫晓路, 等. 乳腺浸润性导管癌Survivin和AIB-1表达及其相关性研究[J]. 中华肿瘤防治杂志, 2013, 20 (12): 935-938.
[3] Lee JY, Kong G. Mel-18, a tumor suppressor for aggressive breast cancer[J]. Oncotarget, 2015, 6 (18): 15710-15711.
[4] 张奇, 宋鑫. Notch信号通路在肿瘤干细胞中的研究进展[J]. 中国肿瘤, 2014, 23 (7): 585-590.
[5] 王冲, 余建, 黄河. Plk1磷酸化修饰PinX1对宫颈癌HeLa细胞有丝分裂及凋亡的影响[J]. 郑州大学学报:医学版, 2013, 48 (3): 323-327.
[6] Won HY,Lee JY,Shin DH,etal.Loss of Mel-18 enhances breast cancer stem cell activity and tumorigenicity through activating Notch signaling mediated by the Wnt/TCF pathway[J].FASEB J,2012,26(12): 5002-5013.
[7] 贠田,王仰坤,原旭涛,等. Mel-18、Notch-1和PLK-1在不同乳腺组织中的表达及临床意义[J]. 诊断病理学杂志,2017,24(1):30-33.
[8] Yuan X,Zhang M,Wu H,etal.Expression of Notch1 Correlates with Breast Cancer Progression and Prognosis[J].PLoS One,2015,10(6):e0131689.
[9] 钱锋. 吉西他滨对胰腺癌细胞增殖、凋亡及PLK-1表达的影响[J]. 解放军医药杂志,2015,27(7):53-55.
[10] King I Sharon,Colin PA,Susan BE,etal.Immunohistochemical detection of Polo-like kinase-1(PLK1)in primary breast cancer is associated with TP53 mutation and poor clinical outcome[J].Breast Cancer Res,2012,14(2):R40.

