氩氦刀联合肿瘤病灶刮除植骨内固定术治疗胫骨近段骨巨细胞瘤疗效分析*
贾一鑫,史占军,陈国奋,肖军
(南方医科大学南方医院 关节与骨病外科,广东 广州 510080)
骨巨细胞瘤在1940年首次被JAFFE发现,为常见的原发性骨肿瘤之一,来源尚不清楚,可能起始于骨髓内间叶组织。骨巨细胞瘤具有较强侵袭性,对骨质的溶蚀破坏作用大,极少数有反应性新骨生成及自愈倾向,可穿过骨皮质形成软组织包块,刮除术后复发率高,少数可出现局部恶性变或肺转移(即所谓良性转移)。骨巨细胞瘤为低度恶性或潜在恶性的肿瘤。骨巨细胞瘤多在20~50岁发病,女性高于男性。骨巨细胞瘤的原发部位多发生在骨骺,随病灶的扩大逐渐侵及干骺端。骨巨细胞瘤多侵犯长骨,以股骨下端及胫骨近段为最多。胫骨近段骨巨细胞瘤在临床上较为常见。其治疗以手术切除为主,常用刮除术加灭活处理,植入自体或异体松质骨或骨水泥。本病复发率高,且易发生肉瘤变。以往常采用液氮冷冻消融、射频消融等辅助治疗手段,但精度较低,容易造成副损伤。随着冷冻技术不断发展,氩氦刀进入临床,可有效提高肿瘤切除精度,实现彻底的病理边界切除,提高患者长期生存率[1],故其广泛应用于肝癌、肺癌、胰腺癌等多种实体肿瘤[2]。本研究回顾性分析氩氦刀联合肿瘤病灶刮除植骨内固定术治疗胫骨近段骨巨细胞瘤术后近期疗效,并通过美国特种外科医院(Hospital for Special Surgery,HSS)膝关节功能评分进行临床评估,以探讨氩氦刀联合肿瘤病灶刮除植骨内固定术治疗胫骨近段骨巨细胞瘤的可行性及疗效,总结氩氦刀冷冻疗法的适应证及技术要点。
1 资料与方法
1.1 研究对象
1.1.1 纳入标准 经病理诊断明确的胫骨近段骨巨细胞瘤患者;肿瘤局限于胫骨中上1/3段内,上边界不超过关节面,下边界不超过胫骨中上1/3分界线;病例资料记录完整;本科首次手术治疗;肿瘤初发患者;无远处转移;手术前后神志清醒;无血液病史及出血倾向;无感染史;保肢手术。
1.1.2 排除标准 病例资料记录不完整;院外己经手术治疗复发者;肿瘤已有远处转移;其他骨骼受累;手术前后神志不清醒;既往有血液病史或正在服用抗凝药物;截肢手术。
1.2 一般资料
选取2010年1月-2016年12月,符合条件的胫骨近段骨巨细胞瘤患者23例。其中,男性11例,女性12例;年龄16~39岁,平均(25.8±9.1岁)。均行肿瘤病灶刮除植骨内固定术,依照不同治疗水平分为两组:单纯手术组11例,男性5例,女性6例;年龄17~36岁,平均26.5岁;均为初次发病。氩氦刀联合手术组12例,男性6例,女性6例;年龄16~39岁,平均28.1岁;均为初次发病。两组患者性别、年龄、体重、Enneking肿瘤分级、术前膝关节HSS功能评分等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.3 治疗方法
1.3.1 单纯手术组 行肿瘤病灶刮除植骨内固定术。取胫骨近段前外侧切口,沿胫骨外侧至小腿中段端沿胫前肌外缘切开皮肤,切开皮肤皮下组织,保护腓总神经,切开深筋膜,显露胫前肌、拇长伸肌和趾长伸肌。在拇长伸肌和趾长伸肌之间进入,把胫前动静脉及腓总神经牵向外侧,显露胫骨上段。胫骨前方沿病灶上缘和下缘之间开窗,开窗时注意保护,对于病灶内容物溢出物应立即给予吸引器清除。骨刀等接触过肿瘤的器械应与其他器械分开单独放置,防止交叉污染。以刮勺刮除病灶,避免肿瘤组织溢出,刮除时应注意把接触过肿瘤的器械与其他器械分开放置,对病灶内溢出物应立即以吸引器清除。用咬骨钳扩大骨窗,至病灶的上下缘水平。扩大骨窗后进一步刮除病灶,刮除时应注意把接触过肿瘤的器械与其他器械分开放置,对病灶内溢出物应立即以吸引器清除。使用牙科镜检查术者不能直观的区域是否残留病变组织。高速磨钻打磨整个病灶内壁,去除硬化缘。冲洗枪反复冲洗术野,取异体松质骨制成骨条后填充。于胫骨外侧上胫骨近端锁定钢板,钻孔拧锁定螺钉固定,活动膝关节,见钢板固定可靠,关闭切口留置引流管。生理盐水及碘伏反复冲洗术野,遵循无瘤原则,手术完毕。
1.3.2 氩氦刀联合手术组 ①沿前述经典手术路径逐层剥离沿途解剖结构,保护重要血管神经,尽可能充分暴露肿瘤完整边界,干纱布保护周围软组织。②布置冷冻探针。保护肿瘤周围正常组织,选取φ2 mm冷冻探针布针原则:超出肿瘤边界外1 cm处为冷冻消融范围,冷冻探针间距设为1 cm,肿瘤区域内布针完整全覆盖。③冷冻消融。冷冻消融2循环,使冰球完全覆盖瘤体。④肿瘤刮除。取出冷冻探针,沿前述手术步骤刮除瘤腔内部经冷冻消融后的坏死组织,后续步骤同单纯手术组。见图1。
1.4 术后处理
上述病例均行常规切口换药。患者均先卧床1周,而后可遵医嘱佩戴外固定支具拄拐下地,开始关节功能训练,且避免负重;8周后才可完全负重。
1.5 评价指标
1.5.1 并发症情况 记录各组患者并发症发生情况。
1.5.2 膝关节HSS功能评分 聘请独立第三方依据HSS评分表对患者进行打分汇总。满分为100分。计算术后与术前的膝关节HSS评分差值。
1.6 统计学方法
数据分析采用SPSS19.0统计软件,计量资料以均数±标准差(±s)表示,采用t检验,膝关节HSS功能评分经Levene检验方差齐,采用重复测量设计的方差分析,计数资料采用χ2检验,均为双侧检验,P<0.05为差异有统计学意义。
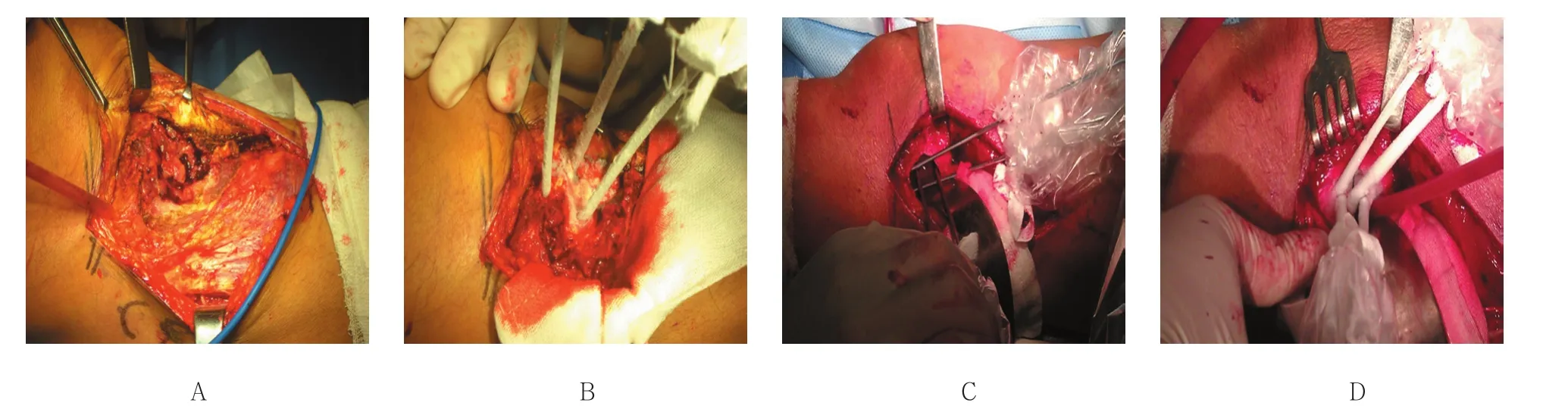
图1 胫骨近段骨巨细胞瘤氩氦刀冷冻消融
2 结果
所有患者均获得12个月观察,两组患者间性别、年龄、体重、肿瘤Enneking分级等一般资料差异无统计学意义(P>0.05)(见表1),具有可比性。所有患者术后切口均一期愈合,单纯手术组术后1例发生下肢水肿,行双下肢血管彩超排除下肢静脉血栓,给予抗凝辅以利尿脱水后好转;3例发生小腿外侧皮神经损伤,小腿外侧皮肤感觉减退,经过营养神经,指导功能锻炼等治疗好转;1例在术后第12个月原位复发,再次行肿瘤病灶刮除植骨术好转。氩氦刀联合手术组术后1例发生肺部感染,经呼吸内科会诊,行抗感染等治疗后好转;2例发生小腿外侧皮神经损伤,小腿外侧皮肤感觉减退,经过营养神经,指导功能锻炼等治疗好转。
单纯手术组与氩氦刀联合手术组术后第3、6、12个月HSS膝关节功能评分比较,采用重复测量设计的方差分析,结果:①不同时间点的HSS膝关节功能评分有差异(F=91.264,P=0.000);②两组的术后HSS膝关节功能评分有差异(F=41.411,P=0.000),氩氦刀联合手术组术后HSS膝关节功能评分较高,相对恢复效果较好;③两组的HSS膝关节功能评分变化趋势有差异(F=4.972,P=0.037)(见表2)。如图2所示,2条曲线间距随时间推移逐渐变近,据此推测,氩氦刀联合手术可以改善患者术后膝关节功能,但这种改善主要体现在近期,就远期来说,这种改善效应会随时间推移而逐渐减弱。
典型病例,患者男,32岁,因右小腿疼痛伴活动受限1月入院。术前病理活检可见大量多核巨细胞散在分布,基质细胞排列疏松,无异型性,间质黏液变性,病理诊断:骨巨细胞瘤(见图3A)。右膝X射线示右胫骨近段骨巨细胞瘤,侵及胫骨骨端,未累及关节面(见图3B),行氩氦刀联合右胫骨近段骨巨细胞瘤刮除植骨内固定术后3、6、12个月X射线示内固定牢靠,位置佳(见图3C~E)。术后3个月门诊复查膝关节活动度,屈曲90°(见图4A),术后6个月门诊复查膝关节活动度,屈曲110°(见图4B),术后12个月门诊复查膝关节活动度,屈曲120°,伸直0°,关节功能恢复良好(见图4C、D)。
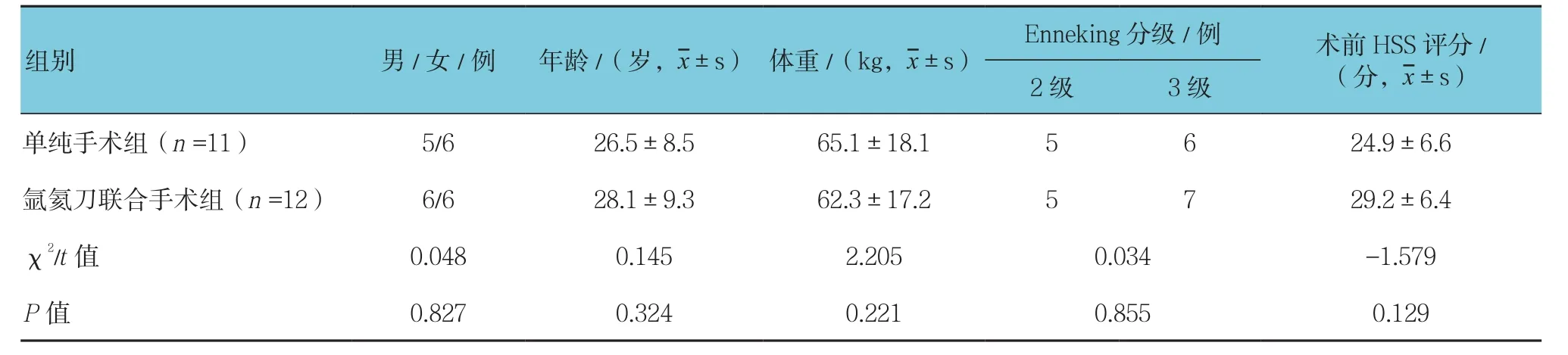
表1 两组患者基线资料比较
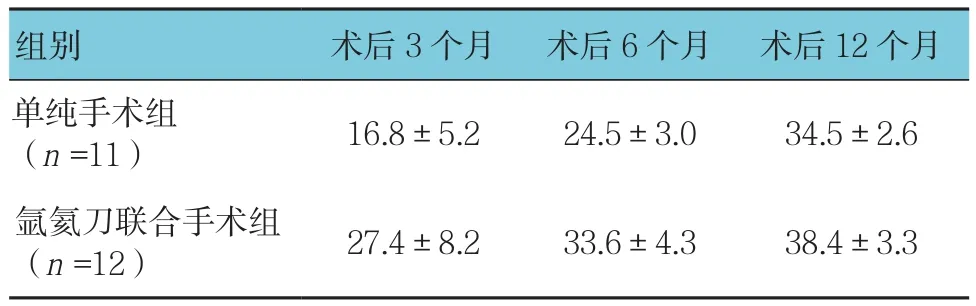
表2 两组患者术后第3、6、12个月HSS评分比较
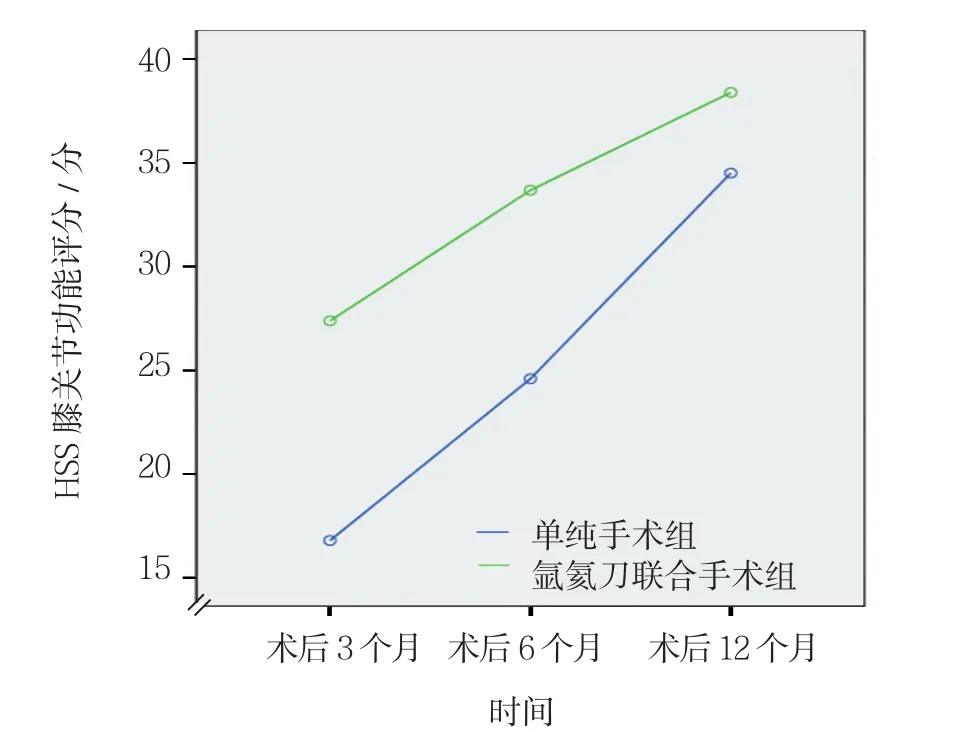
图2 两组术后HSS膝关节功能评分不同时间变化趋势
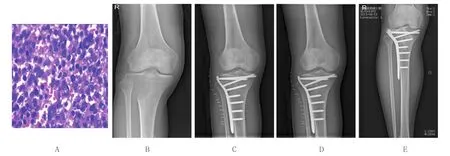
图3 典型病例
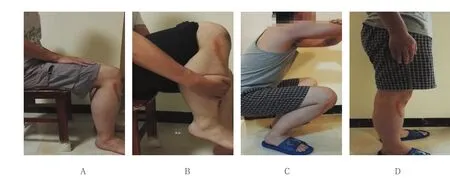
图4 典型病例
3 讨论
3.1 氩氦刀治疗骨巨细胞瘤的机制
冷冻对肿瘤组织具有较强的破坏作用,肿瘤对冷冻也有较高的敏感性,上述2点是冷冻消融的主要治疗原理。冷冻可通过物理、化学和生物效应实现破坏作用。物理效应:肿瘤组织急速冷冻或复温时会在内部生成温度梯度,任何生物材料本身内部结构并非均一,已冻结组织不能随温度自由热胀冷缩因而产生局部应力,当其超过自身的弹性极限时将产生裂纹,肿瘤细胞破裂,从而造成组织损伤。化学效应:当细胞外冰晶形成时,膜脂质受到损伤,通透性增加。蛋白质受损时,表现为酶活性改变,蛋白质变性或灭活,蛋白聚合反应加剧。细胞内膜蛋白变性,细胞表面的电荷改变,细胞内各种酶的活性明显降低,膜的通透性发生改变,膜的稳定性降低。线粒体膜的破坏,导致胞内缺氧,形成了缺氧的微环境,影像能量合成代谢。最终,生物膜结构破损,使细胞代谢各种物质的能力明显减弱,促使细胞凋亡[3]。生物效应:冷冻摧毁肿瘤微循环,扰乱细胞代谢,引起细胞死亡;细胞外间隙冰晶溶解,成为低渗状态,水再进入细胞内,引起细胞肿胀,加上细胞外冰晶形成、微血管栓塞等因素的协同作用,细胞脱水皱缩引起蛋白质变性,组织凝固性坏死,细胞破裂溶解,直接杀伤肿瘤细胞。
3.2 冷冻技术治疗良性及低度恶性骨肿瘤的应用背景
陈国奋等[4]使用氩氦刀联合手术治疗3例骨巨细胞瘤,术中伴行同种异体骨植入术、骨水泥填充术或钢板内固定术,术后随访4个月显示:肿瘤复查无复发,术后3个月可正常下地行走,关节活动度正常,患肢关节功能得到最大限度的保留。
COUPAL等[5]用CT引导下氩氦刀治疗成人骨样骨瘤,结果显示手术成功率100%,疼痛评分术后较术前明显降低,所有患者均未出现并发症,氩氦刀治疗成人骨样骨瘤安全有效。WU等[6]针对儿童骨样骨瘤在CT引导下行氩氦刀联合手术治疗,结果显示在CT引导下行氩氦刀联合手术治疗儿童骨样骨瘤安全有效,患者术后无疼痛,手术成功率为100%,所有患者均无任何形式的并发症,CT引导的核心优势在于可在局部麻醉下行儿童骨样骨瘤的氩氦刀联合手术治疗。
硬纤维瘤一般情况下表现为缓慢生长的局部肿块,质硬、活动度差,可无痛、轻微或中度疼痛。当肿瘤侵犯或压迫周围神经耐会出现麻木、刺痛、放射性疼痛、活动障碍等神经损害症状。通常具有浸润性,远期复发率高,多见于腹壁,局部易复发,硬纤维瘤行手术切除术经研究认为疗效不确切[7]。HAVEZ等[8]针对13例腹外硬纤维瘤患者在图像引导下行氩氦刀联合手术治疗,平均随访11个月余,无瘤生存率为82.3%,2例患者(12%)局部复发。KUJAK等[9]用氩氦刀治疗5例对其他治疗方式无效的腹外硬纤维瘤患者,氩氦刀治疗小型或中等大小硬纤维瘤安全有效,但对于大型硬纤维瘤疗效不佳。
3.3 氩氦刀联合手术改善术后膝关节功能的可行性
术中的精细操作是术后膝关节功能改善的决定因素。减少术中出血,降低术中出血并发症,充分清晰显露术野是手术成功的关键[10]。骨肿瘤多发病隐匿,就诊时常体积较大,毗邻解剖结构复杂、血供极为丰富。临床上以往常采取术前介入手段栓塞肿瘤主要血供以减少术中出血[11],如腹主动脉阻断是目前骶骨肿瘤切除术中最常用、最有效控制出血的方法[12]。出血量与肿瘤性质、位置、大小以及术式密切相关。本研究中,恶性肿瘤、瘤体直径较大、浸润重要血管均是术中大量出血的原因,结果表明,采用液氮冷冻消融及氩氦刀,均可减少术中出血,可能的原因如下:①冷冻的破坏机制主要包括物理、化学和血管效应,低温可以使小血管急剧收缩,降低肿瘤血供,减少出血。②低温使微循环迅速栓塞,微循环停止,同时杀灭肿瘤。③复温后,细胞水肿,压迫血管。坏死物质逐渐吸收,纤维组织增生,形成瘢痕,血管永久闭合,实现彻底止血的目的。相比液氮浸泡法,氩氦刀可以通过降温及升温的速度、时间和温差从而控制冰球尺寸与形状,以达到对靶区的可控操作。同时,由于氩氦刀制冷或加热只限于超导刀尖端,刀杆有很好的热绝效果[13],不会对穿刺路径上的组织造成损伤,从而可以经皮操作,故氩氦刀的控制出血效果更好。
术后疼痛是患者开展膝关节功能锻炼的关键制约因素。多数肿瘤患者均伴有不同程度的疼痛,以晚期肿瘤患者更甚[14]。冷冻缓解术后疼痛的原因主要有:①冷冻可以杀灭肿瘤细胞,这也是冷冻可以缓解术后疼痛的根本原因。②冷冻急剧降低组织活性,代谢减慢,释放各种类型炎症因子的速度降低;冷冻使局部微循环停止,炎症因子无法通过微循环释放,有效缓解疼痛。③冷冻更多依靠肿瘤的低温敏感性杀灭肿瘤,而非以往的手术采取机械切除方式,故更有可能找出肿瘤的病理边界,切除更彻底,止痛效果更佳。相比液氮冷冻消融,氩氦刀更佳精确可控。已有诸多学者将氩氦刀用于恶性肿瘤的姑息治疗[15-16],在B超、CT、MRI等影像技术辅助下,冷冻探针可经皮穿刺,准确到达治疗靶点[17]。同时,影像手段可以对氩氦刀全程即时监控,确保了冰球范围安全有效。故氩氦刀的术后止痛效果更好。
3.4 手术体会及共识与争议
液氮和氩氦刀分别联合手术能否改善肿瘤复发率,国际上关于这一点众说纷。RENARD等[18]采用液氮冷冻消融术治疗22例低分化软骨肉瘤,平均随访2年,所有患者均无局部复发,肢体功能良好。VETH等[19]认为低分化软骨肉瘤(组织学Ⅰ级)患者最适宜行冷冻消融术,且疗效最佳。KOLLENDER等[20]报道使用液氮冷冻消融术治疗14例骶骨恶性肿瘤患者,术后随访3~11年,预后良好,报道认为液氮冷冻消融术较单纯手术切除术局部复发率低,神经血管并发症少,功能恢复更佳。MEFTAH等[21]比较液氮与氩氦刀2种术式的优劣,显示2种手术技术均是安全有效的,疗效差异无统计学意义。以上研究说明,冷冻技术对于骨与软组织肿瘤具有较高特异性,其对骨巨细胞瘤、低分化软骨肉瘤可能有效。在本研究中,因时间条件限制,样本量有限,每种特异类型的肿瘤例数不多,还有待进一步病例收集。
感染是骨软肿瘤手术的灾难性风险。肿瘤切除后残留空腔、肿瘤细胞及肿瘤周围组织坏死,这些坏死组织残留于空腔之中成为可能的感染源,引起感染,造成组织坏疽。同时坏死细胞崩解后释放致热源进入血液循环,引起全身性反应,进一步加重感染[22]。冷冻技术目的在于精确微创切除肿瘤,缩短手术时间,间接降低感染风险。但感染除与手术过程中无菌原则息息相关外,还与患者自身情况密切相关。骨软肿瘤中高龄者占据相当部分,基础疾病免疫力较差,且患有糖尿病、肥胖、高血脂、慢性支气管炎等慢性疾病,增加感染机会[23]。控制感染须:①术前细致评估手术指征,围手术期监控患者的慢性疾病,合理调整用药;②术中严格按照无菌原则,尽量缩短手术时间,减少切口暴露以控制感染风险;③术后严格无菌换药,合理使用抗生素。
骨延迟愈合与多种因素密切相关。部分骨软肿瘤患者一般情况较差,免疫力低下,影响愈合速度;骨软肿瘤患者术中情况常较为复杂,部分肿瘤伴有病理性骨折,浸润神经血管[24]。术中有可能连同血供一同切除,影响骨愈合;患者如有隐匿性感染史,或术后发生感染,则可影响骨愈合;部分骨软肿瘤患者对骨移植物或内固定物存在排斥反应,也可影响愈合[25]。冷冻对骨愈合的影响仍需积累更多病例证实。
冷冻作为一项新技术尚不成熟,需要更多的尝试、改进。国外已经在基础研究上进行了深入探索,在设备上推陈出新,术式上不断改进。而国内的研究水平与国外差距较大,在临床上处于模仿阶段,应用上以量取胜。希望更多的同道加入到该项技术的研究和应用中来,为人类战胜肿瘤贡献智慧。
参 考 文 献:
[1] 张肖, 张璇, 肖越勇, 等. MR引导下氩氦刀冷冻消融术治疗骨盆肿瘤的临床应用[J]. 中国介入影像与治疗学, 2010, 7(3): 232-235.
[2] 周刚, 牛立志, 邱大卫, 等. 冷冻消融治疗对胰腺癌患者细胞免疫功能影响的观察[J]. 中华肿瘤防治杂志, 2011, 18(24): 1938-1941.
[3] GAGE A A, BAUST J C. Cryosurgery for tumors[J]. J Am Coll Surg, 2007, 205: 342-356.
[4] 陈国奋, 张会良, 兰天, 等. 氩氦刀冷冻消融辅助治疗骨巨细胞瘤三例早期临床报道[J]. 中国骨与关节杂志, 2012, 1(3): 277-279.
[5] COUPAL T M, MALLINSON P I, MUNK P L, et al. CT-guided percutaneous cryoablation for osteoid osteoma: initial experience in adults[J]. AJR Am J Roentgenol, 2014, 202: 1136-1139.
[6] WU B, XIAO X, ZHANG X, et al. CT-guided percutaneous cryoablation of osteoid osteoma in children: an initial study[J].Skelet Radiol, 2011, 40: 1303-1310.
[7] WALCZAK B E, ROSE P S. Desmoid: the role of local therapy in an era of systemic options[J]. Curr Treat Options Oncol, 2013, 14:465-473.
[8] HAVEZ M, LIPPA N, AL-AMMARI S, et al. Percutaneous imageguided cryoablation in inoperable extra-abdominal desmoid tumors: a study of tolerability and efficacy[J]. Cardiovasc Intervent Radiol, 2014, 37: 1500-1506.
[9] KUJAK J L, LIU P T, JOHNSON G B, et al. Early experience with percutaneous cryoablation of extra-abdominal desmoid tumors[J].Skelet Radiol, 2010, 39: 175-182.
[10] CARACCIOLO J T, LETSON G D. Radiologic approach to bone and soft tissue sarcomas[J]. Surgical Clinics of North America,2016, 96(5): 963-976.
[11] 单长胜, 于春鹏, 孙成建, 等. 腹主动脉球囊阻断技术在骶骨肿瘤手术治疗中的应用[J]. 国际医学放射学杂志, 2015(2):107-109.
[12] YI L M, HONG D M, WANGLIN LIU M D, et al. Clinical evaluation for lower abdominal aorta balloon occluding in the pelvic and sacral tumor resection[J]. Journal of Surgical Oncology,2013, 108(3): 148-151.
[13] WANG R, SHEN Y, ZHANG C, et al. Comparison between helium and argon plasma jets on improving the hydrophilic property of PMMA surface[J]. Applied Surface Science, 2016,367: 401-406.
[14] MOOS R V, COSTA L, RIPAMONTI C I, et al. Improving quality of life in patients with advanced cancer: Targeting metastatic bone pain[J]. European Journal of Cancer, 2017, 71: 80-94.
[15] ZARGAR H, ATWELL T D, CADEDDU J A, et al. Cryoablation for small renal masses: selection criteria, complications, and functional and oncologic results[J]. European Urology, 2016,69(1): 116-128.
[16] COWAN S, LOZANO-CALDERON S A, UPPOT R N, et al.Successful CT guided cryoablation of phosphaturic mesenchymal tumor in the soft tissues causing tumor-induced osteomalacia: a case report[J]. Skeletal Radiology, 2017, 46(2): 273-277.
[17] H AOUN, P LITTRUP, F MEMON, et al. Abstract No. 195-CT-guided cryoablation of primary and metastatic lung tumors: low recurrence and complication rates[J]. Journal of Vascular and Interventional Radiology, 2017, 28(2): S86.
[18] RENARD A J, VETH R P, SCHREUDER H W, et al.Osteosarcoma: oncologic and functional results. A single institutional report covering 22 years[J]. J Surg Oncol, 1999,72(3): 124-129.
[19] VETH R 1, SCHREUDER B, VAN BEEM H, et al. Cryosurgery in aggressive, benign, and low-grade malignant bone tumours[J].Lancet Oncol, 2005, 6(1): 25-34.
[20] KOLLENDER Y, MELLER I, BICKELS J, et al. Role of adjuvant cryosurgery in intralesional treatment of sacral tumors[J]. Cancer,2003, 97(11): 2830-2838.
[21] MEFTAH M, SCHULT P, HENSHAW R M. Long-term results of intralesional curettage and cryosurgery for treatment of low-grade chondrosarcoma[J]. J Bone Joint Surg Am, 2013, 95: 1358-1364.
[22] NIJMAN T A, VOOGDT K G, TEUNISSEN P W, et al.Association between infection and fever in terminations of pregnancy using misoprostol: a retrospective cohort study[J]. Bmc Pregnancy & Childbirth, 2017, 17(1): 7.
[23] OGAWA S, OKAWA Y, SAWADA K, et al. Continuous postoperative insulin infusion reduces deep sternal wound infection in patients with diabetes undergoing coronary, artery bypass grafting using bilateral internal mammary artery grafts: a propensitymatched analysis[J]. European Journal of Cardio-Thoracic Surgery, 2016, 49(2): 420.
[24] TSUDA Y, YASUNAGA H, HORIGUCHI H, et al. Complications and postoperative mortality rate after surgery for pathological femur fracture related to bone metastasis: analysis of a nationwide database[J]. Annals of Surgical Oncology, 2016, 23(3): 1-10.
[25] VALENTE G, PITTO L, SCHILEO E, et al. Relationship between bone adaptation and in-vivo mechanical stimulus in biological reconstructions after bone tumor: a biomechanical modeling analysis[J]. Clinical Biomechanics (Bristol, Avon), 2017, 42(2):99-107.

