Integrin β1和MMP-9在结直肠癌组织中的表达及其与临床预后的关系
罗冲,张向东,吴艳林,王新伟
(河南省南阳市中心医院 1.消化内科,2.肿瘤内科,3.普外科,河南 南阳 473009)
结直肠癌是一种常见的消化系统肿瘤,尽管大多数患者可及时进行相应的手术治疗,但其淋巴转移依然是术后复发以及影响患者生存的一个重要因素[1-2],对结直肠癌转移及其相关机制的研究具有重要的临床意义。细胞的黏附反应作为肿瘤淋巴转移及远距脏器转移的关键环节[3-5],近年来成为研究者专注的重要课题之一。整合素(Integrins)是细胞黏附分子家族的重要一员,介导细胞与细胞外基质以及细胞与细胞之间的黏附反应,从而影响细胞的增殖、迁移、凋亡等生物学特性[6-7]。整合素β1(Integrin β1)则是该家族最大的亚群,已被报道在多种肿瘤中异常表达,如头颈部肿瘤、食管鳞癌、乳腺癌等[8-10]。基质金属蛋白酶9(matrix metallopmteinase-9,MMP-9)则属于基质金属蛋白酶(MMPs)超家族中的明胶酶,可降解细胞外基质,广泛参与肿瘤、炎症、心血管系统等多种疾病的发生发展过程。研究发现[11-13]细胞外基质的降解是肿瘤侵袭转移的基本步骤,包括胃癌、宫颈鳞癌、淋巴瘤肿瘤中出现MMPs家族的异常表达。但对于Integrin β1及MMP-9与结直肠癌临床关系的系统性研究报道甚少。本文通过检测结直肠癌组织中Integrin β1及MMP-9蛋白的分布和表达情况探讨其与结直肠癌浸润转移及临床分期的关系,分析其临床意义,并于术后对患者进行随访,初步评价Integrin β1及MMP-9的表达与临床疗效之间的关系。
1 资料与方法
1.1 临床资料
选取2008年3月-2011年3月于南阳市中心医院确诊为结直肠癌的52例患者的病理标本及31例正常肠黏膜组织标本。所有入选病例均经患者知情同意且入院之前未接受过放、化疗或手术治疗。其中,男性37例,女性15例;年龄21~67岁,平均53岁;病程2~4年,平均2.6年。依据患者具体情况进行相应治疗后保存患者的癌组织切片,同时详细录入其临床病理资料,以备后续分析。另收集癌旁配对组织标本42例及31例非肠癌患者的正常肠黏膜组织标本作对照研究。
纳入患者均在接受相应的治疗之后参与随访调查,其中失访2例。随访1年后死亡6例,随访3年后死亡14例,随访5年后死亡29例。其中27例死于肿瘤术后转移、复发,2例死于其他疾病。
1.2 免疫组织化学链霉亲和素过氧化物酶连接方法(Immunohistochemical SP)
将癌组织标本、癌旁配对组织标本及正常肠黏膜组织标本用10%甲醛浸泡固定,常规脱水及石蜡包埋后冷冻切片,免疫组织化学染色方法参照SP试剂盒(购自北京中杉金桥生物公司)的说明书进行操作。鼠抗人Integrin β1单克隆抗体及鼠抗人MMP-9单克隆抗体购自美国Santa Cruz公司,磷酸盐缓冲液PBS替代一抗作为阴性对照。
结果判定,Integrin β1和MMP-9均以细胞膜和/或胞质着棕黄色颗粒为阳性[7]。参考文献[8]的半定量方法评定染色结果,即根据阳性细胞的数量和染色强度进行计分:①染色强度的记分标准,不着色记0分、轻度着色(略强于阴性对照,表现为淡黄色颗粒)记1分、中度着色记2分、重度着色记3分;②阳性细胞数量的记分标准,<10%的细胞着色记1分、10%~50%的细胞着色记2分、>50%的细胞着色记3分。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计数资料行χ2检验或校正χ2检验,两两比较采用χ2分割法,检验水准α=0.0167,相关性分析采用Spearman等级相关分析,采用乘积极限法(Kaplan-Meier Method)分析生存率,采用Logrank法检验生存分析差异,P<0.05为差异有统计学意义。
2 结果
2.1 Integrin β1和MMP-9蛋白在结直肠癌组织中表达
免疫组织化学SP法染色结果显示在结直肠癌组织、癌旁组织以及正常肠黏膜组织的细胞膜和/或胞质中均可见黄色着色颗粒(见图1),说明Integrin β1和MMP-9在结直肠癌组织、癌旁组织及正常肠黏膜组织中均有表达。Integrin β1蛋白在结直肠癌组织、癌旁组织和正常肠黏膜组织中的阳性表达率分别为82.69%、14.29%及6.45%,差异有统计学意义(P<0.05);MMP-9在结直肠癌组织、癌旁组织及正常肠黏膜组织中的阳性表达率分别为80.77%、16.67%及9.68%,差异有统计学意义(P<0.05)(见表 1)。Integrin β1和MMP-9蛋白在结直肠癌组织中表达水平与临床病理指标间的关系经进一步统计学分析显示,Integrin β1和MMP-9蛋白的表达与肝转移和Dukes分期相关(P<0.05)(见表 2)。
2.2 Integrin β1和MMP-9蛋白表达与术后生存时间的关系
本实验随访期限为5年,其中失访2例。在结直肠癌组织中,Integrin β1表达阳性组的平均生存时间为(32.34±1.93)个月,Integrin β1表达阴性组的平均生存时间为(53.5±1.3)个月,两组比较差异有统计学意义(P=0.001)(见图2)。MMP-9表达阳性组的平均生存时间为(30.05±2.17)个月,MMP-9表达阴性组的平均生存时间为(49.31±1.19)个月,两组比较差异有统计学意义(P=0.004)(见图3)。
2.3 Integrin β1和MMP-9蛋白表达与术后复发的关系
对52例患者进行随访的过程中,失访2例,2例死于其他疾病,48例纳入考察。发现有27例患者术后出现复发,其中5例再次进行手术。术后复发情况与Integrin β1和MMP-9 2种蛋白表达水平的关系见表3,Integrin β1表达阳性组的复发率高于阴性组,MMP-9表达阳性组的复发率同样高于阴性组。
2.4 Integrin β1和MMP-9蛋白表达的相关性分析
Integrin β1和MMP-9 2种蛋白的表达呈正相关(r=0.981,P=0.001)。见表 4。
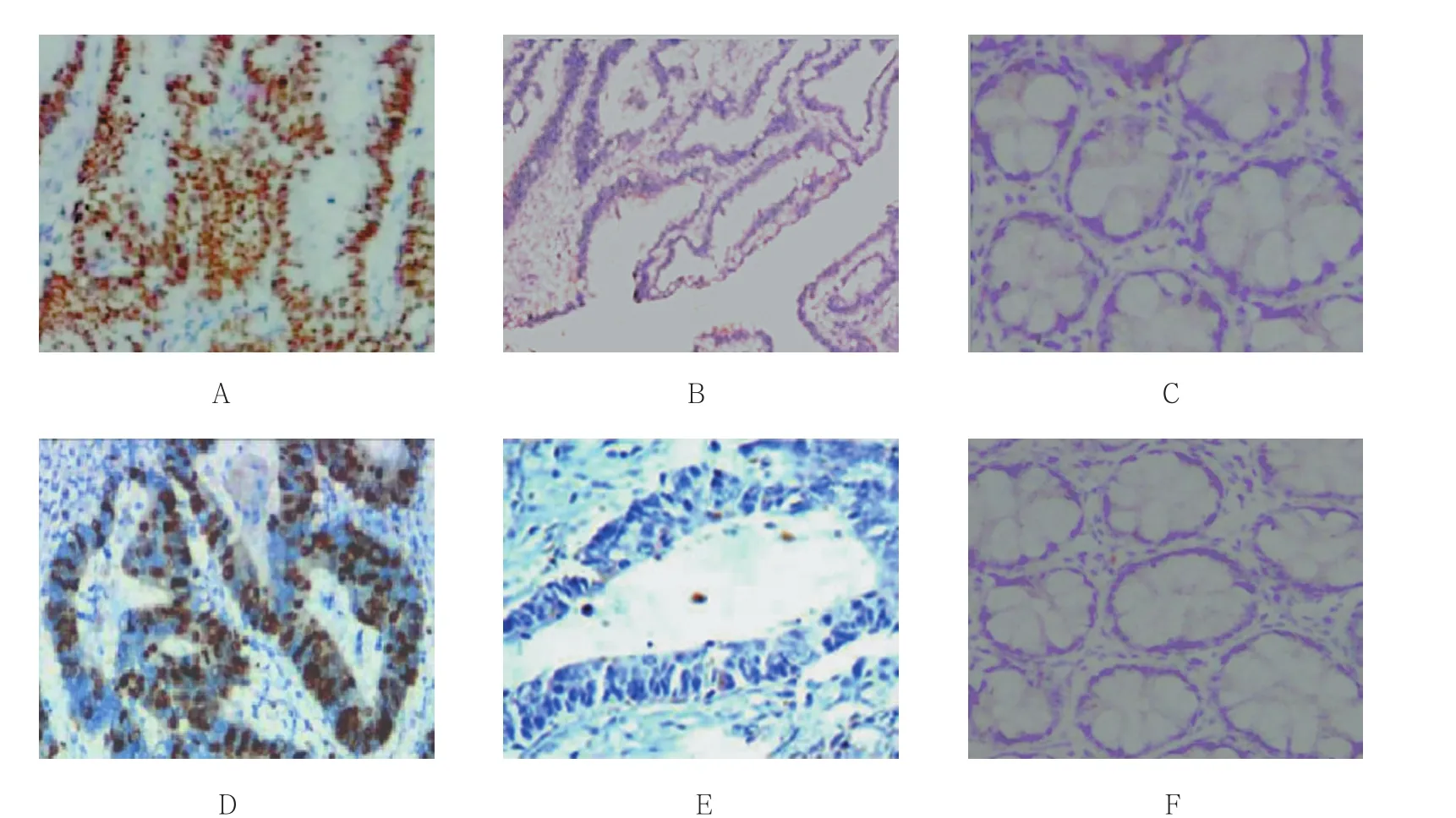
图1 Integrin β1和MMP-9蛋白表达结果 (免疫组织化学SP法染色×400)
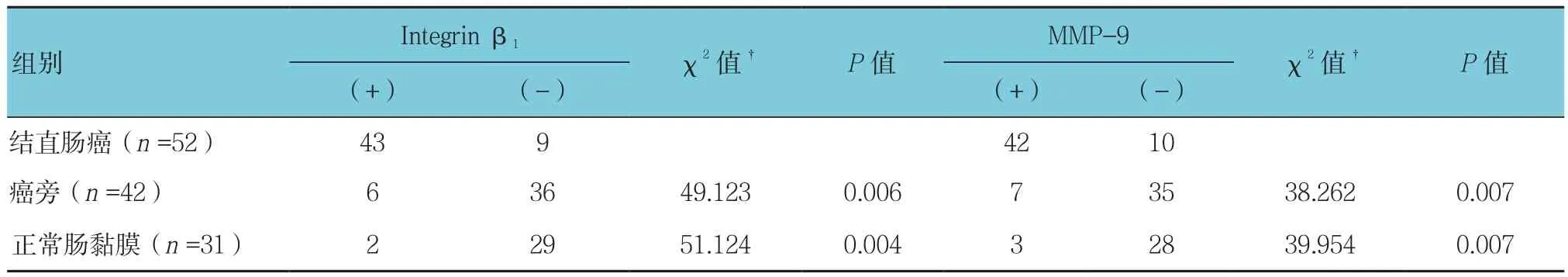
表1 Integrin β1和MMP-9蛋白表达
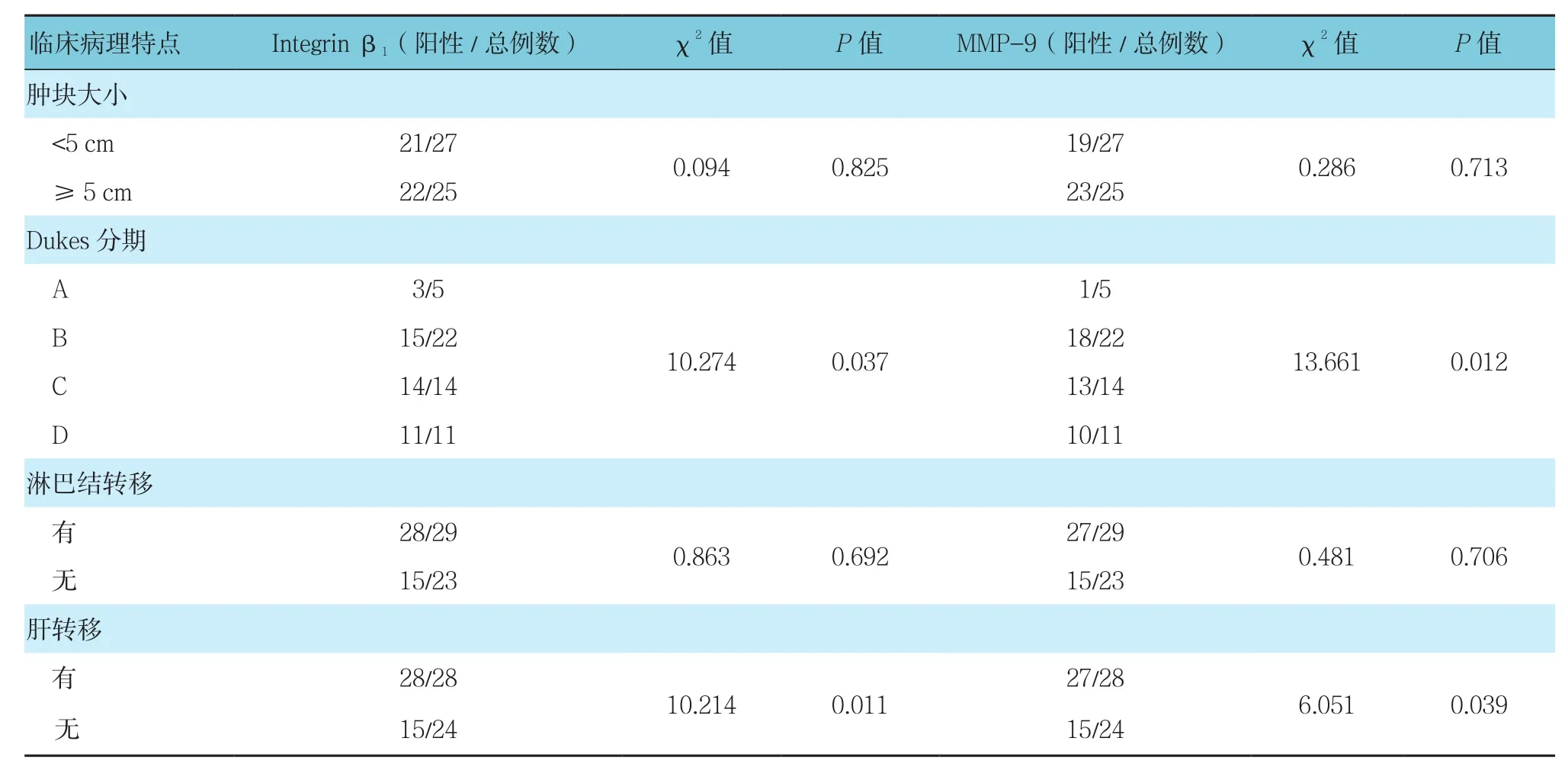
表2 Integrin β1和MMP-9蛋白表达和结直肠癌患者临床病理特点的关系

图2 结直肠癌组织中Integrin β1对患者术后生存时间的影响
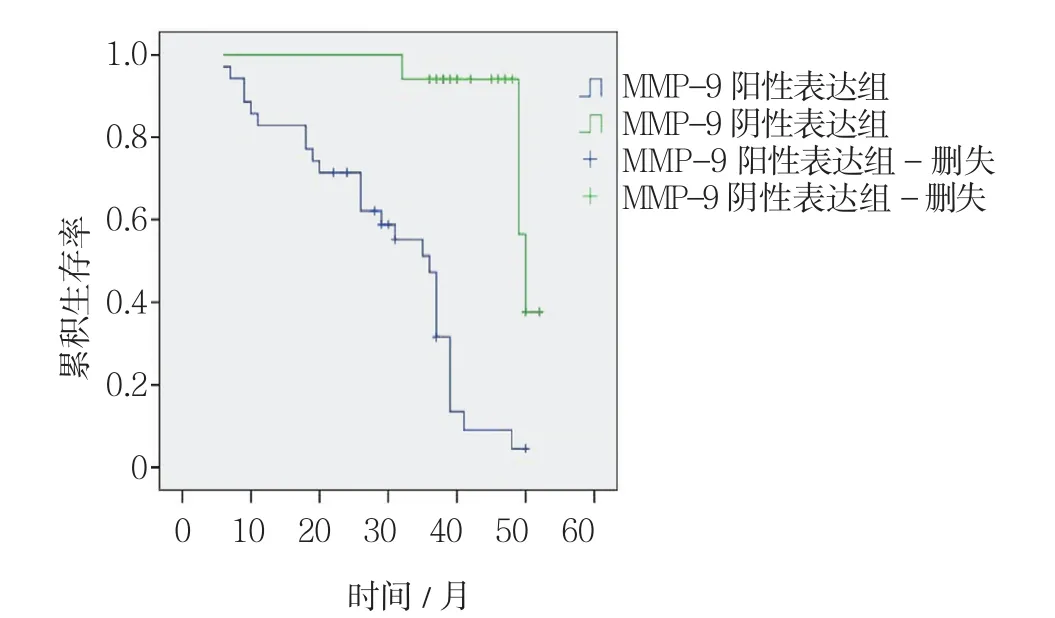
图3 结直肠癌组织中MMP-9对患者术后生存时间的影响
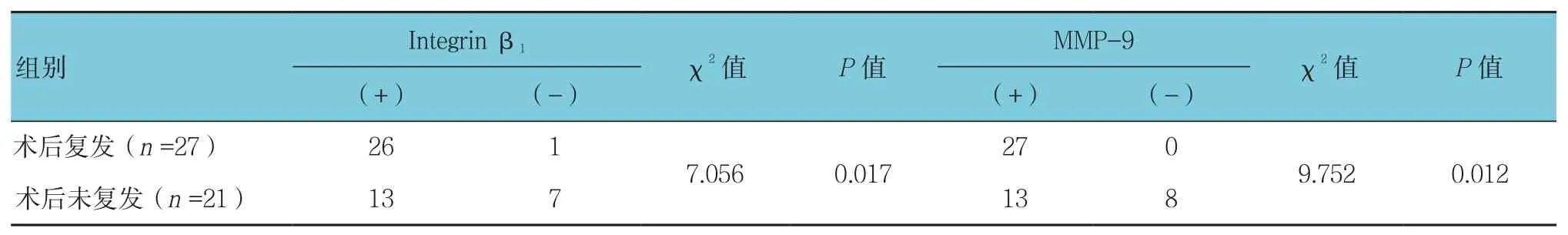
表3 结直肠癌术后复发与Integrin β1和MMP-9表达水平的关系
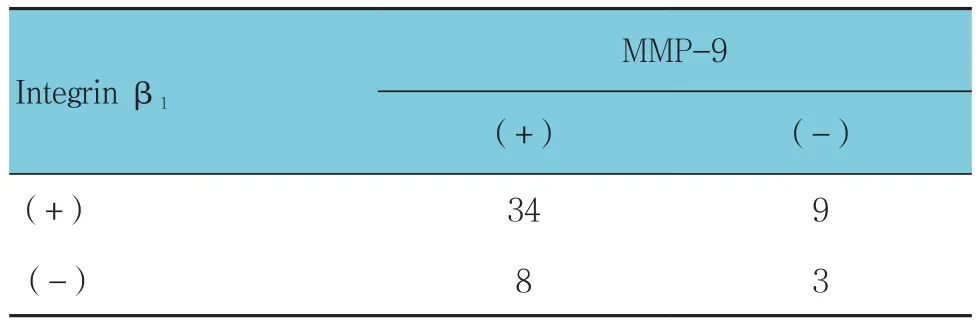
表4 Integrin β1和MMP-9蛋白表达的相关性
3 讨论
恶性肿瘤的一个重要生物学特性即是其极强的侵袭迁移能力,该能力不仅关系着患者的临床治疗效果及预后,还是患者术后复发及生存率下降的主要原因。结直肠癌作为一种常见的消化系统肿瘤,其侵袭迁移过程也是研究者们关注的重点之一。结直肠癌的远距脏器转移及侵袭是一个多因素共同参与的复杂过程,其中细胞的黏附是一个重要的环节。本研究通过对52例结直肠癌患者的病理标本、42例癌旁组织标本及31例非肠癌患者正常肠黏膜组织标本的对照研究,分析与细胞黏附密切相关的2个因子Integrin β1和MMP-9在结直肠癌中的表达情况。
免疫组织化学染色结果显示,Integrin β1和MMP-9蛋白在结直肠癌患者的病理组织中表达高于癌旁组织及正常肠黏膜组织,证实Integrin β1和MMP-9蛋白的表达与肿瘤的发生有密切的关系。同时对患者的临床病理资料进行统计学分析,结果显示Integrin β1和MMP-9的表达与结直肠癌的肝转移和Dukes分期相关。Integrin β1蛋白的表达对判断结直肠癌的病理进程和分期具有重要的参考意义,Integrin β1和MMP-9可作为新的衡量结直肠癌病理进程及转移的分子标记物。
此外本研究还分析了患者的5年生存情况及术后复发情况与这2种蛋白之间的关系。结果发现,Integrin β1和MMP-9阳性表达组的患者术后复发率高于阴性组,且5年术后生存时间明显缩短,不利于患者预后。MMP-9属于基质MMPs超家族的一员,大量的研究均证实MMPs表达增强或活性增加可导致结直肠癌的不良预后[14-15],与本研究结果具有一致性。MMP-9的表达受多种调节因子的影响,有研究表明[16],整合素家族中Integrin αvβ3可促进肿瘤细胞的分泌,诱导MMPs的激活,参与肿瘤的侵袭迁移。本研究分析结直肠癌中Integrin β1和MMP-9蛋白表达的相关性,结果显示两者的表达呈正相关,提示Integrin β1和MMP-9在结直肠癌的侵袭转移中具有协同作用,但是两者参与调控肿瘤转移的具体作用机制还有待进一步的研究。
综上所述,Integrin β1及MMP-9在结直肠癌组织中表达升高,两者皆与结直肠癌的病理特征和肿瘤的侵袭转移密切相关,同时影响结直肠癌患者的术后复发及生存,此外在结直肠癌发病的过程中两者的高表达可能具有协同作用,所以Integrin β1及MMP-9可以作为今后治疗和预后结直肠癌的新靶点。
参 考 文 献:
[1] GIULIANI J, BONETTI A. The pharmacological costs of complete liver resections in unselected advanced colorectal cancer patients:focus on targeted agents. A review of randomized clinical trials[J].J Gastrointest Cancer, 2016, 47(4): 341-350.
[2] MORIARITY A, O’SULLIVAN J, KENNEDY J, et al. Current targeted therapies in the treatment of advanced colorectal cancer: a review[J]. Ther Adv Med Oncol, 2016, 8(4): 276-293.
[3] ARITA T, ICHIKAWA D, KONISHI H, et al. Tumor exosomemediated promotion of adhesion to mesothelial cells in gastric cancer cells[J]. Oncotarget, 2016, 7(35): 56855-56863.
[4] HAASE G, GAVERT N, BRABLETZ T, et al. the wnt target gene l1 in colon cancer invasion and metastasis[J].Cancers (Basel),2016, 8(5): E48.
[5] SLUITER N, DE CUBA E, KWAKMAN R, et al. Adhesion molecules in peritoneal dissemination: function, prognostic relevance and therapeutic options[J]. Clin Exp Metastasis, 2016,33(5): 401-416.
[6] PAN L, ZHAO Y, YUAN Z, et al. Research advances on structure and biological functions of integrins[J]. Springer Plus, 2016, 5(1):1094.
[7] THARMALINGAM S, HAMPSON D R. The Calcium-Sensing Receptor and Integrins in Cellular Differentiation and Migration[J].Front Physiol, 2016, 7: 190.
[8] XU Y, ZHANG H, LIT LC, et al. The kinase LMTK3 promotes invasion in breast cancer through GRB2-mediated induction ofintegrin β1[J]. Sci Signal, 2014, 7(330): ra58.
[9] ZSCHEPPANG K, KURTH I, WACHTEL N, et al. efficacy of beta1 integrin and egfr targeting in sphere-forming human head and neck cancercells[J]. J Cancer, 2016, 7(6): 736-745.
[10] VAY C, HOSCH S B, STOECKLEIN N H, et al. Integrin expression in esophageal squamous cell carcinoma: loss of the physiological integrinexpression pattern correlates with disease progression[J]. PLoS One, 2014, 9(11): e109026.
[11] DARLIX A, LAMY P J, LOPEZ-CRAPEZ E, et al. Serum HER2 extra-cellular domain, S100ß and CA 15-3 levels are independent prognostic factors in metastatic breast cancer patients[J]. BMC Cancer, 2016, 16: 428.
[12] VERMA S, KESH K, GUPTA A, et al. An overview of matrix metalloproteinase 9 polymorphism and gastric cancer risk[J].Asian Pac J Cancer Prev, 2015, 16(17): 7393-7400.
[13] SOLOVУEVA N I, TIMOSHENKO O S, GUREEVA T A, et al.Matrix metalloproteinases and their endogenous regulators in squamous cervical carcinoma (review of the own data)[J]. Biomed Khim, 2015, 61(6): 694-704.
[14] HERSZÉNYI L, HRITZ I, LAKATOS G, et al. The behavior of matrix metalloproteinases and their inhibitors in colorectal cancer[J]. Int J Mol Sci, 2012, 13(10): 13240-13263.
[15] GROBLEWSKA M, MROCZKO B, SZMITKOWSKI M. The role of selected matrix metalloproteinases and their inhibitors in colorectal cancerdevelopment[J]. Postepy Hig Med Dosw(Online), 2010, 64: 22-30.
[16] COHEN K, FLINT N, SHALEV S, et al. Thyroid hormone regulates adhesion, migration and matrix metalloproteinase 9 activity via αvβ3 integrin in myeloma cells[J]. Oncotarget, 2014,5(15): 6312-6322.

