脉冲高容量血液滤过对重症急性胰腺炎患者血清HMGB1的影响*
龚曼芹,王宇静,王庆秋,李兆,李英
[海口市人民医院(中南大学湘雅医院附属海口医院) 血液净化科,海南 海口 570208]
重症急性胰腺炎(severe acute pancreatitis,SAP)是急性胰腺炎的急重症,常引发全身炎症反应综合征,并最终导致多器官功能衰竭,病死率高达20%~30%。大量研究表明,炎症因子可导致胰腺及全身的微循环障碍,在SAP发病及疾病进展过程起重要的作用。新近研究发现,高迁移率族蛋白B1(HMGB1)是重要的晚期炎症因子,参与脓毒症、肿瘤、急性肺损伤、关节炎、肝炎、胰腺炎等疾病的发生、发展,并在感染性休克、全身炎症反应综合征及MODS中起重要作用[1-2]。血液滤过可有效清除低于25~40 KD的中分子物质和炎症介质,从而减轻全身炎症反应。目前血液滤过的超滤量的国内外研究结果尚不一致。常规的持续静脉静脉血液滤过(CVVH)使用常规剂量35 ml/(kg·h),脉冲式高容量血液滤过(pulse highvolume hemofiltration,PHVHF)的治疗方案是在高容量血液滤过(pulse high-volume hemofiltration,HVHF)基础上结合临床实践提出的,即每日短时间(6~8 h)运用85 ml/(kg·h)HVHF,再进行常规剂量3 ml/(kg·h)的CVVH治疗[3-5]。目前,CVVH和PHVHF对SAP患者炎症介质清除的效果尚无定论。本研究拟观察SAP患者血清HMGB1的水平,并比较CVVH和PHVHF对SAP患者血清HMGB1、CRP、TNF-α、ET水平及APACHEⅡ评分的影响。
1 资料与方法
1.1 研究对象
选取海口市人民医院2015年1~12月确诊为SAP患者42例。其中3例患者因72 h内死亡剔除,共39例患者进行随机分组,其中19例分入CVVH组,20例分入PHVHF组。纳入标准:SAP的诊断参照1992年Atlanta International Conference on Pancreatic Diseases 制订的标准:①重症急性胰腺炎出现单个或多个脏器功能障碍,或出现胰腺坏死、脓肿或假性囊肿等局部并发症者;②腹部体征包括腹胀、腹部压痛、反跳痛、肌紧张、肠鸣音减弱或消失、腹部包块、腰胁部皮下淤斑征或脐周皮下淤斑征;③可伴有严重的代谢功能紊乱,如低钙血症(Ca<1.8 mmol/L);APACHEⅡ评分≥8分。排除标准:年龄<18或>80岁和怀孕期妇女。
1.2 治疗方法
患者入院后均入ICU病房,给予禁食禁饮、解痉、胃肠减压、抗感染、生长抑素抑制胰酶分泌及对症支持治疗,根据呼吸状况和血气分析结果,给予气管插管、机械通气或高流量面罩吸氧。在常规内科治疗基础上,于入院确诊24 h内行血液滤过治疗,血管通路采用股静脉置管,血液透析机采用金宝AK96,滤器采用AN69HF空心纤维(面积1.6 m2),抗凝方式采用肝素或低分子肝素抗凝,稀释方式采用前稀释法。CVVH组进行常规剂量35 ml/(kg·h)血液滤过,持续72 h。PHVHF组,每日短时间(6~8 h)运用85 ml/(kg·h)高容量血液滤过,此后再进行常规剂量35 ml/(kg·h)的CVVH治疗,持续72 h。
1.3 检测指标
于0、24、48及72 h,各时间点分别抽取右侧挠动脉血 5 ml,1 500 r/min,离心 10 min,留取血清,-70℃保存备用。
1.3.1 HMGB1的检测 使用酶联免疫吸附测定(ELISA)方法测定HMGB1,试剂盒购自武汉博士德生物工程有限公司,严格按照试剂盒说明书操作步骤进行测定。
1.3.2 CRP、TNF-α的检测 TNF-α采用放射免疫法测定,试剂盒购自北京科美东雅生物技术有限公司,严格按照试剂盒说明书操作步骤进行测定。CRP在该院检验科统一测定。
1.3.3 内皮素的检测 内皮素采用放射免疫法测定,试剂盒购自美国Amresco公司,均严格按照试剂盒说明书操作步骤进行测定。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,计数资料进行正态检验和方差齐性检验,两组独立样本数据分析采用独立样本t检验。治疗前后各时间比较采用重复测量设计的方差分析。相关性分析采用Pearson相关分析。计数资料用频数表示,用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 SAP患者的基本资料
SAP患者共42例,健康对照者共10例。SAP患者的年龄、性别构成、体重与健康对照者比较差异无统计学意义(P>0.05),SAP患者的ET、CRP、TNF-α、HMGB1水平高于健康对照者(P<0.05)。见表1。
2.2 HMGB1与ET、TNF-α、CRP及APACHEⅡ评分的相关性
使用Pearson相关分析对HMGB1与ET、TNF-α、CRP及APACHEⅡ评分进行相关性分析。HMGB1和ET正相关(r=0.912,P=0.012),HMGB1和CRP呈正相关(r=0.678,P=0.034),HMGB1和TNF-α呈正相关(r=0.906,P=0.027),HMGB1和APACHEⅡ无相关性(r=0.287,P=0.065)。见图1。
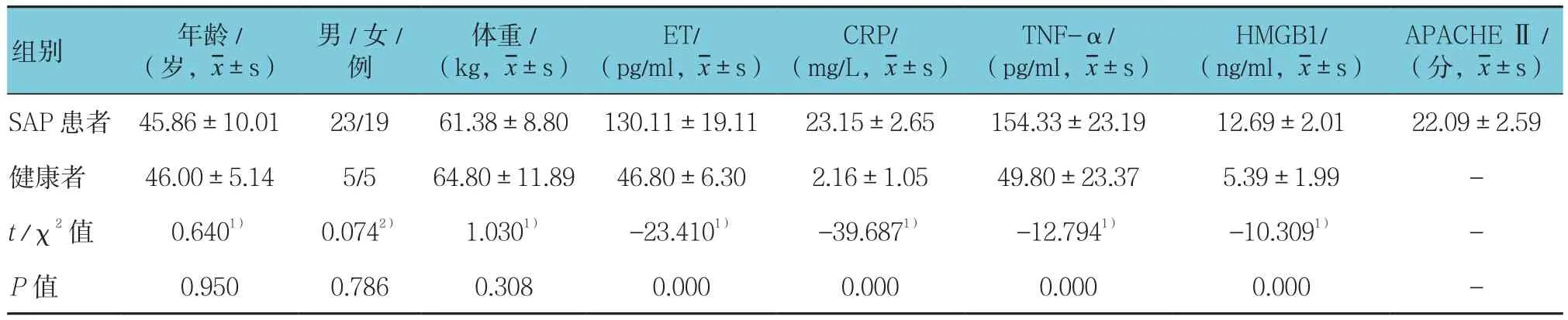
表1 SAP患者的基本资料
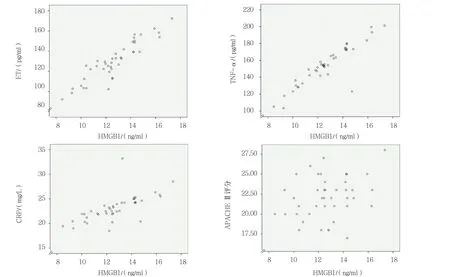
图1 HMGB1与ET、TNF-α、CRP及APACHEⅡ评分Pearson相关分析散点图
2.3 两组的基本资料比较
CVVH组共19例,PHVHF组共20例。CVVH组与PHVHF组的年龄、体重、ET、CRP、TNF-α及HMGB1、APACHEⅡ评分差异均无统计学意义(P>0.05)。见表 2。
2.4 两组各时间血清HMGB1、CRP、TNF-α、ET水平及APACHEⅡ评分的比较
最终完成观察的CVVH组共19例,PHVHF组共20例。使用重复测量设计的方差分析。在CVVH组和PHVHF组之间的比较差异有统计学意义(P<0.05),每组内不同时间的比较差异有统计学意义(P<0.05),分组与时间无交互作用(P>0.05)。具体统计值如下:HMGB1 组间(F=3.857,P=0.047),组内(F=306.266,P=0.000),分组与时间(F=4.663,P=0.137)。CRP组间(F=3.183,P=0.044),组内(F=125.182,P=0.000),分组与时间(F=3.262,P=0.063)。TNF-α组间(F=3.404,P=0.043),组内(F=294.924,P=0.000),分组与时间(F=2.066,P=0.159)。ET组间(F=5.721,P=0.038),组内(F=193.985,P=0.000),分组与时间(F=1.840,P=0.158)。APACHEⅡ评分组间(F=5.106,P=0.030),组内(F=313.578,P=0.000),分组与时间(F=2.311,P=0.066)。见表3和图2。
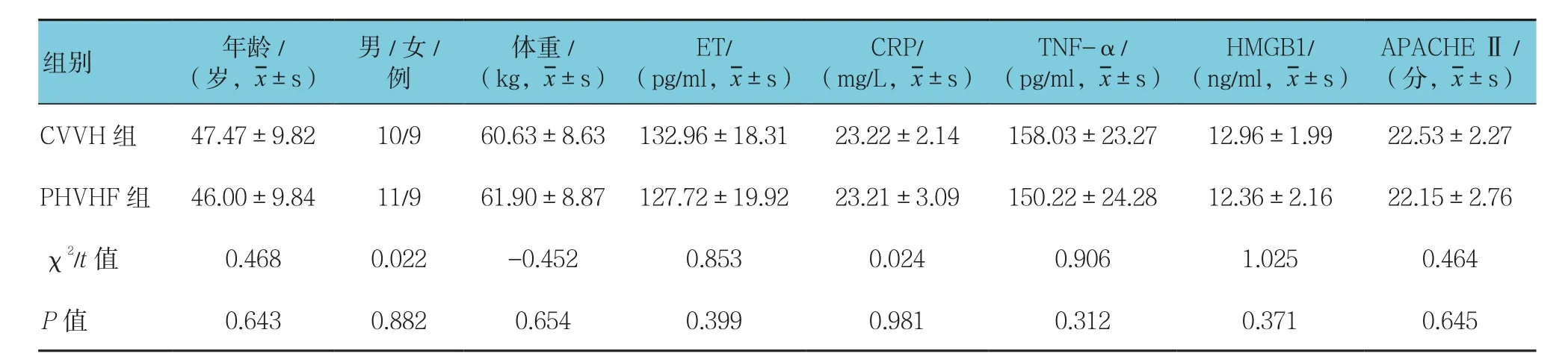
表2 两组的基本资料比较
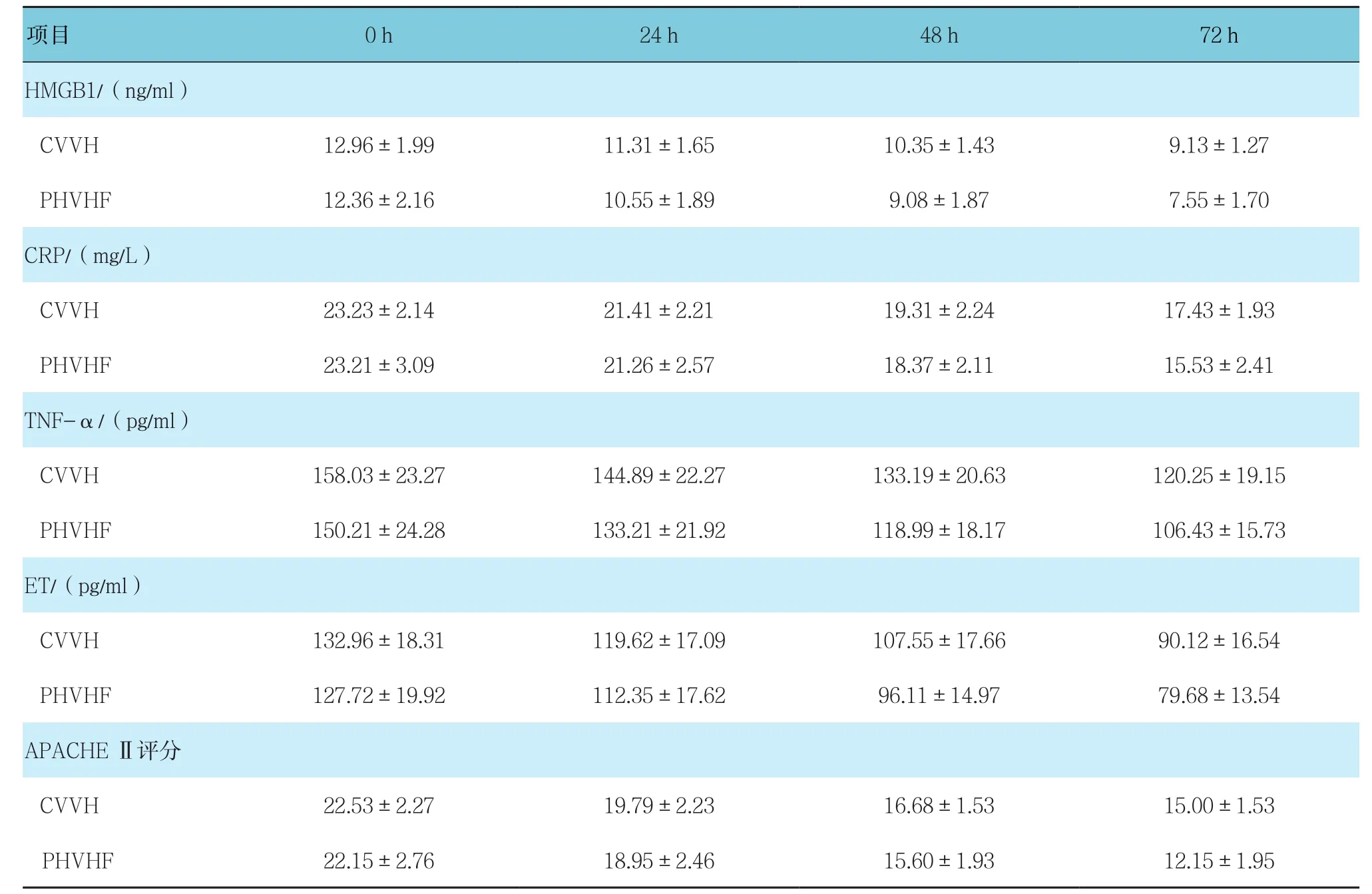
表3 两组各指标相同时间的比较
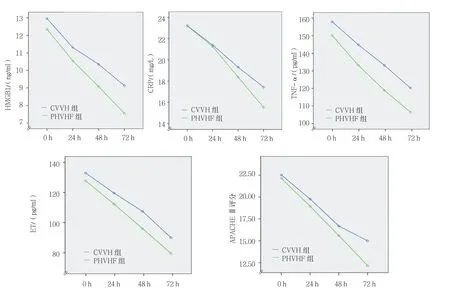
图2 两组重复测量设计的方差分析统计图
3 讨论
SAP引发全身炎症反应是导致患者预后不良的核心原因。SAP中存在哪些重要炎症因子,如何阻断过度激活的炎症反应一直是SAP研究的热点。本研究结果提示新近发现的晚期炎症因子HMGB1在SAP患者血清中升高,并且与ET、TNF-α、CRP传统的炎症因子以及与预后相关的APACHEⅡ评分呈正相关。血液滤过是临床常用的较为有效的清除炎症因子的手段。在SAP患者中何种血液滤过方法更为有效,仍然存在争论。本研究结果显示PHVHF比CVVH更为有效地清除HMGB1和CRP并且降低APACHEⅡ评分。
HMGB1是一类广泛存在于真核细胞内的非组蛋白。近期发现HMGB1是重要的晚期炎症因子,参与脓毒症、肿瘤、急性肺损伤、关节炎、肝炎、胰腺炎等炎症疾病的发生、发展,并在感染性休克、全身炎症反应综合征及MODS中起重要作用。目前HMGB1已成为SAP的研究热点。SAP在体内造成应激环境,通过破坏的胰腺细胞被动分泌以及激活的单核细胞和上皮细胞主动分泌,大量的HMGB1被释放到细胞外[2]。HMGB1进入细胞外成为强有力的促炎因子,激活IL-1、IL-6及TNF-α等炎症因子,该因子可反馈性的加速HMGB1的分泌,形成恶性循环。HMGB1在SAP患者从局部炎症到系统性炎症中起重要的作用,可以引起肺损伤、肠黏膜屏障破坏以及多器官功能障碍综合征(MODS)[1,6-7]。动物研究表明,在急性胰腺炎中,HMGB1分泌较晚,通常在发病12 h后开始升高,作为晚期炎症因子参与SAP的病理生理过程,其表达增加与脏器功能损害密切相关,并且通过干预HMGB1可以改善急性胰腺炎的预后。同样在临床研究中,YASUDA等[8]发现SAP患者血清HMGB1升高,并和脏器损害程度呈正相关。KOCSIS等[9]的研究也得出类似的结论,提示HMGB1与降钙素原呈正相关。本研究结果提示SAP患者血清HMGB1高于正常人群,并且和传统的炎症因子TNF-α、CRP呈正相关,与提示SAP患者预后的APACHEⅡ评分呈正相关。该点与既往的研究结果相一致。进一步,本研究结果提示HMGB1与ET呈正相关,提示HMGB1在微循环障碍中可能起到重要作用。本结果表明HMGB1与SAP炎症反应关系密切。因此干预HMGB1的方法成为未来研究的方向之一。
胰腺微循环障碍一直被认为是急性胰腺炎发展的重要因素之一[10-11]。动物研究表明,急性胰腺炎早期即出现血管收缩,使胰腺血流速度减慢,有效毛细血管密度降低,红细胞密度降低,造成胰腺缺血及血流停滞,最终导致微循环障碍[12]。关于急性胰腺炎临床研究的数据较少,通常来自一些间接的指标。一般通过观察病理组织的血管壁坏死,白细胞浸润,局部出血以及血管内微血栓形成来间接的判断微循环障碍。急性胰腺炎时,与白细胞-内皮细胞交互相关的多种因子的表达出现改变,这些因子参与微循环障碍,比如:ET、缓激肽、P选择素、E选择素、凝血酶原活化因子(PAF)及细胞间黏附分子(ICAM)等。其中ET可以减少胰腺的血流,增加内皮通透性,促进白细胞募集,加重微循环障碍。既往研究发现急性胰腺炎时ET升高,通过ET拮抗剂,ET受体阻滞剂可以改善胰腺微循环[13-14]。但ET拮抗剂及ET受体阻滞剂存在较严重的副作用,仍然处于动物实验阶段。本研究结果提示SAP患者中ET水平升高,通过血液滤过CVVH和PHVHF的方法可降低ET水平,但PHVHF与CVVH比较差异无统计学意义,可能对患者微循环的改善起到相同的作用。
目前临床中仍无有效的方法对HMGB1进行干预。动物研究提示,使用HMGB1抗体、丙酮酸乙酯(EP)、吡咯烷二硫代氨基甲酸酯(PDTC)及蜈蚣提取物(SSM)等得到了抑制炎症、改善预后的效果。但离临床应用仍有很远的距离,大部分胰腺炎患者在发病3 d后才能得到有效治疗。与临床试验不同,动物实验中可以在SAP早期使用干预手段,而临床实际中不可能[7]。因此,如何找到在晚期抑制炎症的方法尤为重要。越来越多的研究表明,CVVH通过清除炎症因子,可以改善SAP的预后[15-16]。尤其是HVHF的效果更优[17-18]。但HVHF要求大量的血流量,严格的超滤控制和昂贵的无菌透析液。2004年RONCO率先开展PHVHF并得到较好的效果。本研究显示,PHVHF组比CVVH对炎症因子的清除更有效,降低APACHEⅡ评分更显著。提示在SAP患者中使用PHVHF可以更好地清除炎症因子,改善预后。本研究未观察到PHVHF可以进一步的减少血清TNF-α和ET水平,考虑可能原因为PHVHF和CVVH对微循环障碍的改善作用相同。也可能由于观察病例较少,差异无统计学意义。另外,本研究不足之处为观察时间较短,没有观察临床终点。
总而言之,SAP患者的血清HMGB1升高,并与ET,CRP,TNF-α水平呈正相关。对比CVVH,PHVHF更有效地降低血清HMGB1、CRP水平及APACHEⅡ评分。
参 考 文 献:
[1] LI G, WU X, YANG L, et al. TLR4-mediated NF-kappaB signaling pathway mediates HMGB1-induced pancreatic injury in mice with severe acute pancreatitis[J]. International Journal of Molecular Medicine, 2016, 37(1): 99-107.
[2] SHEN X, LI W Q. High-mobility group box 1 protein and its role in severe acute pancreatitis[J]. World Journal of Gastroenterology,2015, 21(5): 1424-1435.
[3] LEHNER G F, WIEDERMANN C J, JOANNIDIS M. High-volume hemofiltration in critically ill patients: a systematic review and meta-analysis[J]. Minerva anestesiologica, 2014, 80(5): 595-609.
[4] WANG S, XU L, FENG X, et al. Is continuous venovenous hemofiltration effective against severe acute pancreatitis[J].Artificial organs, 2013, 37(7): 615-622.
[5] CHU L P, ZHOU J J, YU Y F, et al. Clinical effects of pulse highvolume hemofiltration on severe acute pancreatitis complicated with multiple organ dysfunction syndrome[J]. Therapeutic Apheresis and Dialysis, 2013, 17(1): 78-83.
[6] ZHANG T, XIA M, ZHAN Q, et al. Sodium butyrate reduces organ injuries in mice with severe acute pancreatitis through inhibiting HMGB1 expression[J]. Digestive Diseases and Sciences, 2015,60(7): 1991-1999.
[7] SCHNEIDER L, JABRAILOVA B, STROBEL O, et al.Inflammatory profiling of early experimental necrotizing pancreatitis[J]. Life Sciences, 2015, 126: 76-80.
[8] YASUDA T, UEDA T, TAKEYAMA Y, et al. Significant increase of serum high-mobility group box chromosomal protein 1 levels in patients with severe acute pancreatitis[J]. Pancreas, 2006 Nov,33(4): 359-363.
[9] KOCSIS A K, SZABOLCS A, HOFNER P, et al. Plasma concentrations of high-mobility group box protein 1, soluble receptor for advanced glycation end-products and circulating DNA in patients with acute pancreatitis[J]. Pancreatology: Official Journal of the International Association of Pancreatology (IAP),2009, 9(4): 383-391.
[10] CUTHBERTSON C M, CHRISTOPHI C. Disturbances of the microcirculation in acute pancreatitis[J]. The British Journal of Surgery, 2006, 93(5): 518-530.
[11] GASIOROWSKA A, TALAR-WOJNAROWSKA R, KACZKA A, et al. Subclinical inflammation and endothelial dysfunction in patients with chronic pancreatitis and newly diagnosed pancreatic cancer[J]. Digestive Diseases and Sciences, 2016, 61(4): 1121-1129.
[12] JANISCH N H, GARDNER T B. Advances in management of acute pancreatitis[J]. Gastroenterology Clinics of North America,2016, 45(1): 1-8.
[13] FOITZIK T, FAULHABER J, HOTZ H G, et al. Endothelin mediates local and systemic disease sequelae in severe experimental pancreatitis[J]. Pancreas, 2001, 22(3): 248-254.
[14] EIBL G, FORGACS B, HOTZ H G, et al. Endothelin A but not endothelin B receptor blockade reduces capillary permeability in severe experimental pancreatitis[J]. Pancreas, 2002, 25(2): e15-20.
[15] LI W Q, TONG Z H, QUAN Z F, et al. Treatment experience of severe acute pancreatitis on 1033 cases[J]. Chinese Journal of Surgery, 2009, 47(19): 1472-1482.
[16] PUPELIS G, ZEIZA K, PLAUDIS H, et al. Conservative approach in the management of severe acute pancreatitis: eight-year experience in a single institution[J]. HPB, 2008, 10(5): 347-355.
[17] PUPELIS G, PLAUDIS H, GRIGANE A, et al. Continuous veno-venous haemofiltration in the treatment of severe acute pancreatitis: 6-year experience[J]. HPB, 2007, 9(4): 295-301.
[18] LI W, YAN X, WANG H, et al. Effects of continuous high-volume hemofiltration on experimental severe acute pancreatitis in pigs[J].Pancreas, 2007, 34(1): 112-119.

