红龙鱼源β-溶血性嗜水气单胞菌AH的分离及其对机体铁代谢的影响
余文杰, 陈观水
(1.漳州职业技术学院食品与生物工程系,福建漳州 363000; 2.福建农林大学生命科学学院,福建福州 350001)
红龙鱼是我国主要的观赏鱼品种之一,许多养殖场和鱼类爱好者均有饲养。目前福建省已形成相当规模的红龙鱼养殖产业。由于红龙鱼的高蛋白饵料投喂造成其生长水体恶化,而大部分养殖场忽视了防病措施,鱼体传染性病日趋严重,发病率高达75%以上,造成极大的经济损失。2016年5月份福建省一些养殖场暴发红龙鱼疾病,其体表出现溃疡,严重者口鼻充血、流血,解剖后内脏肝、脾、肾肿大。经过细菌分离鉴定发现,主要原因是嗜水气单胞菌的大量感染。目前已经发现嗜水气单胞菌中存在2种β-溶血性毒素,分别是毒力因子溶血素和气溶素[1]。嗜水气单胞菌中溶血性毒素会导致胞质内容物泄漏,最终引发细胞死亡。前人研究表明,aerA基因和ahh1基因分别负责翻译生产溶血素和气溶素。血液中铁元素在水产动物机体内是免疫系统发挥作用的重要因子,可影响鱼体巨噬细胞的杀菌功能和免疫细胞的增殖与活性。同时,铁元素也是病原微生物和宿主相互竞争的对象,机体可以通过调节铁相关基因,从而抑制病原微生物的侵害。Hepcidin基因(hepc)是一种主要由肝细胞产生的防御性抗菌肽,具有抑菌活性,同时也是机体铁代谢的关键调节因子,对维持铁平衡具有重要作用,也称为铁调素[2]。白细胞介素6(简称il-6)炎性因子能强烈地刺激铁调素的表达。而il-6炎性因子是通过刺激蛋白酪氨酸激酶/信号转导子和转录激活子(简称JAK/STAT)信号通路调节铁调素表达[3]。本试验拟通过红龙鱼源β-溶血性嗜水气单胞菌AH的分离鉴定,然后检测受嗜水气单胞菌AH侵染后红龙鱼铁代谢水平和肝脏中hepc、il-6、蛋白质酪氨酸激酶3基因(jak3)、信号转导子和转录激活因子3基因(stat3)表达量的变化,进而研究β-溶血性嗜水气单胞菌AH侵染和鱼体铁代谢之间的相互作用,为进一步分析铁相关基因在受感染寄主应对细菌侵染中的作用提供科学研究依据。
1 材料与方法
1.1 染病红龙鱼采集与病原菌的分离
染病红龙鱼典型患病特征为败血症,其主要症状为反应迟钝、摄食较少,严重者口鼻充血。解剖后可见鱼体肝脏肿大,有点状出血,肾脏、肠道充血。在无菌条件下从染病红龙鱼的肝、肾、皮肤和血液取样,用营养琼脂平板划线分离,30 ℃ 培养24 h,挑取单菌落进行纯化培养,菌株低温保存备用。
1.2 细菌鉴定
通过细菌形状、革兰氏染色和氧化酶检测,采用法国梅里埃生物公司革兰氏阴性或阳性鉴定试剂条,用VITEK-32全自动细菌鉴定仪鉴定。
1.3 化学试剂和生物试剂盒
化学试剂购自上海一基实业有限公司,生物试剂盒购自深圳市长征生物科技有限公司。引物和反应条件参照前人描述的方法[4]。引物由宝生物工程(大连)有限公司合成(表1)。
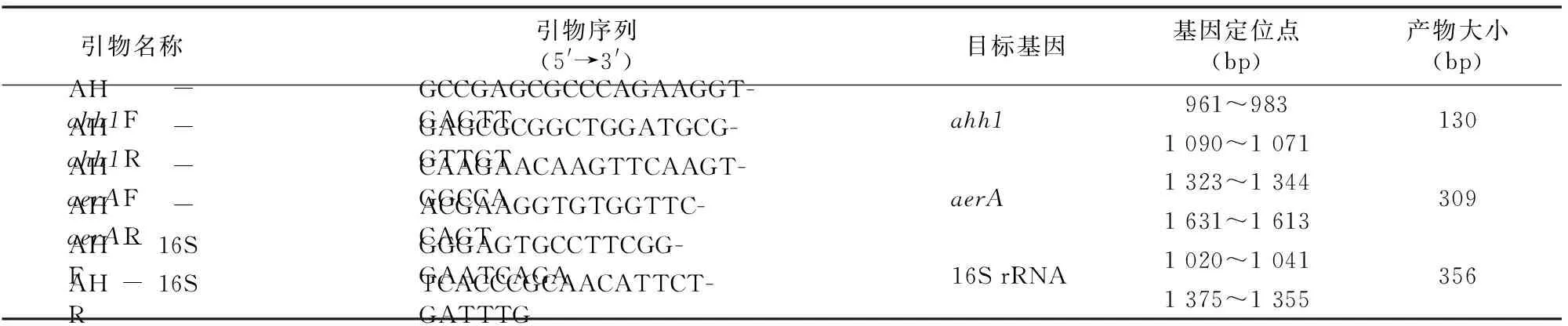
表1引物序列和目标基因
1.4 试验菌株DNA提取
细菌DNA制备依据相应的DNA提取试剂盒产品说明书(北京普洛麦格生物技术有限公司)。
1.5 PCR条件
PCR反应条件包括3对引物的PCR反应。PCR反应溶液(25 μL)包含12.5 μLTaq酶,1.0 μLahh1引物,1.0 μLaerA引物,0.2 μL 16S rRNA引物和1 μL DNA样品,其余为双蒸水。PCR(仪器型号为ABI-2720,美国贝登仪器公司)扩增采用下列条件:95 ℃ 5 min;95 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。扩增的DNA片段的电泳检测条件:2%琼脂糖凝胶水平电泳,1×TAE缓冲区(0.04 mol/L Tris,0.02 mol/L醋酸,0.002 mol/L Na2EDTA),100 V,45 min,使用8 μL PCR产物。凝胶使用1 μL/mL溴化乙锭染色 30 min,在紫外线光照下观察。基因大小标准品采用100个碱基对的DNA梯度标记物(上海启发试验试剂有限公司)。
1.6 试验用鱼
试验用健康红龙鱼购自福建省农业科学院水产养殖基地,选择外观健康和大小相似的红龙鱼幼鱼,鱼体质量为(100±5)g,体长为(20±1)cm。将试验红龙鱼随机分为2个处理组:试验组和对照组,每个处理组设3个平行,每个平行50尾,共300尾。
1.7 嗜水气单胞菌AH侵染和样品采集
根据前期试验结果,采用嗜水气单胞菌AH侵染的最适菌悬液浓度为1.0×106CFU/mL。将培养的嗜水气单胞菌AH用0.65%无菌生理盐水洗脱,稀释成1.0×106CFU/mL的菌悬液,通过红龙鱼腹腔注射,注射前鱼体用200 mg/L丁香酚轻度麻痹,试验组每尾注射0.1 mL菌悬液,对照组注射等量无菌生理盐水。注射后6、12、24、48、72、84、96 h独立采集试验组、对照组鱼各3尾,将一次性注射器用肝素钠(1 000 IU/mL)润洗后从鱼体尾静脉取血0.5~0.8 mL。采血后鱼体立即解剖,取出肝脏组织置于液氮中,于-80 ℃保存,用于肝脏铁含量和基因表达测定。
1.8 血清铁浓度、总铁结合力的测定
血清样品制备:血液于40 ℃静置2 h左右,于 4 000 r/min 离心10 min后收集上层血清,-20 ℃冰箱过夜,次日血清解冻后再次低速(4 000 r/min)离心10 min,吸取上层液于-80 ℃保存备用。
血清铁浓度及总铁结合力(mg/L)的测定使用血清铁、总铁结合力试剂盒(福州先亚生物工程有限公司)。血清铁浓度的检测原理:在酸性溶液和还原剂的作用下,使转铁蛋白中铁与蛋白分离,使血清中高铁还原成亚铁,后者与双吡啶结合成粉红色的络合物,在一定范围内,铁离子的含量与色泽成正比。总铁结合力的检测原理[5]:在血清内加入过量的铁,使血清中转铁蛋白全部与铁结合,再加入铁吸附剂,将多余的铁吸附,然后依据血清铁检测方法测定铁含量,即为总铁结合力。测定步骤具体参照试剂盒说明书,利用紫外分光光度计(TU-1900,北京普析通用仪器有限公司)测定,每个样品重复检测3次。
1.9 肝脏铁浓度的测定
采用电感耦合等离子发射光谱法(简称ICP-AES)检测肝脏铁含量[5]:将肝脏样品解冻后,用低温0.9%生理盐水冲洗干净并用滤纸吸干水分,粉碎均匀后置于坩埚中,置于马弗炉内,于600 ℃灼烧5 h,直至试样呈白色或者灰白色、无炭粒为止。冷却后取出,用5 mL体积比为1 ∶1的硝酸、水溶液溶解,电炉上加热直至沸腾,过滤至50 mL容量瓶内,并用双蒸水反复洗涤坩埚和滤纸,将洗涤液并入容量瓶中,然后用双蒸水定容、混匀,作为试样溶液。同时配制试剂空白液。采用电感耦合等离子体原子发射光谱(inductively coupled plasma-atomic emission specrometry,简称ICP-AES)仪(ICP-8000,北京达丰瑞仪器有限公司)测定,每个样品重复检测3次。
1.10 肝脏铁代谢相关基因表达特征分析
根据红龙鱼hepc基因cDNA序列(基因登录号:JQ308543)、il-6基因cDNA序列(基因登录号:KJ757688)、jak3基因cDNA序列(基因登录号:AF148993)与草鱼stat3基因cDNA序列(基因登录号:JX976548)设计引物,详见表2[6-8]。采用RNAiso[宝生物工程(大连)有限公司]提取肝脏总RNA,反转录成cDNA,在实时定量PCR仪(T-100,美国伯乐仪器有限公司)上进行实时荧光定量PCR。目的基因在肝脏中的相对表达量采用2分对照法确定,选择红龙鱼18S rRNA基因作为内参(基因登录号:AB860236)[9]。实时荧光定量PCR反应体系:0.4 μL上下游引物,2 μL cDNA模板,7.2 μL ddH2O,总体积20 μL。反应条件:95 ℃ 1 min;95 ℃ 5 s,60 ℃ 20 s,72 ℃ 20 s,35个循环。溶解曲线温度为52~99 ℃。每个样品重复检测3次。

表2红龙鱼铁代谢相关基因荧光定量PCR引物序列
1.11 数据分析
所有数据均用SPSS 18.0软件进行统计分析,采用t检验法进行差异显著性分析,P<0.05表示差异显著[10]。所有数值均表示为“平均值±标准差”。
2 结果与分析
2.1 菌落特征
从染病红龙鱼肝脏中分离出1株菌株AH,经24 h营养琼脂平板培养后呈黄色,湿润圆形略隆起,边缘整齐,直径为2 mm左右,见图1。

2.2 生化反应及鉴定结果
菌株AH经过分离纯化后,用VITEK-32全自动微生物分析仪鉴定为嗜水气单胞菌,其生理、生化特性见表3。
2.3 嗜水气单胞菌AH β-溶血性毒素因子ahh1和aerA的基因分析
经过多重PCR证实,从染病红龙鱼中分离得到的嗜水气单胞菌AH携带ahh1和aerA基因。该细菌16S rRNA基因PCR扩增产物(356个碱基对)、ahh1基因扩增产物(130个碱基对)、aerA基因扩增产物(309 bp)见图2。

表3菌株AH生理、生化特性
注:“+”“-”分别表示阳性、阴性。

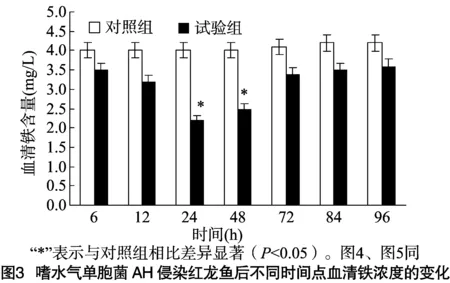
2.4 嗜水气单胞菌AH侵染红龙鱼后其血清铁浓度的变化
嗜水气单胞菌AH侵染红龙鱼后不同时间点血清中铁浓度的变化趋势如图3所示。由图3可以看出,侵染后不同时间点试验组和对照组比较,红龙鱼血清铁浓度均有不同程度的降低,侵染24、48 h后达到显著水平(P<0.05)。
2.5 嗜水气单胞菌AH侵染红龙鱼后其血清总铁结合力的变化
嗜水气单胞菌AH侵染红龙鱼后不同时间点其血清中总铁结合力的变化趋势如图4所示。由图4可以看出,侵染后试验组红龙鱼血液中血清的总铁结合力和对照组比较略有不同程度的增加,但均未达到显著水平。
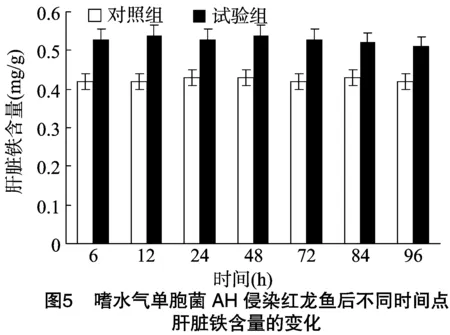
2.6 嗜水气单胞菌AH侵染红龙鱼后其肝脏铁含量的变化
由图5可以看出,嗜水气单胞菌AH侵染红龙鱼后不同时间点试验组肝脏铁含量均高于对照组,但并无显著差异。
2.7 嗜水气单胞菌AH侵染红龙鱼后对其不同时间点hepc、il-6、jak3、stat3基因表达变化
在注射嗜水气单胞菌AH后,hepc基因在不同时间点表达量相对于0 h明显上调,在6、12、24 h与0 h差异显著(P<0.05),在侵染后6 h达到最高值,随后逐渐下降。基因il-6在侵染后表达量明显上调,在24 h时表达量最高,随后有所下降,在12、24、48 h均与0 h差异显著(P<0.05);基因jak3、stat3的表达量亦均有所上调,jak3基因在12 h时表达量达到最高值(P<0.05),stat3基因在6 h时的表达量达到最高值,随后逐步下降,但仍明显高于侵染前的表达水平,详见图6。


3 结论与讨论
对染病红龙鱼肝脏取样后进行细菌的划线分离纯化,在营养琼脂平板上获得形态一致的菌落,将该菌株编号为AH,由全自动细菌分析仪鉴定其为嗜水气单胞菌。菌株AH人工感染红龙鱼试验表明,出现的症状与自然病例基本相同,鉴定的菌株与接种菌株完全一致,所观察到的菌落形态也基本相符。PCR是一种检测病原体首选的方法,它具有显著的优点,如速度快、高敏感性和特异性等[5]。本研究使用特定的毒力因子引物来证实嗜水气单胞菌AH携带气溶素和溶血素基因。菌株AH具有β-溶血性嗜水气单胞菌特征,能分泌具有溶血性、肠毒性和细胞毒性的外毒素,并能广泛地侵袭健康红龙鱼肾、脾、肺、肝、肌肉和血液等器官组织,且能大量增殖,造成广泛性出血、全身性组织损害,并使各器官组织出现肿胀、颗粒变性、玻璃样变、坏死崩解以及红细胞碎裂。解剖后观察均可见体表出现溃疡、疤痕,严重的产生口鼻充血、流血,内脏肝、脾、肾肿大,肠道充血,严重者有腹水。
红龙鱼血液中铁元素是机体内多种酶类合成的必要元素,参与细胞增殖、分化和电子转移等多种生命活动。铁也是需铁细菌增殖分化的必要元素,与致病菌毒力的强弱有关。细菌入侵宿主机体吸收铁以满足其增殖和致病力的表达。宿主通过降低机体铁代谢水平,从而抑制细菌的增殖和降低其致病力。本试验发现,侵染嗜水气单胞菌AH后红龙鱼血清铁含量有所下降,24、48 h与对照差异达到显著水平。肝脏铁含量在侵染嗜水气单胞菌AH后有所上升,但与对照的差异没有达到显著水平。这表明鱼体在侵染后通过一系列调节作用,降低机体的铁循环从而抑制细菌的侵害。侵染后红龙鱼血清总铁结合力相对于对照组有所上升,没有达到显著水平。结合细菌侵染后鱼体血清铁含量的变化和转铁蛋白含量的变化,认为血清铁和转铁蛋白的比例显著下降可以提高铁与转铁蛋白的结合效率,从而抑制嗜水气单胞菌AH从机体摄取铁的能力。
本试验检测发现,红龙鱼肝脏hepc、il-6、jak3和stat3基因在嗜水气单胞菌AH侵染后都有不同程度的上调,表明这些基因都参与了鱼体的非特异性免疫反应。hepc基因主要在肝脏中合成和分泌,可以抑制肠道铁的吸收和肝脏铁的释放以降低机体的铁相关基因水平。前人研究证实,大菱鲆在侵染细菌嗜水气单胞菌AH后,肝、脾、鳃等组织中hepc基因的表达量均显著增高。侵染链球菌后,鲈鱼肝细胞hepc的mRNA水平在数小时内明显上调。香鱼肝脏中hepc基因表达量在侵染鳗利斯顿氏菌后显著上升[11-12]。本试验中,hepc基因在侵染后不同时间点的表达量均有所上升,并在12、24 h与0 h相比达到了显著差异。机体受细菌侵害时,巨噬细胞等免疫细胞会合成和分泌大量的炎性因子,其中主要为白细胞介素6(il-6)。炎症反应可通过一系列生化过程调节hepc基因的表达,进而影响机体铁相关基因水平。il-6和受体结合后可激活jak3基因,进而磷酸化stat3,进入细胞核,调节hepc基因的转录,促进hepc基因的表达。在本试验中,在侵染嗜水气单胞菌AH后红龙鱼肝脏中il-6的表达量均有所上升,在24 h时达到最高值。基因jak3、stat3的表达量也均有所上调,分别在6、12 h时达到最高值。因此,当细菌入侵时,引起鱼体发生炎症反应,在il-6基因和JAK/STAT通路相关基因的共同作用下,hepc基因的表达量上升,从而下调鱼体的循环铁浓度,以应对细菌的侵害。
参考文献:
[1]Janda J M,Abbott S L. The genus aeromonas:taxonomy,pathogenicity,and infection[J]. Clinical Microbiology Reviews,2010,23(1):35-73.
[2]Korbsrisate S,Dumnin S,Chawengkirttikul R,et al. Distribution of aeromonas hydrophila serogroups in different clinical samples and the development of polyclonal antibodies for rapid identification of the genus aeromonas by direct agglutination[J]. Microbiology and Immunology,2002,46(12):875-879.
[3]Grim C J,Kozlova E V,Sha J,et al. Characterization of aeromonas hydrophila wound pathotypes by comparative genomic and functional analyses of virulence genes[J]. mBio,2013,4(2):e00064-13.
[4]Ansary A,Haneef R M,Torres J L,et al. Plasmids and antibiotic resistance inAeromonashydrophilaisolated in Malaysia from healthy and diseased fish[J]. Journal of Fish Diseases,1992,15(2):191-196.
[5]González-Serrano C J,Santos J A,García-López M L,et al. Virulence markers inAeromonashydrophilaandAeromonasveroniibiovar sobria isolates from freshwater fish and from a diarrhoea case[J]. J Appl Microbiol,2002,93(3):414-419.
[6]Subashkumar R,Thayumanavan T,Vivekanandhan G A. Occurrence ofAeromonashydrophilain acute gasteroenteritis among children[J]. Indian Journal of Medical Research,2006,123(1):61-66.
[7]储卫华,陆承平. PCR扩增特异性16S rDNA和溶血素基因检测致病性嗜水气单胞菌[J]. 水产学报,2005,29(1):79-82.
[8]王远微,汤 承,于学辉,等. 三重PCR检测鱼类致病性嗜水气单胞菌[J]. 微生物学报,2008,48(7):947-951.
[9]Chen Q,Yan Q,Wang K J,et al.The portal of entry for pathogenicVibrioalginolyticusinto large yellow croakerPseudosciaenecroceaand characteristic of the bacterial adhesion to the mucus[J]. Dis Aqu Organ,2008,80(3):181-188.
[10]郭松林,关瑞章,柳佩娟. 双重PCR法快速检测欧鳗鲡嗜水气单胞菌[J]. 集美大学学报(自然科学版),2007,12(4):294-300.
[11]Shemesh M,Tam A,Steinberg D.Differential gene expression profiling ofStreptococcusmutanscultured under biofilm and planktonic conditions[J]. Microbiology,2007,153(Pt5):1307-1317.
[12]毛 宁,王志明,郑 莺. 嗜水气单胞菌与其拮抗菌R-15的生长曲线研究[J]. 福建师范大学学报(自然科学版),2008,24(1):82-85.

