白术叶片对干旱胁迫的光谱特征响应*
徐琳煜, 刘守赞, 白 岩**, 张汝民, 丁 恒, 吴学谦, 郑炳松
白术叶片对干旱胁迫的光谱特征响应*
徐琳煜1,2, 刘守赞3, 白 岩1,2**, 张汝民1,2, 丁 恒1,2, 吴学谦1,2, 郑炳松1,2
(1. 省部共建亚热带森林培育国家重点实验室 临安 311300; 2. 浙江农林大学林业与生物技术学院 临安 311300; 3. 浙江农林大学植物园 临安 311300)
白术根茎膨大初期对轻度的土壤水分缺失具有一定的耐受性, 但是过度干旱会抑制其根茎膨大及成分积累, 因此, 无损伤诊断该时期白术是否受到干旱胁迫至关重要。本文以2年生白术为试验材料, 在根茎膨大初期控制土壤水分, 形成不同程度的干旱胁迫, 利用UniSpec-SC光谱分析仪测定其光谱反射率, 并结合光合色素含量, 探讨白术叶片光谱特征对干旱胁迫的响应规律, 为利用光谱参数监测白术生长状况提供技术依据。结果显示, 随着干旱胁迫程度增加, 可见光区域(400~750 nm)白术叶片光谱反射率升高, 说明其光能吸收利用能力下降; 但在750~1 000 nm的近红外波段, 光谱反射率则逐渐平稳, 在1 000 nm处, 干旱胁迫下的全部叶片反射率均低于对照。微分光谱在680~750 nm间差异明显, 并与叶绿素含量在700~750 nm间呈显著相关。同时, 大多数光谱参数与色素含量呈显著相关(<0.05), 尤其类胡萝卜指数(mCRI)、色素归一化指数(PSNDb)、红边位置(red)、红边幅值(red)、红边面积(red)与之呈极显著相关(<0.01)。从上述结果可知, 微分光谱680~750 nm可作为检测白术是否受到干旱影响的主要监测波段, 红边参数、类胡萝卜指数及色素归一化指数可以作为重要指标, 快速、准确、无伤害诊断白术受干旱胁迫程度。本研究结果可为应用反射光谱进行白术干旱胁迫程度诊断提供理论依据和技术支持。
白术; 干旱胁迫; 光谱特征; 光谱反射率; 光合色素; 光谱参数
干旱是植物生存环境中主要逆境因子之一, 能引起叶片水分降低, 光合电子传递链受阻, PSⅡ反应中心耗散光能的能力增强, 导致光合效率下降[1-2], 进而影响植物生长发育。当植物受到干旱胁迫时, 光合色素含量会发生相应变化, 且与光谱反射率有显著的相关性[3]。OSÓRIO等[4]研究发现, 温度和水分双重胁迫综合作用于光化学反射指数(PRI), 且叶片总叶绿素含量与红边位置(red)显著相关。冬小麦(L.)冠层反射率在可见光波段随着水分含量的增加而逐渐降低, 而在近红外波段与之相反[5]; 关于白皮乌口树(Hutchins)的研究表明, 冠层光谱反射率、红边幅值、红边面积等叶片光谱特征可反映植物干旱胁迫程度[6]; 李梦竹等[7]和林毅等[8]通过分析烟草(L.)和春玉米(L.)的光谱反射率变化特征, 分别建立了BP神经网络模型和光谱参数对土壤水分的反演模型。由此可见, 反射光谱参数不但可快速并准确地监测旱情、反映植物生长情况, 并且拟合的模型可为生产抗旱提供重要的参考依据。
白术(Koidz.)[9]为菊科多年生草本植物, 常用于补气复方中, 以2年生干燥根茎入药, 具有补脾健胃、化湿止泻、燥湿利尿[10]、降低血糖血脂[11-12]及升高白血球[13]等作用, 为著名的“浙八味”之一。目前多数研究集中在白术有效成分[14]及药理作用方面[15], 且最新研究发现白术对于抗肿瘤具有辅助作用[16-17], 但是对于其抗旱能力及反射光谱研究尚少见报道。浙江省作为白术的优质产区之一, 8—9月份雨量充沛, 适宜白术生长, 但是近几年持续在7、8两月出现极端高温少雨天气, 阳光辐射强, 蒸腾剧烈, 同时导致土壤水分快速蒸发, 常引起白术叶片失水萎蔫, 生长遭遇干旱胁迫, 甚至会影响其根茎膨大, 造成产量下降。因此, 研究快速无损伤检测白术所受干旱胁迫程度, 对于提升其栽培技术具有较为重要的现实意义。
本研究利用反射光谱技术, 从叶片的光谱反射率入手, 探讨白术反射光谱及其相关参数对不同干旱胁迫的响应特征, 为解析白术干旱胁迫下的生理生化及成分合成积累规律提供基础研究, 也为生产上利用光谱参数进行大区域、无破坏、实时快速监测白术生长状况提供技术依据。
1 材料与方法
1.1 试验材料
试验在浙江农林大学智能温室内进行, 于2015年6月下旬, 选取平均株高40.0 cm左右、健壮、无病虫害的2年生白术苗, 移栽入直径30 cm、高25 cm的盆中, 盆土采用田间表层土, 每盆1株, 缓苗1个月, 正常浇水。7月下旬, 选择连续晴朗高温天气[室内平均温度范围(39±1) ℃, 利用抽湿机和排风扇等设备制造干旱小环境, 室内空气相对湿度为28%±5%], 正式开始干旱胁迫试验。
试验选取长势相近的健康植株, 共设计5个处理组, 每组10盆。第1组作为对照组(CK), 正常浇水, 即每天浇水量0.5 L; 第2~4组作为干旱处理组, 分别停止浇水2 d (Tr1)、4 d (Tr2)、6 d (Tr3)和8 d (Tr4), 并测定5个处理组的土壤含水量。处理结束后测定土壤含水量, 采集白术叶片光谱信息并进行光合色素含量测定。
1.2 试验方法
1.2.1 土壤含水量测定
参考林大仪[18]的方法, 于盆中取土样, 利用四分法混匀, 再精密称取土样10 g, 在(105±2) ℃烘箱中烘至恒重, 称重, 并计算含水量。不同水分胁迫处理土壤绝对含水量结果见表1。

表1 不同水分胁迫处理的土壤含水量
CK: 对照组, 正常浇水, 每天浇水量0.5 L; Tr1、Tr2、Tr3和Tr4为干旱处理组, 分别停止浇水2 d、4 d、6 d和8 d。不同字母表示在0.05水平上差异显著。CK: control group, watered 0.5 L per day; Tr1, Tr2, Tr3 and Tr4 were drought-treated groups, stopped watering for 2 days, 4 days, 6 days and 8 days, respectively. Different lowercase letters mean significant differences at 0.05 level.
1.2.2 光合色素含量测定
每个干旱处理选取长势相近的3株白术, 每株取样3次, 均选中部叶片。采用分光光度计法, 分别在波长为663 nm、645 nm和470 nm处测定OD值, 计算叶绿素a (Chla)、叶绿素b (Chlb)、类胡萝卜素(Cars)、总叶绿素(Chla+b)含量及叶绿素比(Chla/b)[19]。
1.2.3 光谱数据采集
利用美国产UniSpec-SC光谱分析仪采集光谱数据, 测量波段为310~1 130 nm, 光谱采样间隔1 nm, 光谱分辨率1 nm。在干旱胁迫后, 各处理中选择长势相近的白术5盆, 选取中部叶片, 每隔1 d于11: 00—14: 00测定白术叶片的反射光谱数据。将健康无病无破损的白术叶片放入光谱仪的叶夹中, 根据程序进行测定, 测量过程中及时进行标准白板校正, 以免产生较大误差。利用Multispec 5.1数据处理软件读取反射光谱原始数据, 计算每个处理的平均值作为该样品叶片光谱反射率。
1.3 数据处理与分析
利用Orining Pro 8和SPSS进行数据统计分析和绘图。
将测得的白术叶片反射光谱, 通过以下公式进行一阶微分处理, 得到微分光谱。
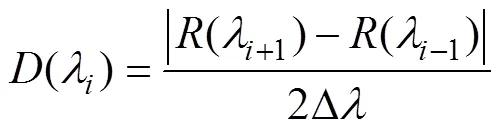
式中:为不同波段的波长值;(λ)为波长的光谱反射率值; ∆为波长λ-1到的差值, 由光谱采样间隔决定。
2 结果与分析
2.1 干旱胁迫对白术叶片光合色素含量的影响
干旱胁迫影响白术叶片的叶绿素含量(表2), 随着干旱时间延长, Chla、Chlb和Cars的含量都呈现先增大后减少的趋势, 且变化显著(<0.05), Chla在干旱时间为4 d时出现最大值, Chlb和Cars在干旱时间为2 d时出现最大值, 含量分别比对照提高27.99%、10.18%和46.06%; 当干旱时间为8 d时, Chla、Chlb和Cars比对照分别降低57.78%、54.50%和47.58%。Chla/b随着干旱时间的延长出现先增加后降低的趋势, 在干旱6 d时达到最大值, 且在干旱4 d和6 d后, 与其他处理相比差异显著。
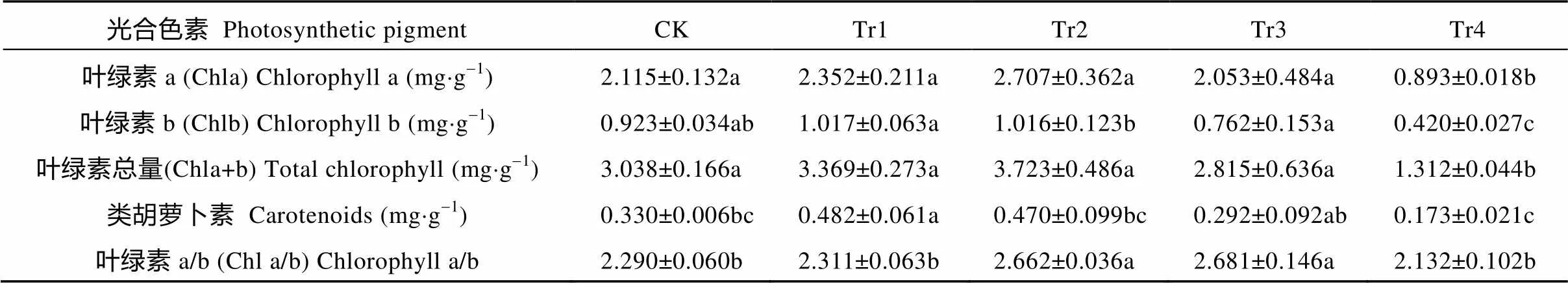
表2 干旱胁迫对白术叶片光合色素含量的影响
CK: 对照组, 正常浇水, 每天浇水量0.5 L; Tr1、Tr2、Tr3和Tr4为干旱处理组, 分别停止浇水2 d、4 d、6 d和8 d。同行不同字母表示在0.05水平上差异显著。CK: control group, watered 0.5 L per day; Tr1, Tr2, Tr3 and Tr4 were drought-treated groups, stopped watering for 2 days, 4 days, 6 days and 8 days, respectively. Different lowercase letters in the same line mean significant differences at 0.05 level.
2.2 干旱胁迫下白术叶片反射光谱特征
2.2.1 干旱胁迫对白术叶片光谱反射率的影响
不同干旱胁迫后白术叶片光谱反射率曲线的整体变化趋势相似, 均具有明显的绿峰(510~560 nm)、红谷(640~680 nm)和近红外平台(760~1 000 nm), 但反射光谱的反射率大小存在差异(图1)。最明显的差异是黄光区(605~655 nm)和绿光区(525~605 nm), 其次是短波近红外区(750~1 000 nm)。在可见光区(400~750 nm), 白术叶片对照、干旱2 d和4 d的反射率相近, 干旱6 d和8 d的反射率相近, 并且前三者的值低于后二者; 在波长550 nm下, 白术叶片反射率随干旱时间增加依次升高, 干旱8 d的反射率升高到25.71%, 比对照组高26.5%, 这是因为在白术控水处理过程中, 含水率降低, 叶绿素部分分解, 吸收减弱, 叶片对可见光的反射增强。在近红外区750 nm处, 反射率随着干旱时间的增加而增加, 但到干旱8 d时骤减并低于对照, 在1 000 nm处, 干旱胁迫下的全部叶片反射率均低于对照。这是因为随白术干旱程度增加, 叶片含水率降低, 水吸收减弱, 叶片内部分子空隙加大, 对近红外和短波红外散射逐渐减弱。
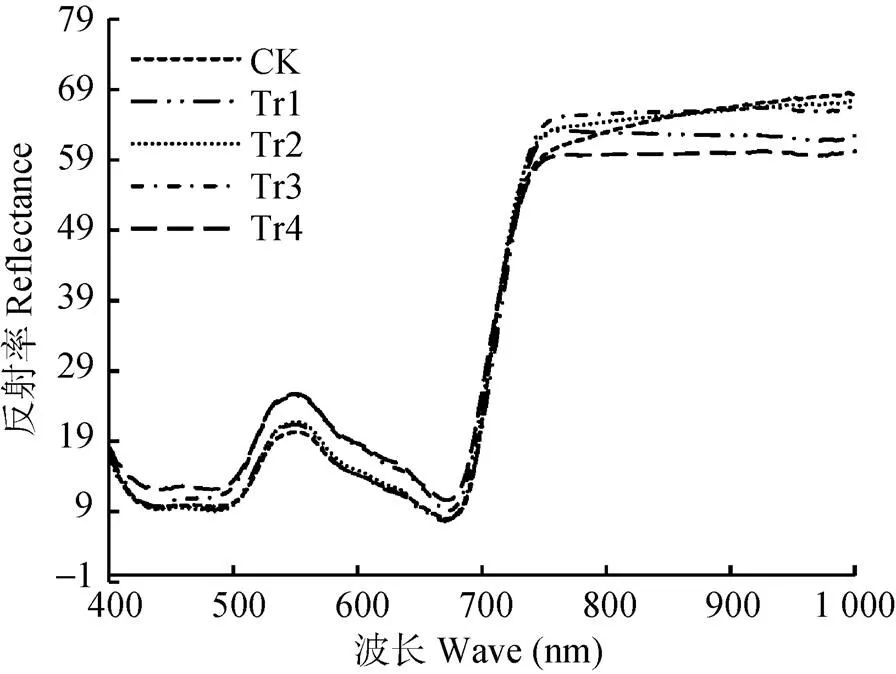
图1 不同干旱胁迫对白术叶片反射光谱的影响
CK: 对照组, 正常浇水, 即每天浇水量0.5 L; Tr1、Tr2、Tr3和Tr4为干旱处理组, 分别停止浇水2 d、4 d、6 d和8 d。CK: control group, watered 0.5 L per day; Tr1, Tr2, Tr3 and Tr4 were drought-treated groups, stopped watering for 2 days, 4 days, 6 days and 8 days, respectively.
2.2.2 干旱胁迫下白术叶片反射光谱的三边特征
对试验所测得的光谱数据求一阶导数, 去除背景噪声对反射光谱的影响, 结果见图2。不同干旱胁迫的白术叶片在红光范围(680~750 nm)波段内都只有1个峰值, 红边位置在干旱2 d即达最大值, 且变化极显著, 其后随着干旱胁迫时间的延长略有波动; 红边幅值以对照最大, 之后整体呈现降低趋势, 但在干旱4 d时有一个次峰出现, 干旱6 d时达到极显著差异; 红边面积随着干旱时间的延长而先增大后减小, 在4 d时形成峰值且达到显著变化。蓝边位置在不同干旱胁迫时间下无明显差异, 蓝边幅值和蓝边面积随着干旱胁迫时间的延长呈现出先增加后降低的趋势, 峰值均出现在干旱6 d。对照和处理的黄边位置变化相近, 黄边幅值在干旱2 d达最大值之后, 随着干旱时间的增加变化较为平稳, 黄边面积随着干旱时间的延长而出现先增加后降低再增加的趋势, 峰值出现在干旱6 d(表3)。
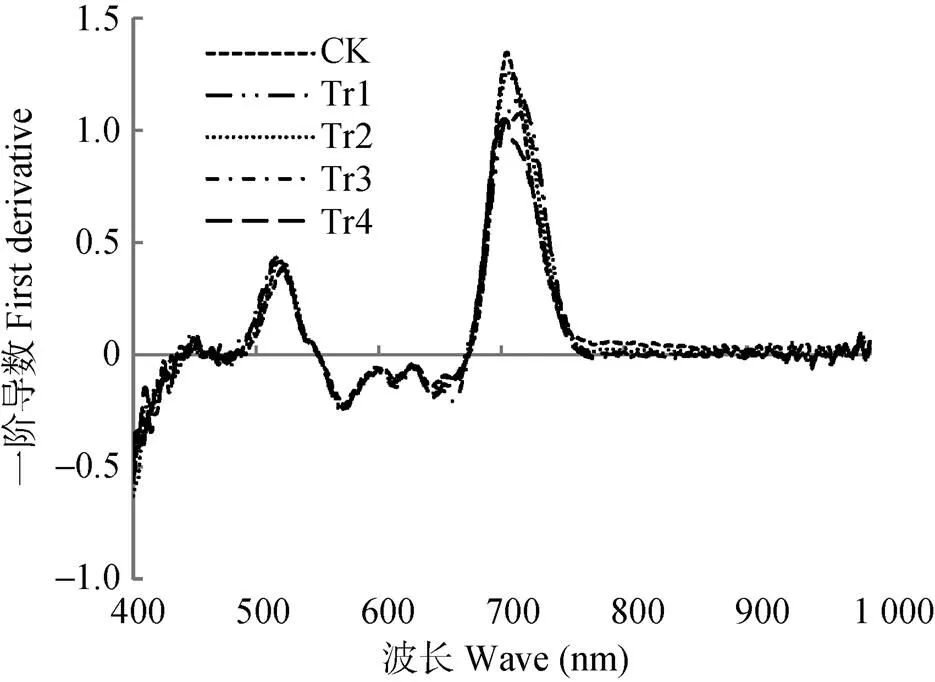
图2 不同干旱胁迫处理白术叶片反射光谱一阶导数
CK: 对照组, 正常浇水, 即每天浇水量0.5 L; Tr1、Tr2、Tr3和Tr4为干旱处理组, 分别停止浇水2 d、4 d、6 d和8 d。CK: control group, watered 0.5 L per day; Tr1, Tr2, Tr3 and Tr4 were drought-treated groups, stopped watering for 2 days, 4 days, 6 days and 8 days, respectively.
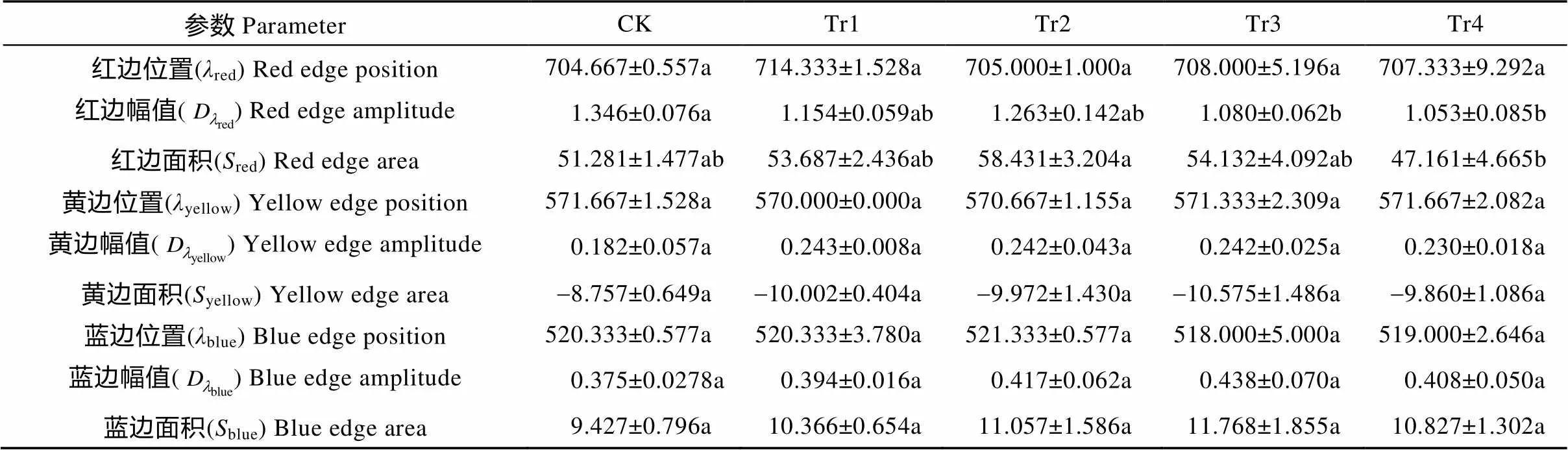
表3 不同干旱胁迫处理下白术叶片红边、黄边和蓝边参数
CK: 对照组, 正常浇水, 即每天浇水量0.5 L; Tr1、Tr2、Tr3和Tr4为干旱处理组, 分别停止浇水2 d、4 d、6 d和8 d。同行不同字母表示在0.05水平上差异显著。CK: control group, watered 0.5 L per day; Tr1, Tr2, Tr3 and Tr4 were drought-treated groups, stopped watering for 2 days, 4 days, 6 days and 8 days, respectively. Different lowercase letters in the same line mean significant differences at 0.05 level.
2.2.3 干旱胁迫对白术叶片光谱参数的影响
白术叶片的光谱参数计算结果见表4。随干旱胁迫时间延长, 先升后降的参数有RR、SR705、rNDVI、mND705和PRI, 下降的参数有SR680、NDVI、gNDN、PSNDa、PSNDb和SIPI, 呈升-降-升趋势的参数是RARSa和RARSb, 呈降-升-降趋势的参数是CRI1、CRI2和mCRI; 红绿比变化不大, 最低值出现在干旱2 d, 之后略呈上升趋势, 在第8 d达到最大值。
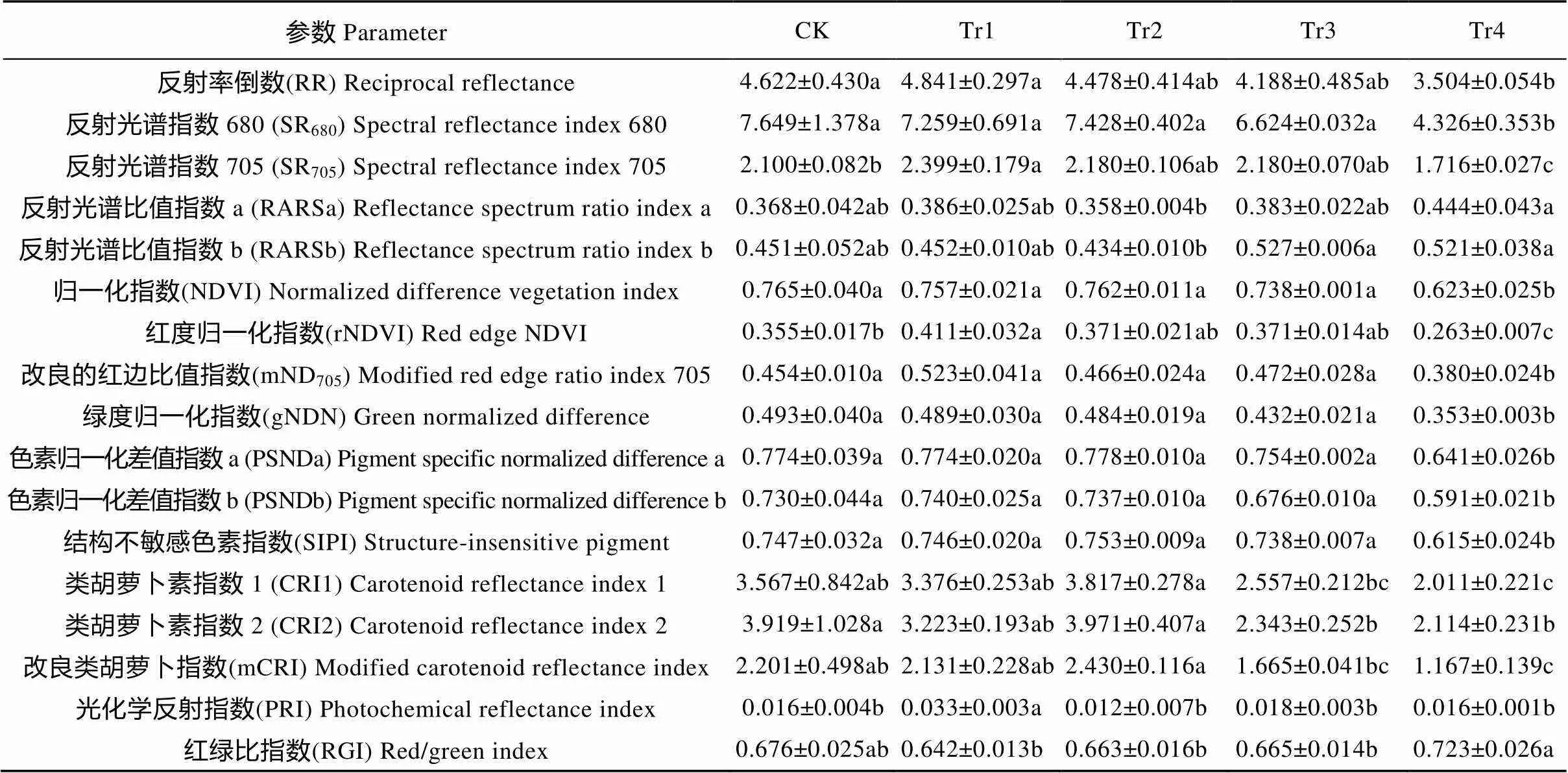
表4 不同干旱胁迫处理下白术叶片反射光谱参数的影响
CK: 对照组, 正常浇水, 即每天浇水量0.5 L; Tr1、Tr2、Tr3和Tr4为干旱处理组, 分别停止浇水2 d、4 d、6 d和8 d。同行不同字母表示在0.05水平上差异显著。CK: control group, watered 0.5 L per day; Tr1, Tr2, Tr3 and Tr4 were drought-treated groups, stopped watering for 2 days, 4 days, 6 days and 8 days, respectively. Different lowercase letters in the same line mean significant differences at 0.05 level.
2.3 白术叶片反射光谱参数与色素含量的相关性
2.3.1 色素含量与光谱反射率的相关性
求取不同干旱胁迫程度下的白术叶片光合色素含量与400~1 000 nm光谱反射率的相关系数, 绘制图3, 并进行相关性分析。400~720 nm之间, Chla、Chlb和Cars含量与反射率呈负相关, 且Chla、Chlb、Chla+b与Chla/b反射率达显著相关, 其中Chla在416 nm处的相关性最高, 相关系数为-0.954; 在720~1 000 nm之间, 白术叶片Chla、Chlb和Cars含量与反射率呈正相关, 且Chla、Chla+b与Chla/b为显著正相关, 其中, Chla/b在730~737 nm之间与反射率呈极显著相关, 最大相关系数为0.997。
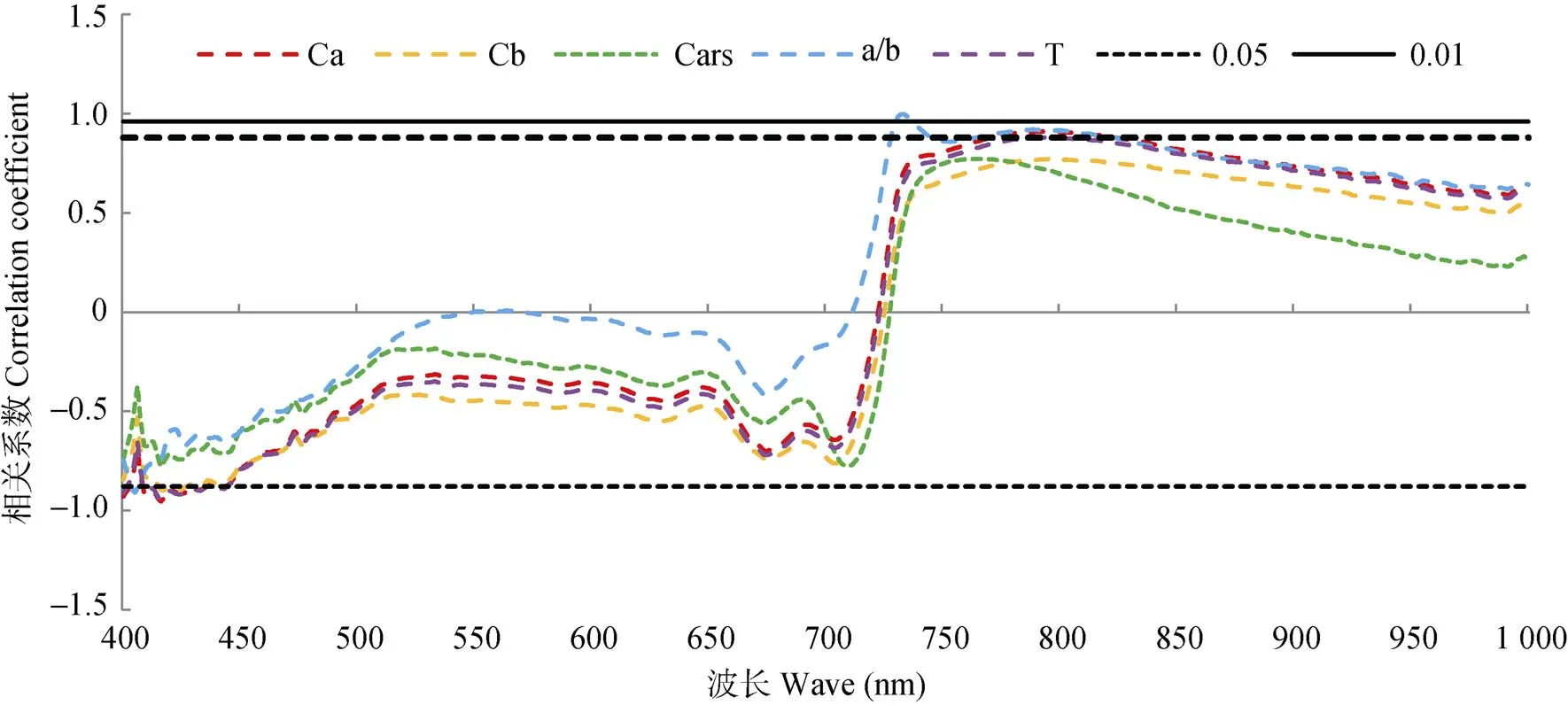
图3 白术叶片光合色素含量与光谱反射率的相关性
Ca: 叶绿素a; Cb: 叶绿素b; Cars: 胡萝卜素; a/b: 叶绿素a/b; T: 总叶绿素含量; 0.05: 显著性水平为0.05; 0.01: 显著性水平为0.01。Ca: chlorophyll a; Cb: chlorophyll b; Cars: carotene; a/b: chlorophyll a/b; T: total chlorophyll content; 0.05: significant level 0.05; 0.01: significant level 0.01.
2.3.2 光合色素含量与微分光谱的相关性
计算不同干旱胁迫程度下的白术叶片光合色素含量与400~1 000 nm微分光谱的相关系数, 进行相关性分析, 如图4。白术叶片的叶绿素和类胡萝卜素含量与反射率呈显著相关。其中Chla、Chlb、Cars、Chla/b和Chla+b分别在488 nm、634 nm、636 nm、542 nm和488 nm出现最大值, 分别为0.989、0.981、0.977、0.991和0.976, 呈极显著正相关; Cars在999 nm处出现最低值(-0.975), 呈极显著负相关; Chla、Chlb、Chla/b和Chla+b分别在978 nm、978 nm、402 nm和978 nm处出现最低值, 分别为-0.936、-0.9222、-0.930和-0.939, 呈显著负相关。
2.3.3 光合色素含量与反射光谱参数的相关性
相关分析表明(表5), 白术叶片Chla、Chlb、Chla+b及Cars含量与绝大多数反射光谱参数都存在正相关性, 其中, Chla与SR680、NDVI、rNDVI、gNDN、PSNDa、PSNDb、SIPI、CRI1、mCRI和red, Chlb与SR705、NDVI、rNDVI、SIPI和CRI1, Chla+b与RR、SR680、SR705、NDVI、rNDVI、gNDN、SIPI、CRI1、mCRI和red, Cars与PSNDb和mCRI等光谱参数呈显著正相关; Chlb与RR、SR680、gNDN、PSNDa、PSNDb和mCRI, Chla+b与PSNDa和PSNDb等参数呈极显著正相关。Chla、Chlb、Chla+b和RARSa、RARSb、RGI等参数呈负相关。
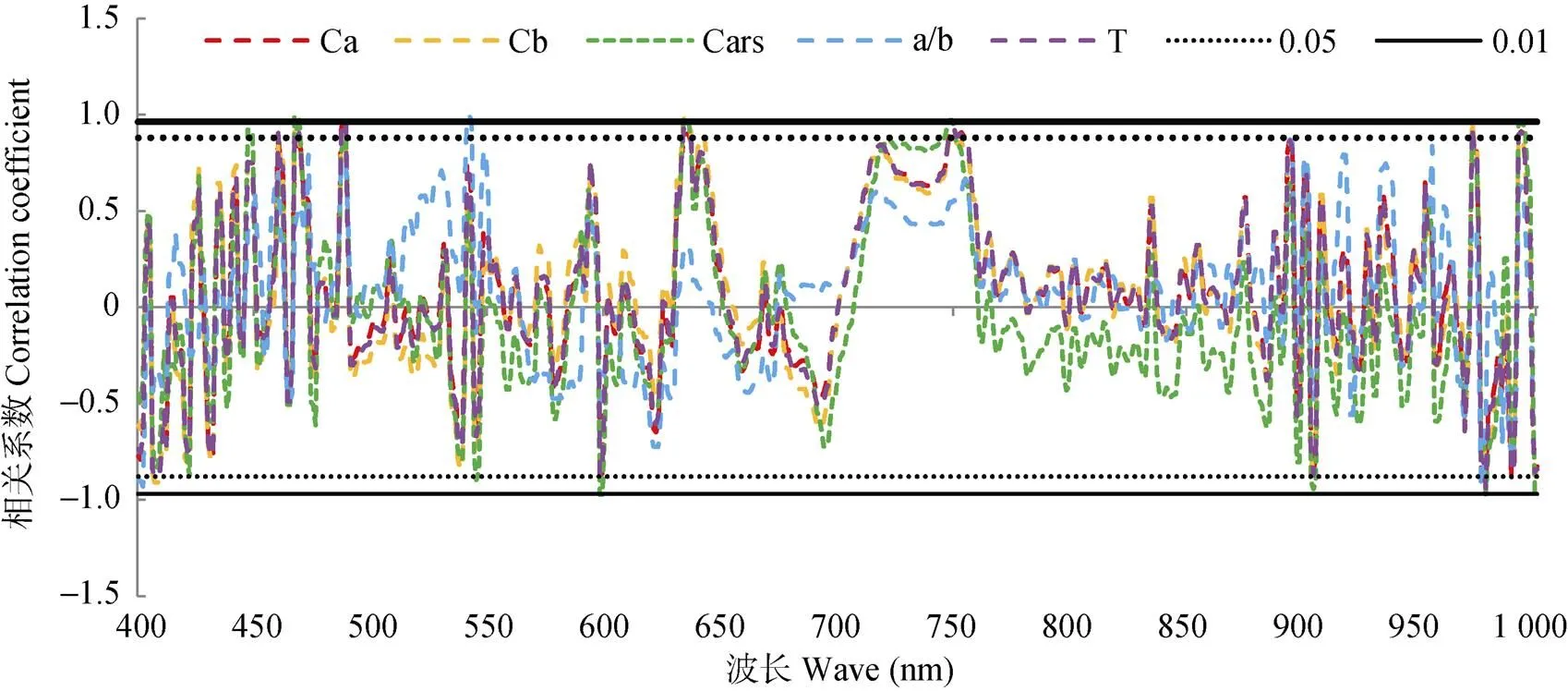
图4 白术叶片光合色素含量与微分光谱的相关性
Ca: 叶绿素a; Cb: 叶绿素b; Cars: 胡萝卜素; a/b: 叶绿素a/b; T: 总叶绿素含量; 0.05: 显著性水平为0.05; 0.01: 显著性水平为0.01。Ca: chlorophyll a; Cb: chlorophyll b; Cars: carotene; a/b: chlorophyll a/b; T: total chlorophyll content; 0.05: significant level 0.05; 0.01: significant level 0.01.
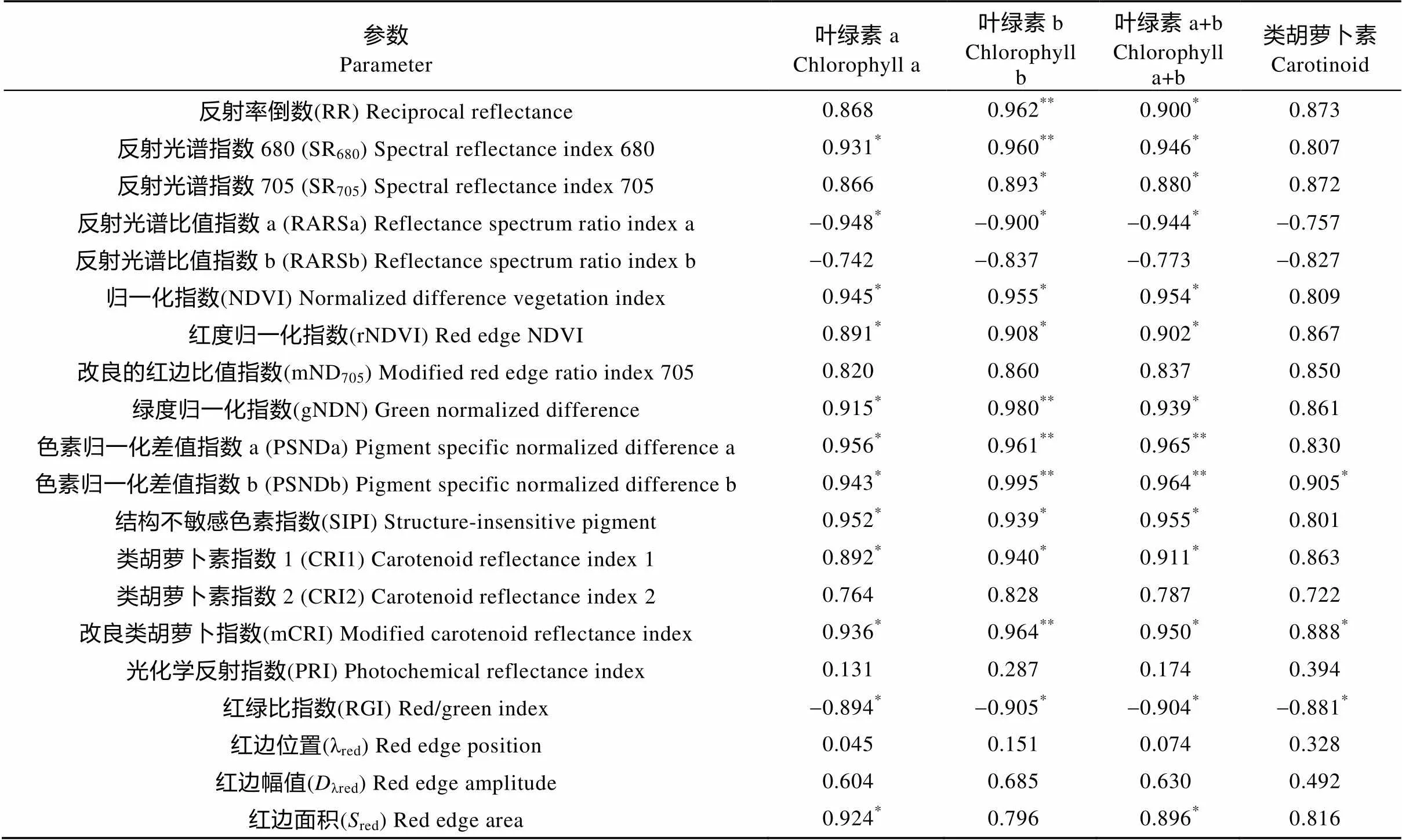
表5 不同干旱胁迫处理下白术叶片反射光谱参数与光合色素含量的相关性
*表示相关性显著(<0.05); **表示相关性极显著(<0.01)。* and ** mean significant correlation at 0.05 and 0.01 levels, respectively.
3 讨论与结论
植物在生长发育进程中, 吸收和利用光的能力是相对稳定的, 未被吸收利用的部分则被反射, 高温、干旱、施肥等因素均会引起反射光谱的变化, 因此, 检测反射光谱可无损伤判断植物的生长状况。本研究利用该项技术, 测定并分析了白术反射光谱及其相关参数对不同干旱胁迫的响应特征。结果发现, 在干旱处理初期光合色素的含量均上升, 6 d后呈现下降趋势。分析认为, 胁迫初期叶片水分减少但光合色素未分解, 导致单位重量内光合色素含量上升。同时, 随着干旱胁迫程度的加重, 可见光区域光谱反射率逐渐升高, 即在可见光区域, 叶绿素和类胡萝卜素的含量是影响光谱反射的主导因子。研究结果与浙江雪胆(Cogn. ex Forbes et Hemsl.)和乌头(Pers. var.Ledeb.)的研究结果相近[20-21], 即光合色素含量会随土壤水分含量的减少而降解, 能良好指示植物环境胁迫、光合能力和衰老进程等生理状态, 因此, 可用于监测植物长势、估算植物光合效率和生物量[22]。
本研究中, 不同干旱胁迫后白术叶片光谱反射率曲线的整体变化趋势相似, 均具有明显的绿峰(510~560 nm)、红谷(640~680 nm)和近红外平台(750~1 000 nm)等普通绿色植物的反射特征, 且在可见光波段反射率表现出上升趋势, 这与对生菜(L. var.Hort.)[23]、冬小麦[24]叶片含水率研究结果一致; 短波近红外光波段反射率随干旱程度增加呈明显降低的趋势与对棉花(sp.)[25]含水率研究结果一致。总体来说,绿峰和红谷差异性较明显, 其余波段差异不明显。
不同干旱处理下白术叶片光谱反射率曲线在500~680 nm区间差异明显, 而其光谱反射率与色素含量的相关性在730~750 nm间较好。经过降低背景和噪音等干扰的微分处理后发现, 微分光谱在680~750 nm间差异明显, 与叶绿素含量在700~750 nm间呈显著相关, 可较好指示测试结果。因此, 700~750 nm可作为检测白术是否受到干旱影响的主要监测波段。
红边位置、红边幅值、红边面积由于对土壤干旱胁迫的响应时间较短[8], 经常在光谱分析中对其特征量加以讨论, 并作为判断干旱发生时的重要参考指标。干旱胁迫后的白术,red与对照组相比出现“红移”, 与大部分研究结果相反, 分析认为, 可能与其处于开花前期有关(白术从6月下旬开始现蕾, 至9月上旬开花), 这与贺可勋等[26]研究发现小麦在开花前期出现“红移”相似。光谱参数SR680、NDVI、rNDVI、gNDN、PSNDa、PSNDb、SIPI、CRI1和mCRI等光谱参数与叶绿素含量呈显著正相关(<0.05), RGI、RARSa与叶绿素含量呈显著负相关(<0.05), 通过对比, 光谱参数mCRI、PSNDb与叶片色素含量之间的相关系数明显优于其他参数, 可以作为监测干旱胁迫对于白术影响的指示参数, 及时应对早期干旱。至于干旱对白术地下块根产量和有效成分的影响, 则需进一步研究, 分析并讨论反射光谱及其相关参数与地下块根生长发育、成分积累之间的规律。
根据本文结果可得出如下结论, 干旱胁迫程度增加致使可见光区域(400~750 nm)白术叶片光谱反射率升高, 尤其微分光谱680~750 nm间差异明显, 因此, 此波段可作为检测白术是否受到干旱影响的主要波段; 同时, 类胡萝卜指数(mCRI)、色素归一化指数(PSNDb)、红边位置(red)、红边幅值(red)、红边面积(red)亦可以作为重要指标, 快速、准确、无损伤诊断白术受干旱胁迫程度, 为揭示白术受干旱胁迫后生理生态特性提供理论依据和研究基础。
[1] 胡宏远, 王振平. 干旱胁迫对赤霞珠葡萄叶片水分及叶绿素荧光参数的影响[J]. 干旱区资源与环境, 2017, 31(4): 124–130 HU H Y, WANG Z P. Effects of drought stress on leaf water content and chlorophyll fluorescence parameters of Cabernet Sauvignon[J]. Journal of Arid Land Resources and Environment, 2017, 31(4): 124–130
[2] 郭晓飞, 黄春燕, 田春燕, 等. 不同水分处理条件下棉花高光谱植被指数与光合参数的相关分析[J]. 新疆农业科学, 2017, 54(1): 20–26 GUO X F, HUANG C Y, TIAN C Y, et al. Correlation analysis between hyperspectral vegetation indices and photosynthetic parameters of cotton under different water treatments[J]. Xinjiang Agricultural Sciences, 2017, 54(1): 20–26
[3] MOORTHY I, MILLER J R, NOLAND T L. Estimating chlorophyll concentration in conifer needles with hyperspectral data: An assessment at the needle and canopy level[J]. Remote Sensing of Environment, 2008, 112(6): 2824–2838
[4] OSÓRIO J, OSÓRIO M L, ROMANO A. Reflectance indices as nondestructive indicators of the physiological status ofseedlings under varying moisture and temperature regimes[J]. Functional Plant Biology, 2012, 39(7): 588–597
[5] 陈智芳, 宋妮, 王景雷, 等. 基于高光谱遥感的冬小麦叶水势估算模型[J]. 中国农业科学, 2017, 50(5): 871–880 CHEN Z F, SONG N, WANG J L, et al. Leaf water potential estimating models of winter wheat based on hyperspectral remote sensing[J]. Scientia Agricultura Sinica, 2017, 50(5): 871–880
[6] 张树斌, 张教林, 曹坤芳. 季节性干旱对白皮乌口树(Hutchins)水分状况、叶片光谱特征和荧光参数的影响[J]. 植物科学学报, 2016, 34(1): 117–126 ZHANG S B, ZHANG J L, CAO K F. Effects of seasonal drought on water status, leaf spectral traits and fluorescence parameters inHutchins, a Chinese savanna evergreen species[J]. Plant Science Journal, 2016, 34(1): 117–126
[7] 李梦竹, 刘国顺, 贾方方. 干旱胁迫下旺长期烤烟冠层叶绿素密度的高光谱估测[J]. 中国烟草科学, 2017, 38(1): 23–28 LI M Z, LIU G S, JIA F F. Hyperspectral estimation of canopy chlorophyll density in flue-cured Tobacco under different drought stress at the vigorous growth stage[J]. Chinese Tobacco Science, 2017, 38(1): 23–28
[8] 林毅, 李倩, 王宏博, 等. 干旱条件下春玉米高光谱特征及土壤含水量反演[J]. 生态学杂志, 2016, 35(5): 1323–1329 LIN Y, LI Q, WANG H B, et al. Hyperspectral characteristics of spring maize and the inversion of soil moisture under drought stress[J]. Chinese Journal of Ecology, 2016, 35(5): 1323–1329
[9] 国家药典委员会. 中华人民共和国药典(第一部)[M]. 北京: 中国医药科技出版社, 2015: 103–104State Pharmacopeia Committee of China. Pharmacopoeia of the People’s Republic of China (Volume Ⅰ)[M]. Beijing: China Medicine Science and Technology Press, 2015: 103–104
[10] 陈静, 孙云超, 冉小库, 等. 白术利尿作用研究[J]. 中国现代中药, 2016, 18(5): 563–567CHEN J, SUN Y C, RAN X K, et al. Study on diuretic effect ofRhizoma[J]. Modern Chinese Medicine, 2016, 18(5): 563–567
[11] 林海雄, 王晓彤, 王菁, 等. 参苓白术散对高脂血症小鼠血糖血脂及瘦素水平的影响[J]. 中华中医药学刊, 2017, 35(1): 143–145LIN H X, WANG X T, WANG J, et al. Effects of Shenling Baizhu powder on blood lipid, glucose and leptin in hyperlipidemia mice[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(1): 143–145
[12] 唐琪晶, 陈素红, 潘丹丹, 等. 白术精提物对代谢性高脂血症大鼠的药效及机制研究[J]. 中国中药杂志, 2015, 40(9): 1803–1807TANG Q J, CHEN S H, PAN D D, et al. Preliminary study on efficacy and mechanism ofRhizoma extracts in metabolic hyperlipidemia rats[J]. China Journal of Chinese Materia Medica, 2015, 40(9): 1803–1807
[13] 周琼. 参苓白术散加味治疗肿瘤化疗后白细胞减少临床观察[J]. 实用中医药杂志, 2017, 33(2): 128–129 ZHOU Q. Clinical observation on treatment of leukopenia after chemotherapy with Shenling baizhu powder[J]. Journal of Practical Traditional Chinese Medicine, 2017, 33(2): 128–129
[14] 赵玉娇, 徐文慧, 沈小丽, 等. 白术中内酯类成分的TLC鉴别与UPLC含量测定[J]. 中国中药杂志, 2017, 42(3): 531–535 ZHAO Y J, XU W H, SHEN X L, et al. Study on TLC identification and UPLC determination method of atractylenolide in[J]. China Journal of Chinese Materia Medica, 2017, 42(3): 531–535
[15] 徐洋洋, 蔡皓, 段煜, 等. 白术芍药散治疗溃疡性结肠炎研究进展[J]. 中国中药杂志, 2017, 42(5): 856–862 XU Y Y, CAI H, DUAN Y, et al. Research progress of Baizhu Shaoyao powder in treating ulcerative colitis[J]. China Journal of Chinese Materia Medica, 2017, 42(5): 856–862
[16] 张彩霞, 张亚杰, 江滨, 等. 白术内酯Ⅱ促进大肠癌Lovo细胞凋亡及对PARP1和Caspase-3表达的影响[J]. 中国实验方剂学杂志, 2017, 23(5): 157–161 ZHANG C X, ZHANG Y J, JIANG B, et al. Effect ofⅡ in promoting apoptosis of Lovo cells and its impact on expression of PARP1 and Caspase-3[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(5): 157–161
[17] 郭晨旭, 刘静波, 赵艳, 等. 白术抑制胃癌细胞SGC-7901增殖并促进其凋亡[J]. 中国组织化学与细胞化学杂志, 2017, 26(5): 468–474 GUO C X, LIU J B, ZHAO Y, et al.inhibits proliferation and promotes apoptosis in gastric cancer cell line SGC-7901[J]. Chinese Journal of Histochemistry and Cytochemistry, 2017, 26(5): 468–474
[18] 林大仪. 土壤学实验指导[M]. 北京: 中国林业出版社, 2004 LIN D Y. Soil Science Experiment Guidance[M]. Beijing: China Forestry Publishing House, 2004
[19] 张志良, 瞿伟菁, 李小方. 植物生理学实验指导[M]. 第4版. 北京: 高等教育出版社, 2009 ZHANG Z L, QU W Q, LI X F. Plant Physiology Experiment Guidance[M]. 4th ed. Beijing: Higher Education Press, 2009
[20] 哀建国, 金松恒. 干旱胁迫对浙江雪胆光合特性的影响[J]. 中草药, 2008, 39(7): 1074–1078AI J G, JIN S H. Effects of drought stress on photosynthetic characteristics in[J]. Chinese Traditional and Herbal Drugs, 2008, 39(7): 1074–1078
[21] 李洁, 周春娥, 梁志英, 等. 干旱胁迫对乌头部分生理指标的影响[J]. 中国水土保持科学, 2011, 9(3): 93–100 LI J, ZHOU C E, LIANG Z Y, et al. Impacts of drought stress on physiological characteristics of Aconitums[J]. Science of Soil and Water Conservation, 2011, 9(3): 93–100
[22] NAIDU R A, PERRY E M, PIERCE F J, et al. The potential of spectral reflectance technique for the detection of Grapevinein two red-berried wine grape cultivars[J]. Computers and Electronics in Agriculture, 2009, 66(1): 38–45
[23] 毛罕平, 高洪燕, 张晓东. 生菜叶片含水率光谱特征模型研究[J]. 农业机械学报, 2011, 42(5): 166–170 MAO H P, GAO H Y, ZHANG X D. Spectral characteristics model of lettuce leaves’ water content[J]. Transactions of the Chinese Society for Agricultural Machinery, 2011, 42(5): 166–170
[24] 李方舟, 冯美臣, 杨武德, 等. 水旱地冬小麦叶绿素含量高光谱监测[J]. 生态学杂志, 2013, 32(12): 3213–3218LI F Z, FENG M C, YANG W D, et al. Monitoring of winter wheat chlorophyll content in irrigated and dry lands of Shanxi Province of China based on hyperspectral remote sensing[J]. Chinese Journal of Ecology, 2013, 32(12): 3213–3218
[25] 苏毅, 王克如, 李少昆, 等. 棉花植株水分含量的高光谱监测模型研究[J]. 棉花学报, 2010, 22(6): 554–560SU Y, WANG K R, LI S K, et al. Monitoring models of the plant water content based on cotton canopy hyperspectral reflectance[J]. Cotton Science, 2010, 22(6): 554–560
[26] 贺可勋, 赵书河, 来建斌, 等. 水分胁迫对小麦光谱红边参数和产量变化的影响[J]. 光谱学与光谱分析, 2013, 33(8): 2143–2147 HE K X, ZHAO S H, LAI J B, et al. Effects of water stress on red-edge parameters and yield in wheat cropping[J]. Spectroscopy and Spectral Analysis, 2013, 33(8): 2143–2147
Responses of leaf spectral characteristics ofKoidz. to drought stress*
XU Linyu1,2, LIU Shouzan3, BAI Yan1,2**, ZHANG Rumin1,2, DING Heng1,2, WU Xueqian1,2, ZHENG Bingsong1,2
(1. State Key Laboratory of Subtropical Silviculture, Zhejiang Agriculture and Forestry University, Lin’an 311300, China; 2. School of Forestry and Biotechnology, Zhejiang Agriculture and Forestry University, Lin’an 311300, China; 3. Botanical Garden, Zhejiang Agricultural and Forestry University, Lin’an 311300, China)
Koidz. is a perennial herb belonging to Compositae family, which is fond of cool climate regions. Rhizome dried for over 2 years are used for a series of medicinal functions. It is a top medicinal herb in Zhejiang Province, China. At the early stage of rhizome enlargement,has a certain tolerance to mild soil drought, but excessive drought can inhibit rhizome enlargement and accumulation of constituent chemicals. Increasing degree of drought stress could slow down growth, inhibit rhizome enlargement and limit yield. In order to provide reference for drought stress control and cultivation of drought-resistant varieties, biennialwere planted under different drought stress. Spectral reflectance ofleaves determined by UniSpec-SC spectrum analyzer and combined with photosynthetic pigment contents were used to explain the response of spectral characteristics under drought stress. The results showed that spectral reflectance increased in the visible region (400-750 nm) with increasing drought stress. This indicated that the absorption and utilization ability of light energy decreased under increased drought stress. However, spectral reflectance gradually stabilized in the near-infrared band 750-1 000 nm. The reflectance of all the leaves under drought stress was lower than that of the control at 1 000 nm. The difference in spectrum of 680-750 nm was significant, which was correlated with chlorophyll content in 700-750 nm. This band could be used to monitor whetherwas affected by drought. The contents of photosynthetic pigments increased initially and then decreased with the increased drought stress. It indicated that a suitable degree of drought was good for growth. Most of the spectral parameters were significantly correlated with pigments contents (< 0.05). Spectral parameters of mCRI, PSNDb, red-edge position (red), red-edge amplitude (red) and red-edge area (red) were significantly correlated with leaf pigments contents (< 0.01), which could be used to diagnose drought indicators. In summary, differential spectrum of 680-750 nm could be used to detect drought impact on. Red-edge parameters, carotenoid reflectance indexes and pigment specific normalized difference may be used as indicators to diagnose drought stress degree of. This conclusion not only provided a reference for the study of high-spectrum plant research, but also provided theoretical basis and technical support for the application of spectrum diagnosis ofin drought stress analysis.
Koidz.; Drought stress; Spectral characteristics; Spectral reflectance; Photosynthetic pigment; Spectral parameter
, E-mail: hzbaiyan@163.com
Aug. 2, 2017;
Jan. 11, 2018
10.13930/j.cnki.cjea.170704
R282.2
A
1671-3990(2018)05-0719-09
白岩, 主要从事药用植物栽培与生理生化调控研究。E-mail: hzbaiyan@163.comb 徐琳煜, 主要从事药用植物栽培与生理研究。E-mail: xlyzjnl@163.com
2017-08-02
2018-01-11
* This study was supported by the Natural Science Foundation of Zhejiang Province of China (LY13C130010).
* 浙江省自然科学基金项目(LY13C130010)资助
徐琳煜, 刘守赞, 白岩, 张汝民, 丁恒, 吴学谦, 郑炳松. 白术叶片对干旱胁迫的光谱特征响应[J]. 中国生态农业学报, 2018, 26(5): 719-727
XU L Y, LIU S Z, BAI Y, ZHANG R M, DING H, WU X Q, ZHENG B S. Responses of leaf spectral characteristics ofKoidz. to drought stress[J]. Chinese Journal of Eco-Agriculture, 2018, 26(5): 719-727
——缺陷度的算法研究

