青年乳腺癌与老年乳腺癌患者分子分型及临床病理特征的对比分析
伍颖君,李 超
(江门市中心医院普外科,广东 江门 529000)
乳腺癌是威胁全球女性健康的恶性肿瘤之一,乳腺癌的分子分型、病理组织学分级与患者的预后密切相关。我国乳腺癌发病高峰主要分布在45~54岁和60~69岁2组年龄段,而年龄超过60岁的老年患者约占乳腺癌患者的一半以上[1]。近年来随着女性社会压力的增大、饮食结构和生活环境的改变,乳腺癌的发病呈上升和年轻化趋势[2],发病年龄小于35岁的年轻乳腺癌患者越来越多[3]。本文通过对比分析青年乳腺癌和老年乳腺癌患者的分子分型及临床病理特征,为临床医生在个体化临床诊治乳腺癌及判断预后时提供更多的理论依据。
1 资料与方法
1.1 一般资料
选择江门市中心医院普外科在2016年1―12月收治的120例乳腺癌患者,均为女性,均病理检查确诊为原发性乳腺癌,术前检查均未见远处转移病灶。将年龄≤35岁的患者纳入青年组,55例;将年龄≥60岁的同期乳腺癌患者纳入老年组, 65例。青年组年龄为27~35岁,中位年龄为31岁;老年组年龄为61~83岁,中位年龄为72岁。
1.2 分子分型
采用免疫组织化学检测法:所有标本常规10%甲醛固定,石蜡包埋后切片,采用SP法,按照说明书进行免疫组织化学染色,DAB显色。免疫组织化学结果判断标准[4]:乳腺癌肿瘤组织雌激素受体(ER)和孕激素受体(PR)的结果判定依据着色程度与比例,细胞核染色≥1%时为阳性,其他为阴性;对于人表皮生长因子受体(HER-2)结果可分为HER-2阴性(0—1+)、HER-2阳性(3+)、HER-2阳性(FISH检测+);肿瘤细胞增殖相关核抗原Ki-67以细胞核着色阳性≥14%定义为阳性。分子分型判定参考2013年St.Gallen会议共识[4]分为4个亚型:Lumial A、Luminal B、HER-2-rich和Triple negative(三阴性)型。
1.3 一般临床资料收集
整理患者肿瘤大小、临床分期、病理分级、有无淋巴结转移等情况并进行比较。肿瘤分级标准依据WHO乳腺及女性生殖器官肿瘤病理学和遗传学标准,分级越高,肿瘤恶性程度越高。
1.4 统计学方法
采用SPSS19.0软件处理数据,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组患者分子分型比较
青年组与老年组乳腺癌患者分子分型总体分布不同,差异有统计学意义(P<0.01);且青年组乳腺癌患者以三阴性型居多(36.36%),老年组乳腺癌患者以Luminal A型居多(36.92%)。见表1。
2.2 2组患者临床病理特征比较
青年组与老年组乳腺癌患者在肿瘤直径、临床分期、病理分级、淋巴转移方面分布不同,差异均有统计学差异(P<0.05或P<0.01)。与老年组相比,青年组肿瘤直径>2 cm的所占比例高(72.73%),临床分期晚(Ⅱ、Ⅲ期占75.55%),病理分级高(Ⅱ、Ⅲ级占92.73%),容易有淋巴结转移(转移率达60.00%),差异均有统计学意义(P<0.05)。详见表2。

表1 2组患者分子分型比较
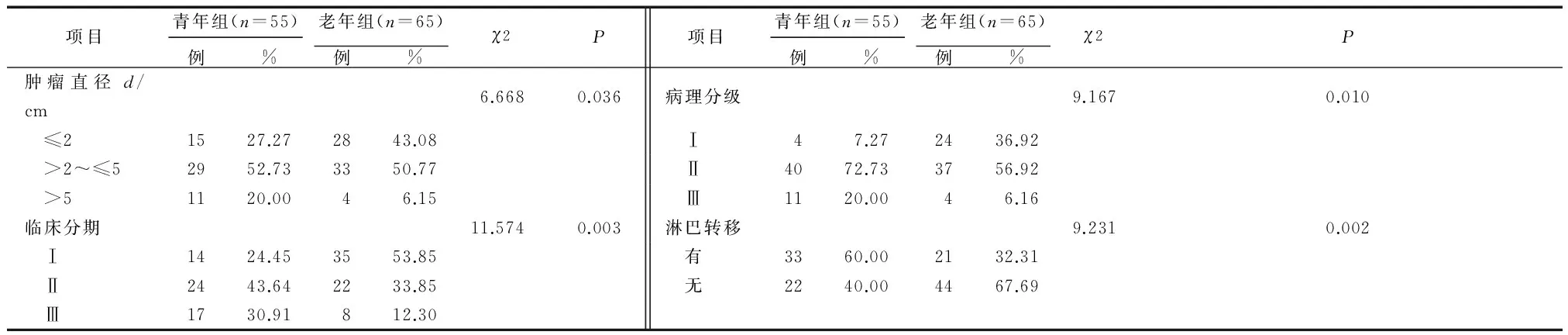
表2 2组患者临床病理特征比较
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一。据相关数据统计[5]显示,2008年我国女性乳腺癌年发病为16.9万,死亡病例约4.5万。近年来我国乳腺癌发病率呈持续上升趋势,且乳腺癌发病趋向年轻化。有学者[6]提出年龄可作为乳腺癌患者预后的独立危险因素,不同年龄组别的乳腺癌患者其病理特征、临床分级、分子分型及临床预后均有明显的差别,且年龄越小预后越差。但另有研究[7]认为乳腺癌的预后与年龄无关,而与其分子分型及病理特征相关。本研究发现青年乳腺癌患者肿瘤直径>5 cm的比例高达20.00%,淋巴结转移率达60.00%,Ⅲ期乳腺癌达30.91%,明显高于老年组(P<0.05)(表2)。但对于局部晚期的老年乳腺癌患者,其病理分期则明显高于青年乳腺癌患者。因此,仅依据患者的年龄因素而判断患者的预后仍存在争议。
随着Perou等[8]在2000年首先提出了乳腺癌分子分型的概念,使乳腺肿瘤的分类基础由形态学转向以分子特征为基础的新的肿瘤分类系统。根据2013年St.Gallen专家会议的共识,将乳腺癌分为4种分子亚型:Luminal A、 Luminal B、 HER-2-rich和三阴性型[4]。Ihemelandu等[9]在研究中发现以PR、ER)和HER2均为阴性的一种特殊的乳腺癌亚型—三阴性型乳腺癌(TNBC),占乳腺癌的10%~20%,其远处转移及淋巴结转移率明显较其他分子亚型高。TNBC是一种缺乏激素效应的高风险癌,其生物学特征主要表现为组织学分级高,肿瘤直径大,较早发生局部复发及远处转移,内脏转移率高,预后差[10]。HER2是具有酪氨酸激酶活性的高同源性蛋白质,其过度表达能促进肿瘤的发生和恶性转化。HER-2阳性表达越高提示生物学侵袭性越强[11]。可见乳腺癌的分型与预后有密切联系。秦颖等[12]报道了464例乳腺癌患者的随访结果,显示青年TNBC比例明显高于中老年乳腺癌,尤其在低龄青年患者中,TNBC的比例高达24.1%,而中老年组仅为19%,提出分子分型是影响青年乳腺癌患者预后的独立因素。本研究发现青年组与老年组乳腺癌患者分子分型总体分布不同,青年组患者TNBC的比例为36.36%,HER-2-rich型占27.27%,老年组乳腺癌患者则以Luminal A型居多,占36.92%。因此青年乳腺癌临床分期晚、侵袭性强、恶性程度高可能与其高表达HER-2-rich及TNBC的分子分型相关。目前对预测乳腺癌复发转移的评估,美国肿瘤联合会(AJCC)对乳腺癌分期系统首次提出解剖学分期及预后分期的理念。指南推荐以ER、PR、HER及组织学分级四项生物学信息作为基本依据,联合OncotypeDx○R多基因检测,对肿瘤进行预后分期的综合评价,分子分型的提出奠定了乳腺癌进入分类治疗时代的基础[13]。
综上所述,青年乳腺癌分子分型以TNBC多见,肿瘤生长速度快,早期可发生淋巴结和远处转移。老年乳腺癌多为内分泌高反应型,分子分型以Luminal A居多,肿瘤侵袭性较青年乳腺癌弱,预后较好。乳腺癌是具有高度异质性的肿瘤,分子水平的多样化是导致临床生物学行为、病理学特征各不相同的本质[13],年龄的分层不能作为评估患者预后的独立因素。
参考文献:
[1] 隗立兵,康骅,海涛,等.老年乳腺癌140例的临床特点和治疗[J].中国老年学杂志,2011,31(15):2858-2860.
[2] Yang H J,Yu X F,He X M,et al.Age interactions in breast cancer:an analysis of a 10-year multicentre study in China[J].J Int Med Res,2012,40(3):1130-1140.
[3] 邓智平,刘秋芳,宋张骏,等.年轻乳腺癌患者的病理特点分析[J].现代生物医学进展,2016,16(32):6373-6375.
[4] Goldhirsch A,Winer E P,Coates A S,et al.Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J].Ann Oncol,2013,24(9):2206-2223.
[5] 郑莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013(8):561-569.
[6] Kim K J,Huh S J,Yang J H,et al.Treatment results and prognosticfactors of early breast cancer treated with a breast conserving operation and radiotherapy[J].Jpn J Clin Oncol,2005,35(3):126-133.
[7] Kollias J,Elston C W,Ellis I O,et al.Early-onset breast cancer histopathological andprognosticconsiderations[J].Br J Cancer,1997,75(9):1318-1323.
[8] Perou C M,Sorlie T,Eisen M B,et al.Molecular portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[9] Ihemelandu C U,Leffall L D,Dewitty R L,et al.Molecular breast cancer subtypes in premenopausal and postmenopausal African-American women:age-specific prevalence and surviv-al[J].J Surg Res,2007,143(1):109-118.
[10] 李春艳,王培,张晟,等.三阴性乳腺癌的临床病理特征和预后分析[J].中华肿瘤杂志,2013,35(6):463-467.
[11] 乔杉杉,王大业.乳腺癌HER2基因的研究进展及其靶点治疗[J].首都医科大学学报,2008,29(1):96-99.
[12] 秦颖,张同先,张巍,等.青年乳腺癌临床病理特点分子分型及预后分析[J].中国肿瘤临床,2014(4):231-236.
[13] 刘荫华,周斌,辛灵,等.正确认识AJCC第8版乳腺癌预后分期的临床价值[J].国际外科学杂志,2017,44(3):149-151.

