不良反应对人工肝治疗即刻效应的影响
胡飘萍
(南昌大学第一附属医院输血科,南昌 330006)
重型病毒性肝炎是由肝炎病毒导致肝脏功能受损的一类疾病,其治疗主要为内科综合治疗、人工肝支持治疗及肝移植[1]。人工肝支持系统(ALSS)以血液净化为基础,借助体外装置替代肝脏功能,快速清除各种有害物质,使机体内环境得到改善。目前应用最广泛的ALSS有血浆置换(PE)和分子吸附再循环系统(MRAS)。本文观察PE和MRAS治疗过程出现的不良反应及不良反应对治疗效果的即刻影响。
1 资料与方法
1.1 研究对象
2014年7月至2015年11月在南昌大学第一附属医院住院且行人工肝治疗的重型病毒性肝炎患者87例,其中男71例,女16例,年龄19~74岁,平均年龄43.6岁。患者人工肝治疗前无严重活动性出血、不对肝素和鱼精蛋白等高度过敏、循环功能尚可,均符合病毒性肝炎防治方案[2]中的重型病毒性肝炎诊断标准及肝衰竭标准[3]。
87例患者根据治疗方法分为PE组和MARS组,其中PE组47例,MARS组40例。2组患者共行117例次人工肝治疗:PE治疗70例次,MARS治疗47例次。PE组和MARS组在男女治疗次数比例(χ2=0.787,P>0.05)、年龄以及Child-Pugh分级(P>0.05)比较差异无统计学意义,具有可比性,详见表1。
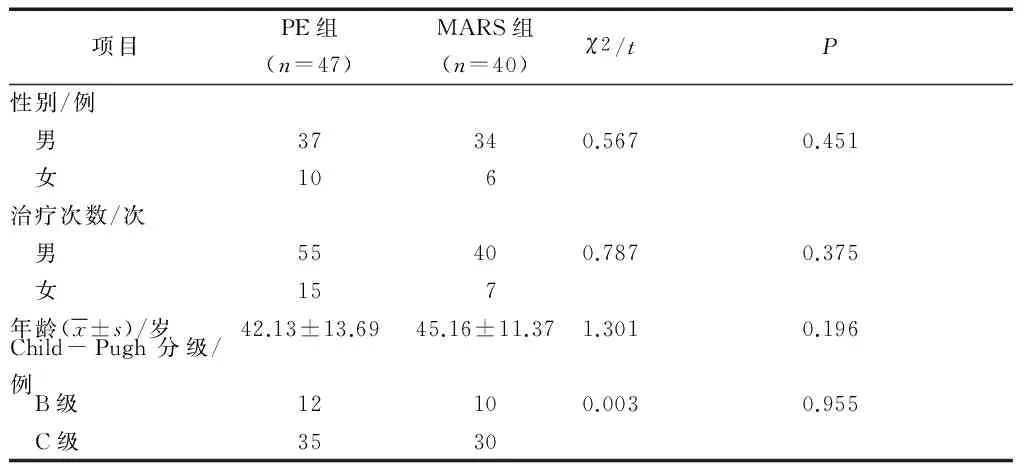
表1 PE组和MARS组患者的基本资料
1.2 治疗方法与观察指标
所有病例均行保肝、退黄及输注白蛋白等内科综合治疗。在治疗前与治疗结束即刻行血丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)、直接胆红素(DBIL)、总蛋白(TP)、白蛋白(ALB)、血红蛋白(Hb)、白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)、肌酐(Cr)、尿素氮(BUN)以及血电解质K+、Na+、Cl-、Ca2+等观察指标检测。
1.2.1 人工肝治疗方案
通过患者股静脉置管,费森尤斯4008S仪器进行MARS操作,透析液为20%白蛋白稀释液。ACH-10进行PE治疗,透析液为ABO、Rh血型与患者相同的同种异体血浆,血浆量2500~3000 mL。人工肝开始时用生理盐水及肝素盐水预充,循环血流量为80~150 mL·min-1,透析液流量为50~80 mL·min-1,术中根据患者血压情况调节血流速度,整个过程以肝素抗凝,结束时以鱼精蛋白封管。所有患者PE术前10 min肌内注射盐酸异丙嗪注射液25 mg。
1.2.2 不良反应的观察
治疗过程中,根据患者主诉不适、有无出血以及生命体征监测等记录不良反应。
1.3 统计学方法
应用统计学软件SPSS20.0进行数据处理,治疗前后检测指标采用配对t检验,不同治疗组检测值治疗前后变化用ANOVA分析,计数资料的比较采用χ2检验和Fisher确切概率法,显著性检验水准为α=0.05。
2 结果
2.1 2组不良反应比较
人工肝过程中不良反应发生率为53.00%,PE的不良反应率高于MARS(61.43%比40.43%,P<0.05),2组不良反应类别比较差异有统计学意义(P<0.001),见表2;不同的Child-Pugh分级患者间发生不良反应率比较差异无统计学意义(P>0.05),见表3。
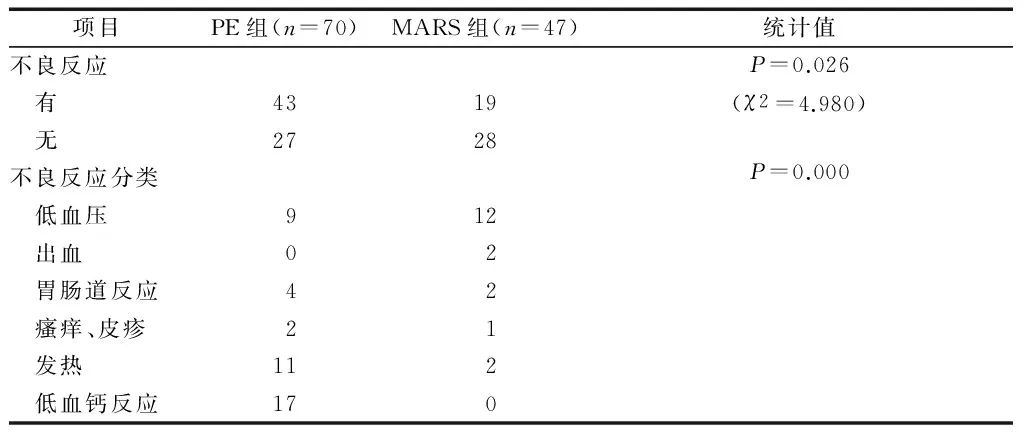
表2 2组人工肝过程中的不良反应比较 次
2.2 2组人工肝治疗前后各观察指标的比较
2组患者根据有无不良反应,分别分为有反应组和无反应组:PE有反应组患者年龄(47.25±11.47)岁,人工肝治疗44次,无反应组患者年龄(47.25±11.47)岁,人工肝治疗26次,有、无反应组患者年龄比较差异有统计学意义(P<0.05);MARS有反应组患者年龄(46.68±16.31)岁,人工肝治疗19次,无反应组患者年龄(39.04±10.84)岁,人工肝治疗28次,有、无反应组患者年龄比较差异有统计学意义(P<0.05)。各组患者在治疗后,ALT、TBIL、DBIL、Cr、Hb、PLT、RBC均显著低于治疗前(P<0.05),但Na+、Cl-较治疗前升高(P<0.05);WBC在PE后有所下降,而在MARS则显著升高(P<0.05);BUN在PE有反应组和MARS有反应组治疗后均显著下降(P<0.05)。见表4。
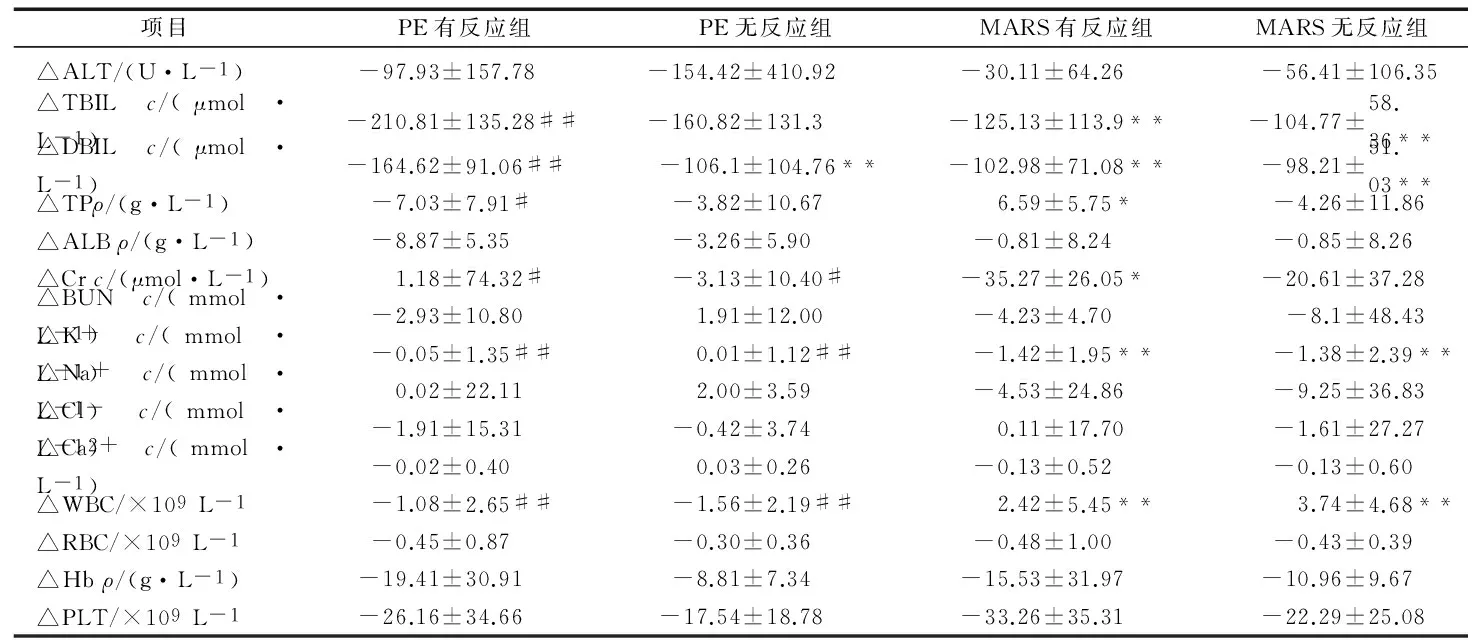
2.3 各组治疗前后各观察指标差值比较
计算检测指标治疗后与治疗前的差值,记为△值。DBIL、TBIL在PE有反应组下降最显著,Cr在MARS有反应组下降最显著,WBC在MARS有反应组和MARS无反应组均有显著的升高。ANOVA分析,各组间有差异的指标有△TBIL(F=5.421,P=0.002)、△DBIL(F=5.116,P=0.002)、△Cr(F=2.847,P=0.041)、△K+(F=5.947,P=0.001)、△WBC(F=14.222,P=0.000)。见表5。
2.4 二元logistic回归分析
患者人工肝过程中发生不良反应相关因素有:治疗类型(PE或MARS),OR0.410(95%CI0.175~0.959,P=0.040);治疗前Ca2+浓度,OR值26.562(95%CI1.366~520.316,P=0.030)以及患者治疗前RBC,OR0.357(95%CI0.194~0.656,P=0.001)。

表3 2组不同Child-Pugh分级和不良反应比较 次

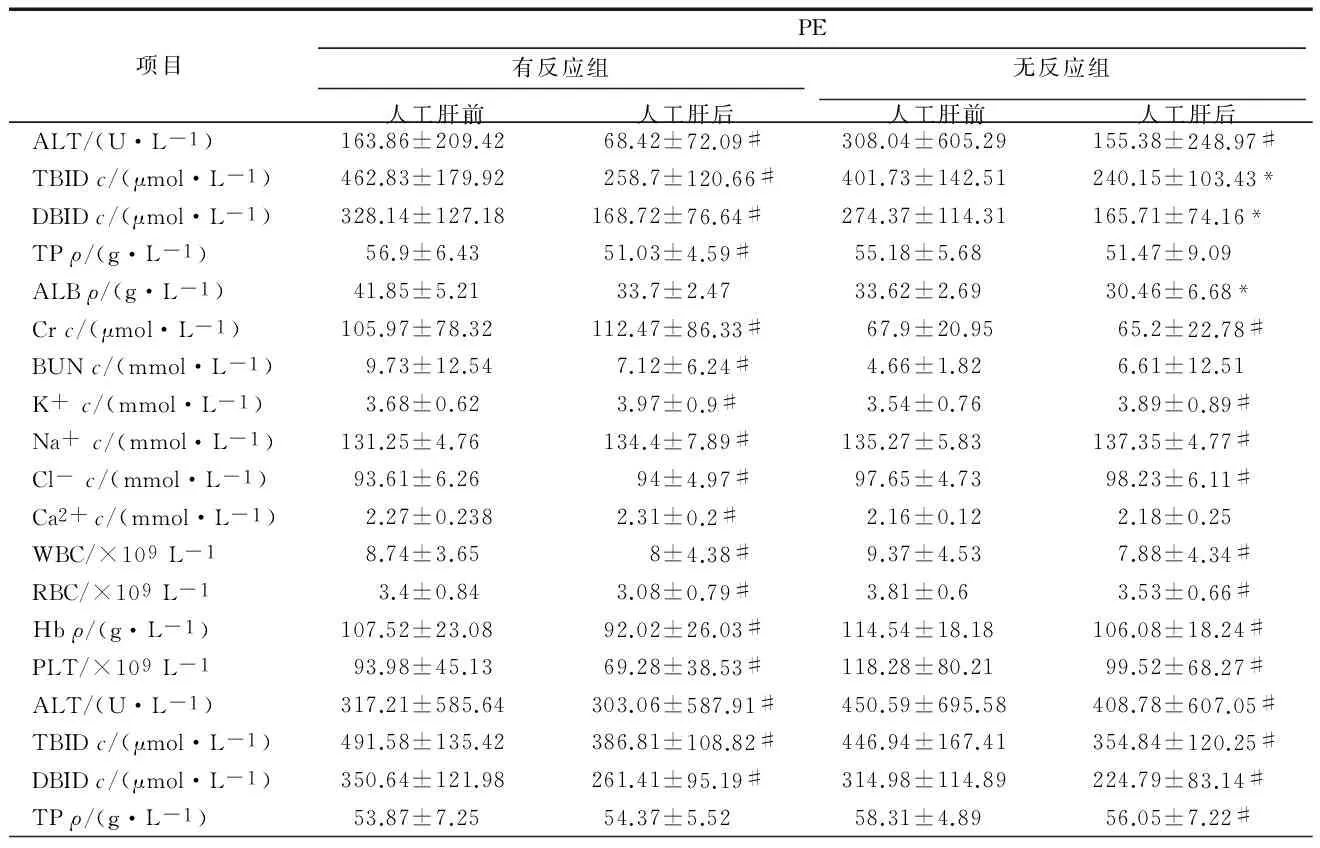
项目PE有反应组无反应组人工肝前人工肝后人工肝前人工肝后ALT/(U·L-1)163.86±209.4268.42±72.09#308.04±605.29155.38±248.97#TBIDc/(μmol·L-1)462.83±179.92258.7±120.66#401.73±142.51240.15±103.43*DBIDc/(μmol·L-1)328.14±127.18168.72±76.64#274.37±114.31165.71±74.16*TPρ/(g·L-1)56.9±6.4351.03±4.59#55.18±5.6851.47±9.09ALBρ/(g·L-1)41.85±5.2133.7±2.4733.62±2.6930.46±6.68*Crc/(μmol·L-1)105.97±78.32112.47±86.33#67.9±20.9565.2±22.78#BUNc/(mmol·L-1)9.73±12.547.12±6.24#4.66±1.826.61±12.51K+c/(mmol·L-1)3.68±0.623.97±0.9#3.54±0.763.89±0.89#Na+c/(mmol·L-1)131.25±4.76134.4±7.89#135.27±5.83137.35±4.77#Cl-c/(mmol·L-1)93.61±6.2694±4.97#97.65±4.7398.23±6.11#Ca2+c/(mmol·L-1)2.27±0.2382.31±0.2#2.16±0.122.18±0.25WBC/×109L-18.74±3.658±4.38#9.37±4.537.88±4.34#RBC/×109L-13.4±0.843.08±0.79#3.81±0.63.53±0.66#Hbρ/(g·L-1)107.52±23.0892.02±26.03#114.54±18.18106.08±18.24#PLT/×109L-193.98±45.1369.28±38.53#118.28±80.2199.52±68.27#ALT/(U·L-1)317.21±585.64303.06±587.91#450.59±695.58408.78±607.05#TBIDc/(μmol·L-1)491.58±135.42386.81±108.82#446.94±167.41354.84±120.25#DBIDc/(μmol·L-1)350.64±121.98261.41±95.19#314.98±114.89224.79±83.14#TPρ/(g·L-1)53.87±7.2554.37±5.5258.31±4.8956.05±7.22#
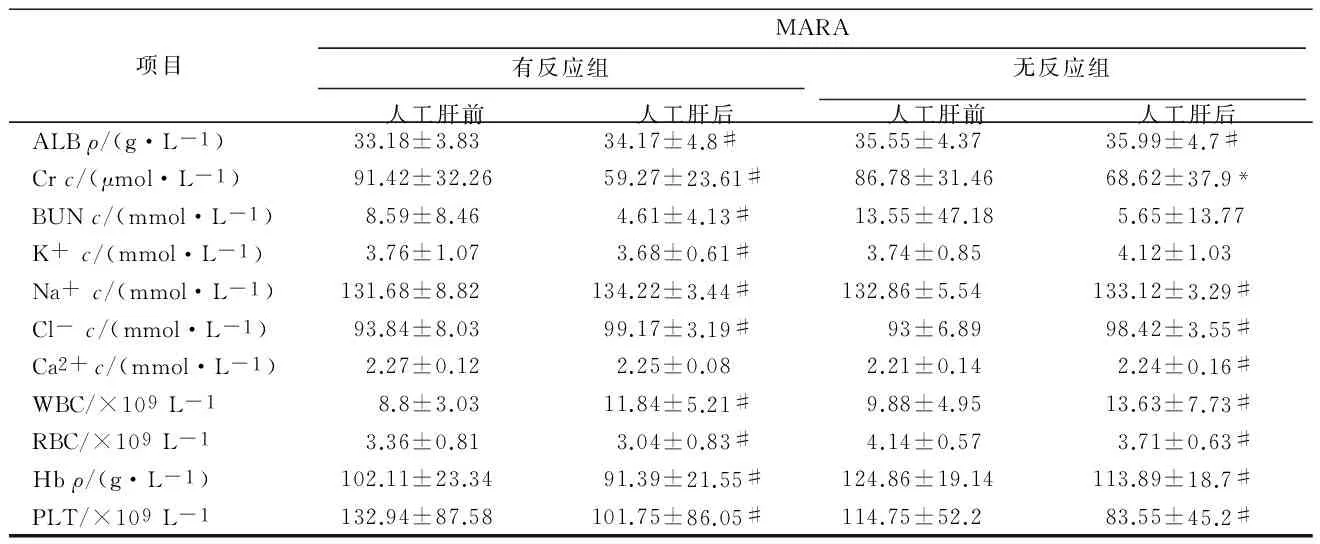
表4(续)
#P<0.01与人工肝前比较,*P<0.05与人工肝前比较。

项目PE有反应组PE无反应组MARS有反应组MARS无反应组△ALT/(U·L-1)-97.93±157.78-154.42±410.92-30.11±64.26-56.41±106.35△TBILc/(μmol·L-1)-210.81±135.28##-160.82±131.3-125.13±113.9**-104.77±58.36**△DBILc/(μmol·L-1)-164.62±91.06##-106.1±104.76**-102.98±71.08**-98.21±51.03**△TPρ/(g·L-1)-7.03±7.91#-3.82±10.676.59±5.75*-4.26±11.86△ALBρ/(g·L-1)-8.87±5.35-3.26±5.90-0.81±8.24-0.85±8.26△Crc/(μmol·L-1)1.18±74.32#-3.13±10.40#-35.27±26.05*-20.61±37.28△BUNc/(mmol·L-1)-2.93±10.801.91±12.00-4.23±4.70-8.1±48.43△K+c/(mmol·L-1)-0.05±1.35##0.01±1.12##-1.42±1.95**-1.38±2.39**△Na+c/(mmol·L-1)0.02±22.112.00±3.59-4.53±24.86-9.25±36.83△Cl-c/(mmol·L-1)-1.91±15.31-0.42±3.740.11±17.70-1.61±27.27△Ca2+c/(mmol·L-1)-0.02±0.400.03±0.26-0.13±0.52-0.13±0.60△WBC/×109L-1-1.08±2.65##-1.56±2.19##2.42±5.45**3.74±4.68**△RBC/×109L-1-0.45±0.87-0.30±0.36-0.48±1.00-0.43±0.39△Hbρ/(g·L-1)-19.41±30.91-8.81±7.34-15.53±31.97-10.96±9.67△PLT/×109L-1-26.16±34.66-17.54±18.78-33.26±35.31-22.29±25.08
**P<0.01与PE有反应组比较,*P<0.05与PE有反应组比较;##P<0.01与MARS有反应组比较,#P<0.05与MARS有反应组比较。
3 讨论
重型病毒性肝炎时,病毒可通过表达特定的病毒蛋白产物、细胞膜受体以及诱导机体释放穿孔素/颗粒酶等免疫反应导致肝细胞凋亡[4],患者肝脏功能严重受损,肝脏解毒功能明显下降。人工肝支持系统是将患者的血浆分离并去除,然后补充等量置换液如同种新鲜冰冻血浆或白蛋白等,在清除体内有害物质的同时补充体内所缺乏的凝血因子、白蛋白等物质,减轻肝脏及全身炎症反应,利于肝组织再生,是救治重型肝炎的有效治疗手段[1,5]。
本研究中,PE组和MARS组患者的年龄、男女构成比例以及肝功能Child-Pugh分级比较差异无统计学意义(P>0.05)。人工肝治疗后,患者的ALT、TBIL、DBIL、Cr较治疗前均显著下降(P<0.05),但Na+、Cl-较治疗前升高,提示人工肝治疗对改善患者肝功能、清除Cr以及调节电解质浓度有显著作用。Hb、PLT、RBC在治疗后显著下降,考虑与循环治疗过程中的损耗相关,即可认为人工肝治疗会加重患者贫血和血小板减少的情况。WBC在PE后有所下降,而MARS后却显著升高,提示两种治疗方案对患者的免疫系统的作用不同;BUN仅在2组有反应组中治疗后显著下降,而在无反应组中未见显著下降,其机制有待研究。
人工肝过程中最常见的严重不良反应有低血压、荨麻疹和低血钙等,不良反应的严重程度与处理的血液以及置换液的量呈正相关[6]。不良反应发生率在2组患者发生率较高(53.00%,62/117),在2组间的发生率有区别,PE组的不良反应发生率(61.43%,43/70)显著高于MARS组(40.43%,19/47),其中PE组低血钙反应最多,而MARS组的低血压反应
最多。低血钙与置换的血浆中的枸橼酸抗凝剂有关,低血压可因置换液置换的速度慢于血液流出速度或置换液胶体渗透压较低引起,组内的发生不良反应和未发生不良反应患者的肝功能Child-Pugh分级差异无统计学意义。不良反应的发生于治疗类型(PE或MARS)、治疗前Ca2+浓度以及患者治疗前RBC有关。
通过对检测指标治疗后与治疗前的差值ANOVA分析,不同治疗组有无不良反应间有差异的指标有△TBIL、△DBIL、△Cr、△K+、△WBC。治疗前,TBIL、K+、WBC在4组间值差异无统计学意义,DBIL仅在PE无反应组和MARS有反应组差异有统计学意义(P=0.039),Cr仅在PE无反应组和PE有反应组差异有统计学意义(P=0.005);经过人工肝治疗,TBIL和DBIL下降在PE组中最显著,Cr在MARS有反应组降低最多,K+在MARS组下降显著,WBC在MARS组显著升高。
本研究结果提示2组人工肝均能有效降低ALT、TBIL、DBIL、Cr,且治疗后Hb、PLT、RBC降低,但PE对降低胆红素浓度的能力高于MARS,而清除Cr不如MARS。人工肝治疗过程中出现的不良反应与治疗类型、治疗前患者Ca2+浓度以及治疗前RBC有关,PE的不良反应率高于MARS,不良反应影响治疗前后TBIL、DBIL、Cr、K+、WBC值的变化。
参考文献:
[1] 林伟,孔明,高玉娟.不同类型人工肝治疗重型肝病的即刻疗效及不良反应对照[J].临床肝胆病杂志,2011,27(3):306-308.
[2] Tamaki N.New year's resolution:increase the impact factor of this journal[J].Jpn J Radiol,2016,34(1):1-2.
[3] 中华医学会感染病学分会肝衰竭与人工肝学组.肝衰竭诊治指南:2012年版[J].实用肝脏病杂志,2013,21(3):210-216.
[4] Cao L,Quan X B,Zeng J,et al.Mechanism of Hepatocyte Apoptosis[J].J Cell Death,2016,9:19-29.
[5] 朱其荣,王川林,刘娇,等.分子吸附再循环系统对肝衰竭患者血清Th1/Th2型细胞因子水平的影响[J].实用肝脏病杂志,2017,20(1):107-108.
[6] Mörtzell Henriksson M,Newman E,Witt V,et al.Adverse events in apheresis:an update of the WAA registry data[J].Transfus Apher Sci,2016,54(1):2-15.

