拆分网络分析22株蛹虫草亲缘关系及高产虫草素菌株初筛
刘建兵 戚梦 杜苑如 傅俊生 胡开辉
(福建农林大学生命科学学院生物工程系,福州 350002)
蛹虫草Cordyceps militaris(L.)Fr.俗称北冬虫夏草、北虫草、蛹草等,属子囊菌门Ascomycota、肉座菌目Hypocreales、麦角菌科Clavicipitaceae、虫草属Cordyceps,在自然界中分布广泛[1]。其子实体和发酵产物中均含有丰富的虫草素、虫草酸、腺苷及多糖等活性成分,具有抗菌、消炎、抗肿瘤、降血糖及调节人体免疫功能等作用,在我国作为食药用真菌而广泛应用[2]。但目前蛹虫草产业存在着很多问题,尤其是缺乏优质菌种、菌种易退化以及“同种异名”或“同名异种”现象严重等问题是制约蛹虫草产业化的重要瓶颈。应对这些问题的主要手段是重新分离野生菌株以及进行人工育种,杂交育种是最重要的育种方法之一[3]。在进行杂交育种之前,充分认识亲本菌株间的亲缘关系是必要的,限制性片段长度多态性(RFLP)、随机扩增多态性DNA(RAPD)、简单重复间序列(ISSR)及rDNA ITS序列是研究蛹虫草亲缘关系最常见的几种分子标记方法[4-5]。其中rDNA ITS序列因其应用广泛及操作简便等优点而备受研究者的喜爱,并且ITS序列分析可以比较序列中单碱基的变化,是研究真菌遗传变异最灵敏的方法之一,所以常用来研究真菌种内的亲缘关系及遗传分化[6]。但诸多研究表明[7-8],ITS序列在蛹虫草种内的变异率比较低,用传统的系统发育树很难分析种内的聚类情况及亲缘关系,所以建立一种基于ITS序列直观地分析蛹虫草种内聚类情况及亲缘关系的方法具有重要意义。
虫草素cordycepin最初是从蛹虫草中分离出来的核苷类抗菌素,也是我国传统名贵中药材蛹虫草和冬虫夏草的主要活性成分之一,具有抗肿瘤、抗菌、抗衰老、免疫调节和清除体内自由基等多种药理作用,所以虫草素可作为评价菌种质量的重要指标[1,9]。基于此,本研究采用ITS序列对22株蛹虫草行分类鉴定,用拆分网络法研究蛹虫草种内的聚类情况,并比较供试菌株发酵产虫草素能力,为蛹虫草菌株质量监测和菌种鉴定提供快速有效的技术手段。
1 材料与方法
1.1 菌株来源
本研究所用的蛹虫草菌株共22株(表1)。
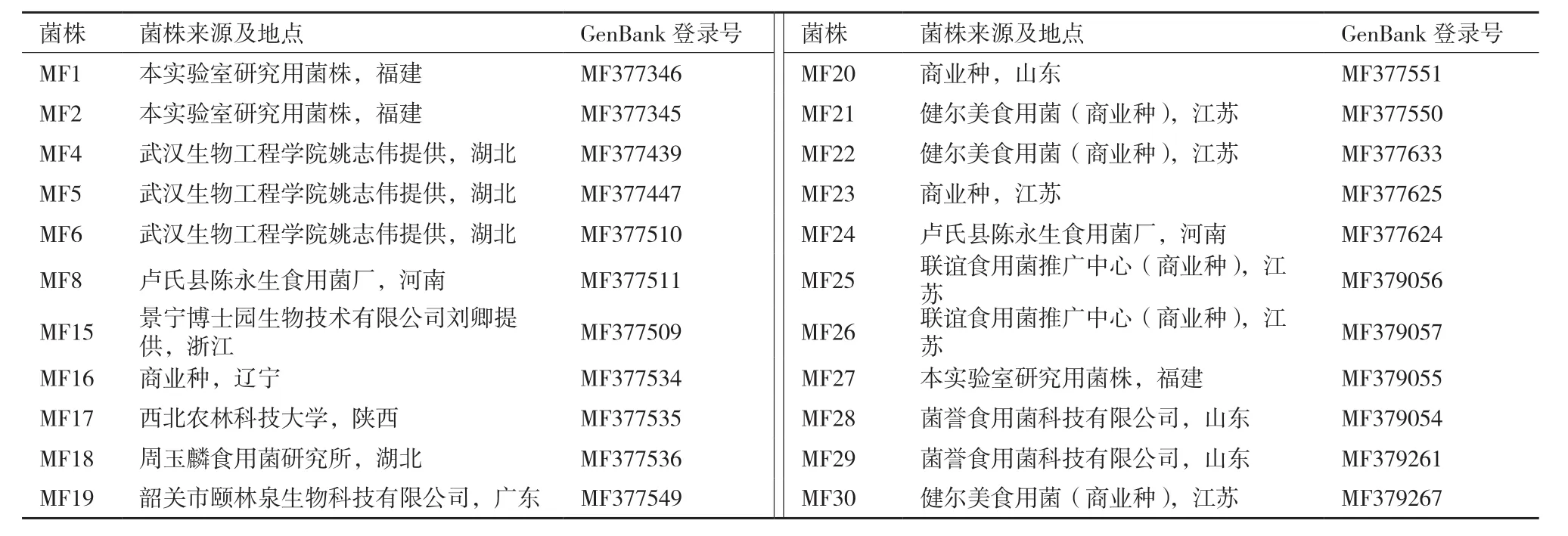
表1 供试菌株
1.2 方法
1.2.1 菌株基因组DNA提取、ITS区扩增及测序 将活化的菌株以打孔法接种到液体培养基(葡萄糖20 g,蛋白胨2 g,酵母膏2 g,H2PO41.5 g,MgSO4·7 H2O 0.5 g,水 1 L)中,25℃、160 r/min培养6 d后,过滤收集菌丝。菌丝使用液氮研磨,并按照OMEGA真菌基因组DNA提取试剂盒提取菌株基因组DNA,再按照Bioteke 2×power Taq PCR MasterMix试剂盒说明扩增ITS区序列,引物采用真菌核糖体基因间隔区通用ITS1(5'-TCCGTAGGTGAACCTGCGG-3') 和 ITS4(5'-TCCTCCGCTTATTGATATGC-3')。反应条件:95℃ 2 min;95℃ 30 s,62℃ 30 s,72℃ 1 min,28个循环;72℃ 10 min。扩增样品经1%琼脂糖胶检测后送往生工生物工程(上海)股份有限公司进行测序。
1.2.2 ITS序列分析 将序列在GenBank 数据库中注册获得登录号。利用NCBI中的BLAST对DNA序列进行比对分析;用DNAMAN V6软件统计序列长度、GC含量;用系统发育分析软件 MEGA6.0软件的ClustalW功能进行序列比对,并统计序列的变异情况;采用Splits Tree 4构建折分网络图,运行条件为默认设置。
1.2.3 虫草素含量检测 将活化的菌株以打孔法接种到液体培养基中,250 mL三角瓶装100 mL培养基,25℃、160 r/min培养13 d后,抽滤分离发酵液和菌丝;HPLC法测摇瓶发酵液及菌丝体中虫草素含量,发酵液过0.22 μm滤膜后上机检测,菌丝体烘干后粉碎,加水超声浸提,料液比1∶80(g:mL),离心取上清过滤膜,后上机检测虫草素含量;色谱条件:岛津ODS-2 C18 色谱柱,流动相为甲醇∶水=15∶85,流速1 mL/min,柱温25℃,检测波长260 nm,进样10 μL。
1.2.4 统计学分析 采用 SPSS 23.0 统计软件包进行数据处理,不同处理组间比较采用one-way ANOVA检验,实验数据以x-±s表示,P< 0.05 表示差异有统计学意义。
2 结果
2.1 供试蛹虫草菌株的ITS序列差异
测序结果(表2)表明,22供试的株蛹虫草ITS序列长度在518-539 bp之间,相差21 bp;G+C含量差异较小,从56.42%到57.54%。根据GenBank中已有的蛹虫草ITS序列信息,确定供试样品ITS序列的ITS1、5.8S及ITS2区域,去除18S和26S区引物端序列后,将供试菌株及外类群 ITS序列对位排列(图1),分析菌株间ITS序列的变异情况,共有39个差异位点(Variable sites),其中简约信息(Parsimony informative,PI)位点有12个,而序列的差异主要来源于ITS1区,5.8S区和ITS2区在供试蛹虫草菌株间没有碱基差异。
2.2 拆分网络法分析22株蛹虫草的亲缘关系
基于上述ITS序列的分析,拆分网络分析22株蛹虫草菌株间的亲缘关系(图2)表明,22株蛹虫草聚为了三个类群。
第一类群由9株(MF1、5、15、17、18、19、27、28、29)蛹虫草组成,以其特有的第6位点(Site6)位点处的碱基替换而区别于其他菌株,在这个信息位点中既发生了碱基的转换(transition)又发生了碱基的颠换(transversion),这个类群菌株在此位点发生了G-T或A-T间的颠换,而颠换所占的权重(处理DNA序列时)要大于转换,所以在拆分网络上形成了一个分裂;并且在这9个菌株中,MF5、19、27由于在第11位点(Site11)处发生的A-C碱基的颠换,而显示了较近的亲缘关系。
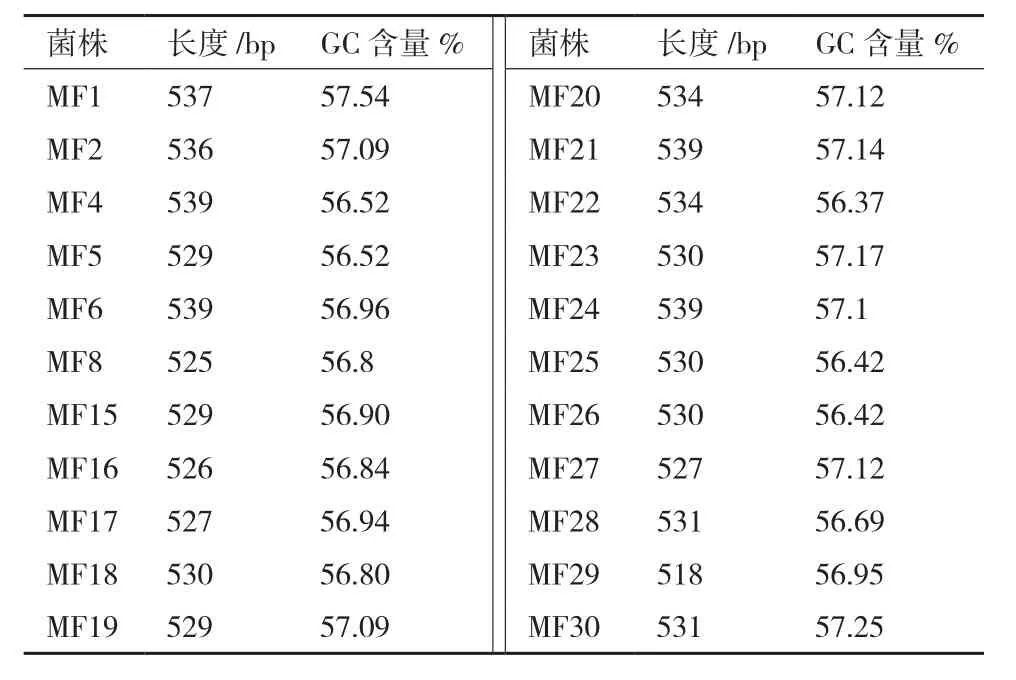
表2 供试菌株r DNA-ITS区序列信息
第二类群由菌株MF2、4、6、8、16、20、24、25、26组成,因共同表现在第8位点(Site8)和第17位点(Site17)处发生的碱基替换而形成亲缘关系较近的类群,明显区别于其它菌株,此外菌株MF2、25、26以及MF4、6因ITS序列100%的相似度而处于相同的系统位置。
第三个类群的4个菌株(MF21、22、23、30)均来源于江苏,因第8位点的碱基颠换而形成一个小分支,表现为亲缘关系较近,可能为“同种异名”菌株。
2.3 供试蛹虫草菌株液体发酵产虫草素能力
虫草素是蛹虫草的主要活性成分之一,也是作为评价产品品质优劣的主要指标,所以筛选出高产虫草素的菌株对生产具有实际意义的。从图3可以看出,虫草素的出峰时间为16.02 min左右,发酵液及菌丝体中的虫草素能够很好的被分离开。从表3可以看出,不同菌株间产虫草素能力相差很大,且蛹虫草的液体发酵物中胞外液占主要体积,而胞外液中都有较高虫草素含量,所以可以看出蛹虫草在液体发酵过程中,虫草素主要存在于胞外液中;从胞外液中虫草素含量来看,MF27产量最高,含量达到332.74 mg/L,是含量最低菌株MF25的31倍,且显著的高于其它菌株(P<0.05),这为后续的优良菌株选育,以及优良菌株的推广奠定了良好基础。

图1 供试菌株ITS序列变异位点分析
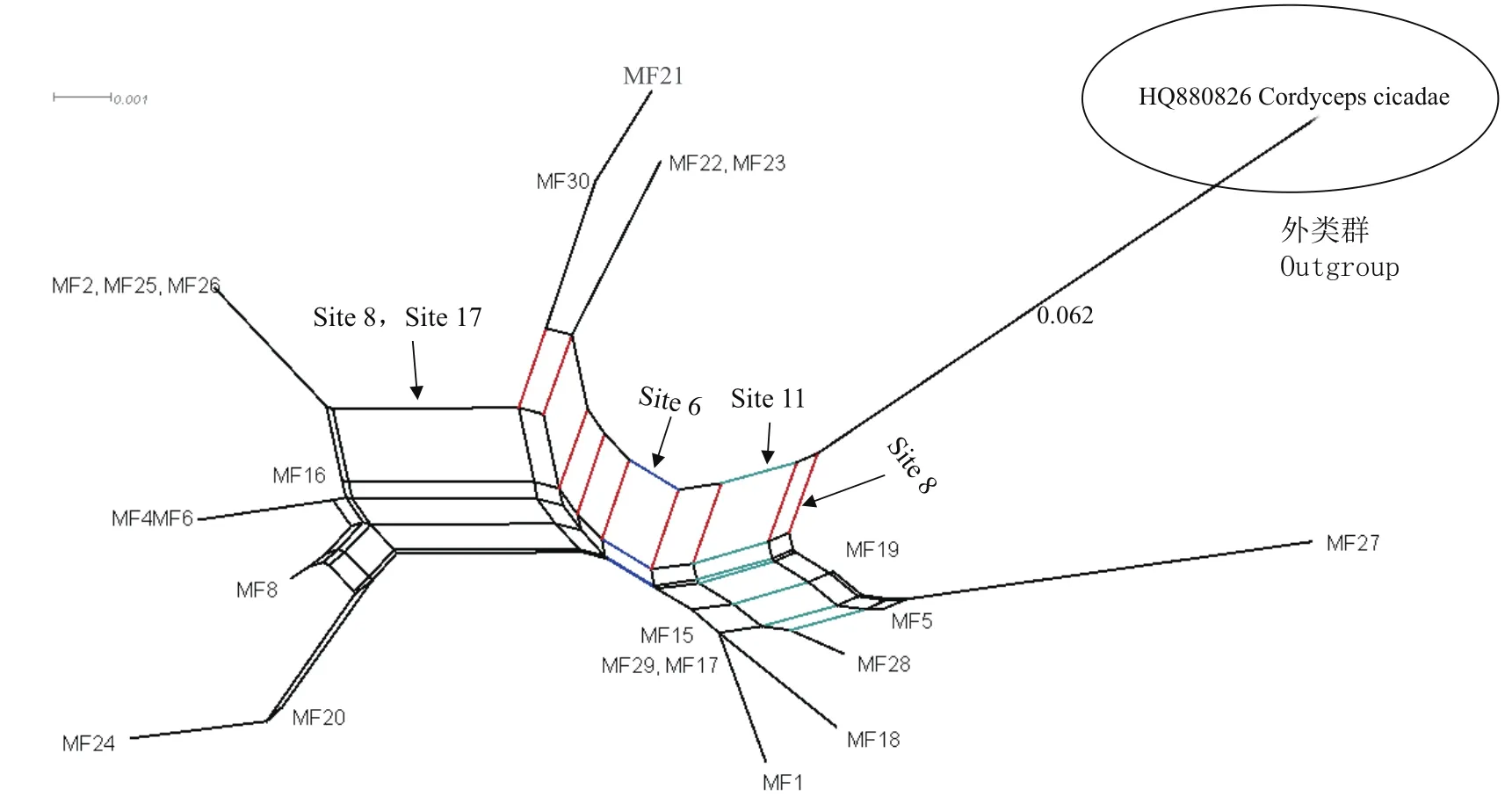
图2 基于ITS序列构建的拆分网络
3 讨论

图3 虫草素标准品(A)和MF27虫草胞外液(B)HPLC分析图谱
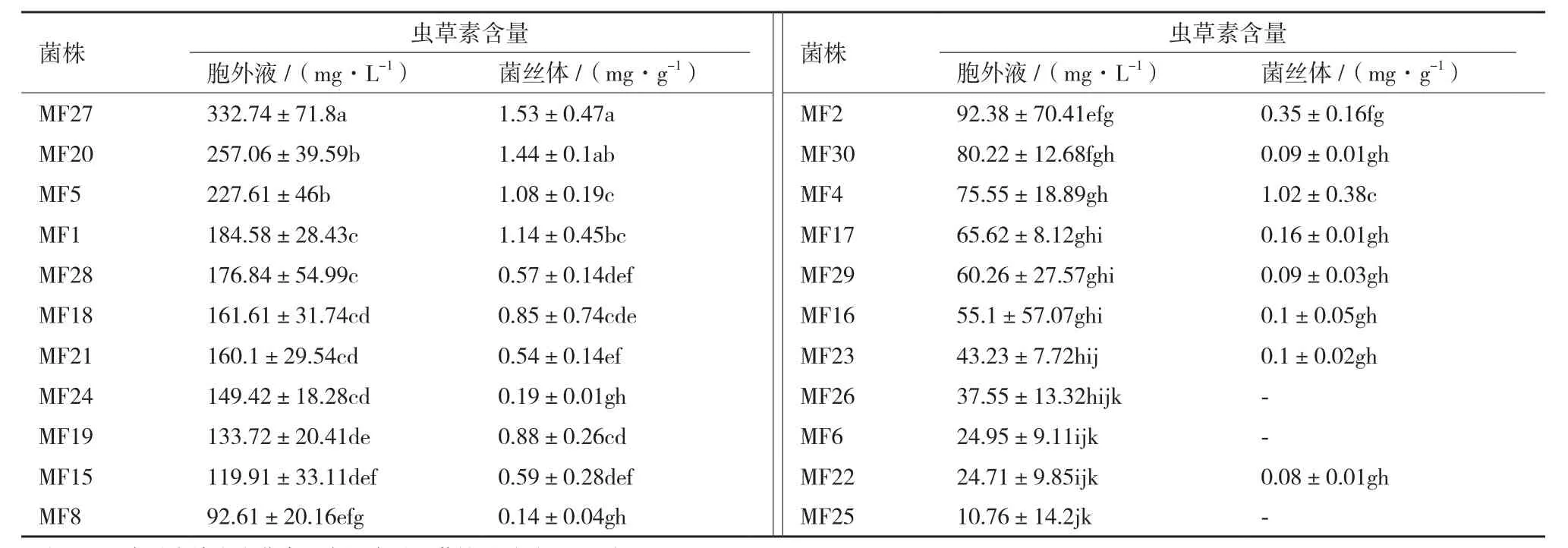
表3 供试菌株液体发酵产虫草素能力比较
本文利用拆分网络法,基于ITS序列分析22株蛹虫草的亲缘关系,结果在拆分网络上聚类为3个类群,发现每个类群因其特有的碱基替换而区别于其他菌株,较直观地展示了菌株间的亲缘关系。拆分网络splits networks法[10-12]是系统发育网络phylogenetic networks分析中常用的方法之一,能用以描述数据集中冲突的、模糊不清的信号,检测一些细微的差异,能提供一个二叉进化树不能展示的、被掩盖了的平行事件,不确定的系统发育关系进化图像。由于拆分网络的优越性,使得其得到了越来越广泛的应用和认可。胡春云[13]分别应用简约法系统树和NeighborNet系统发育网络,基于cpDNA序列分析梨属植物系统发育关系,发现NeighborNet能解释系统发育树上低支持率现象是由冲突的信和信息位点不足引起的,能更好地分析种群的演化。梁宗琦[10]和周叶鸣等[14]研究表示拆分网络配合系统发育树能更清楚地解释物种之间的进化关系,且拆分网络更适合分析亲缘关系较近的物种间的遗传分化。
虫草素最早是从蛹虫草中分离出来的,所以又被称作蛹虫草菌素、虫草菌素,是蛹虫草中标志性的活性成分[15]。冯德龙等[16]以19株蛹虫草为研究材料,CYM 液体培养基25℃摇瓶培养 20 d后用HPLC法检测各菌株发酵液的虫草素含量,结果虫草素积累量最高的达到126.33 mg/L;王蕾等[17]从14株蛹拟青霉菌株Paecilomyces militarisZ.Q. Liang中筛选到CM001菌株的虫草素产量最高,达到73.81 mg/L。本文以液体发酵产虫草素能力为指标评价菌株的品质特性,结果显示MF27发酵液虫草素含量达到332.74 mg/L,是含量最低菌株MF25的31倍,且显著高于其它菌株(P<0.05),可见MF27具有一定的推广应用价值。
4 结论
本文建立了基于rDNA ITS序列,利用拆分网络分析蛹虫草亲缘关系的方法,并筛选出高产虫草素菌株,MF27的发酵液中虫草素含量为332.74 mg/L,显著高于其它菌株(P<0.05)。本研究为分析蛹虫草菌株间的亲缘关系提供了科学方法。
[1] 文庭池, 查岭生, 康冀川, 等. 蛹虫草研究和开发过程中的一些问题和展望[J]. 菌物学报, 2017, 36(1):14-27.
[2] 杨婷. 北虫草中虫草素的提取及产品开发[D]. 大连:大连工业大学, 2014.
[3] 贾国军, 徐盛燕, 王剑虹, 等. 蛹虫草育种技术的研究进展综述[J]. 食药用菌 , 2017, 147(5):45-48.
[4] 王荣宇. 蛹虫草种质资源ISSR分析与优质高产菌株筛选[D].福州:福建农林大学, 2012.
[5] Shu XL, Shen SQ, Bao JS,et al.Molecular and biochemical analysis of the gelatinization temperature characteristics of rice(Oryza sativaL.)Starch granules[J]. Journal of Cereal Science, 2006, 44(1):40-48.
[6] 谭秀梅, 李永, 朴春根, 等. 杏鲍菇遗传多样性的SRAP和ITS分析[J]. 中国农学通报, 2016, 411(12):117-122.
[7] Chen YQ, Hu B, Xu F,et al.Genetic variation of Cordyceps sinensis,a fruit-body-producing entomopathogenic species from different geographical regions in China. [J]. FEMS Microbiol Lett, 2004,230(1):8-153.
[8] 唐传红, 唐庆九, 张劲松, 等. 基于rDNA ITS序列和ERICPCR研究虫草真菌无性分离物的遗传多样性[J]. 南京农业大学学报, 2014, 37(2):146-152.
[9] Naru K, Lee HH, Park I,et al.Development of high cordycepinproducingCordyceps militarisstrains[J]. Mycobiology, 2017, 45(1):31-38.
[10] 梁宗琦, 陈万浩, 梁建东, 等. 一个蚁巢中束梗孢类昆虫病原真菌的多型现象Ⅰ[J]. 菌物学报, 2016, 158(8):12-23.
[11] 周家喜, 邹晓, 梁宗琦. 一种罕见虫生真菌蜻蜓层束梗孢的重新描述[J]. 山地农业生物学报, 2015, 147(6):54-56.
[12] Morozov AA, Galachyants YP, likhoshway YV. Inferring Phylogenetic Networks from Gene Order Data[J]. BioMed Research International, 2013:1-7.
[13] 胡春云. 基于叶绿体DNA非编码区的梨属系统发育关系及东亚栽培梨的演化研究[D]. 杭州:浙江大学, 2012.
[14] 周叶鸣, 邹晓, 瞿娇娇, 等. 中国虫草一新记录种[J]. 微生物学通报, 2015, 42(9):1710-1716.
[15] 买尔哈巴·艾合买提, 古丽·艾合买提, 杨新平. 产虫草素真菌资源的研究现状及应用前景[J]. 天然产物研究与开发,2015, 27(7):1317-1323.
[16] 冯德龙, 胡惠萍, 黄龙花, 等. 野生虫草无性型分离株分子鉴定及遗传多样性研究[J]. 现代食品科技, 2017, 33(4):1-7.
[17] 王蕾, 罗巍, 胡瑕, 等. 虫草素高产菌株的筛选及不同添加物对虫草素产量的影响研究[J]. 菌物学报, 2012, 31(3):382-388.

