一例蛋鸡传染性喉气管炎的诊治与体会
祖立闯,薛凌壮,王 艳,苗立中*(. 山东绿都生物科技有限公司,山东 滨州 56600; . 山东省临清市畜牧兽医局,山东 临清 5600; . 山东省滨州畜牧兽医研究院,山东 滨州 56600)
鸡传染性喉气管炎(Infectious laryngotracheitis,ILT)是由疱疹病毒科(Herpesviridae)α疱疹病毒亚科(Alphaherpesvirinae)的鸡传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)引起鸡的一种急性呼吸道传染病,其特征表现为呼吸困难、喉部和气管黏膜肿胀、咳嗽及咳出含有血液的渗出物[1-2]。ILTV只能水平传播,病毒可以潜伏在三叉神经节等部位使病鸡终身带毒,病鸡和带毒鸡是主要传染源,主要通过气管黏膜和眼结膜途径感染[3]。近年来,随着我国养鸡业的规模化快速发展,ILT呈现出“老病新发”、以“非典型”和“温和型”症状为主的流行新特征[4-5],给我国鸡病的临床诊断增加了难度,并造成了巨大的经济损失。2017年1~3月,山东蛋鸡养殖场发生了ILTV感染病例,通过对病死鸡的临床症状观察,结合病理剖检和实验室诊断,最终才对该病例进行了确诊,现将整个诊疗过程介绍如下,为相同疾病的诊治提供参考。
1 发病情况
2017年1月26日,山东省临清市某鸡场一栋5 000只330日龄海兰灰鸡群(A鸡群)出现个别鸡只单侧眼流泪、喘鸣、怪叫等症状,精神萎靡、饮食减少、伸颈张口呼吸,每天死亡3~5只;到29日大群发病,咳嗽加重、张口喘吸、甩血痰,产蛋量减少、采食量骤减、死亡增加至30只;同时,相邻的7 300只210日龄京粉鸡群(B鸡群)也出现相似症状,因春节原因,拖到1月30日才来就诊。经询问,该场进行了新城疫、禽流感、传染性支气管炎等疫苗的免疫接种,但从未进行过ILT疫苗的免疫接种,遂按传染性喉气管炎病投药5 d,但未见疗效,死亡增至100只左右,怀疑有新城疫、禽流感等疾病混合感染,2月5日,送检病重鸡至实验室检验。
2 临床症状
A鸡群发病蛋鸡大棚饲养,通风不良,走进鸡舍明显感觉到氨气味、腥臭味;鸡群精神沉郁,饮食减少,由正常时的600 kg/d减少至400 kg/d,拉白稀粪,个别绿粪;部分鸡只鸡冠发绀,张口呼吸,呼噜音,咳嗽,咳带血黏液;少部分鸡只肿眼流泪,流涕,无法饮食,迅速消瘦;产蛋由发病之前的93 %左右降至最低66 %左右,蛋壳颜色变浅,但畸形蛋、沙皮蛋不多;到2月10日痊愈,最后因呼吸困难、消瘦、窒息至死亡约1 600只鸡。B鸡群症状大同小异,但总体较轻,到2月8日痊愈时共死亡700只左右。
3 病理变化
A鸡群解剖10只病死鸡,主要病变如下:气管浆膜外观不透明,色泽不均,出血斑6只;气管黏膜针尖状疱疹7只;气管有血色黏痰、干酪物6只;肺脏出血、肺支气管血栓、9只;肝脏色泽发暗、发黄、有出血点6只;腺胃黏膜水肿、出血点7只;肌胃内容物如黑焦油状2只,肌胃角质膜糜烂、易脱落1只,肌胃角质膜条纹状溃疡、米粒样肿胀甚至溃疡5只;肠道黏膜出血斑点5只,淋巴丛肿胀4只;卵泡出血、变形3只。B鸡群解剖5只病死鸡,主要病变有:气管浆膜外观色泽斑驳4只;气管黏膜针尖疱疹5只;血色黏液、条状黏痰3只;肺出血5只;其他器官如肝脏、脾脏、胃、肠道、卵巢和输卵管未见异常。
4 细菌观察与分离培养
将无菌采集的A鸡群和B鸡群病死鸡喉头、气管等组织样品涂片、革兰氏染色、镜检,均未见任何细菌。将无菌采集的A鸡群和B鸡群病死鸡喉头、气管等组织样品分别接种于鲜血琼脂平板、麦康凯琼脂平板、厌氧肉肝汤中进行细菌分离培养,均未见任何细菌生长。
5 病毒PCR检测与分离鉴定
5.1 病料样品PCR检测
分别设计合成针对鸡传染性喉气管炎病毒(ILTV)、鸡新城疫病毒(NDV)、鸡传染性支气管炎病毒(IBV)、H9亚型禽流感病毒(AIV-H9)、I亚群禽腺病毒(Fav-I)、禽网状内皮组织增生病病毒(REV)、禽呼肠孤病毒(ARV)特异性检测引物(详见表1)。利用病毒基因组DNA/RNA提取试剂盒(美国AXYGEN公司产品)分别提取A鸡群和B鸡群临床病料样品的病毒基因组DNA/RNA。分别利用以上7对特异性检测引物对病毒基因组DNA/RNA进行PCR/RT-PCR检测(详见表1),PCR扩增产物经1 %琼脂糖凝胶电泳检测显示,只有ILTV检测引物的PCR扩增产物在位于约427 bp处均具有特异性条带(如图1所示),与预期大小相符。
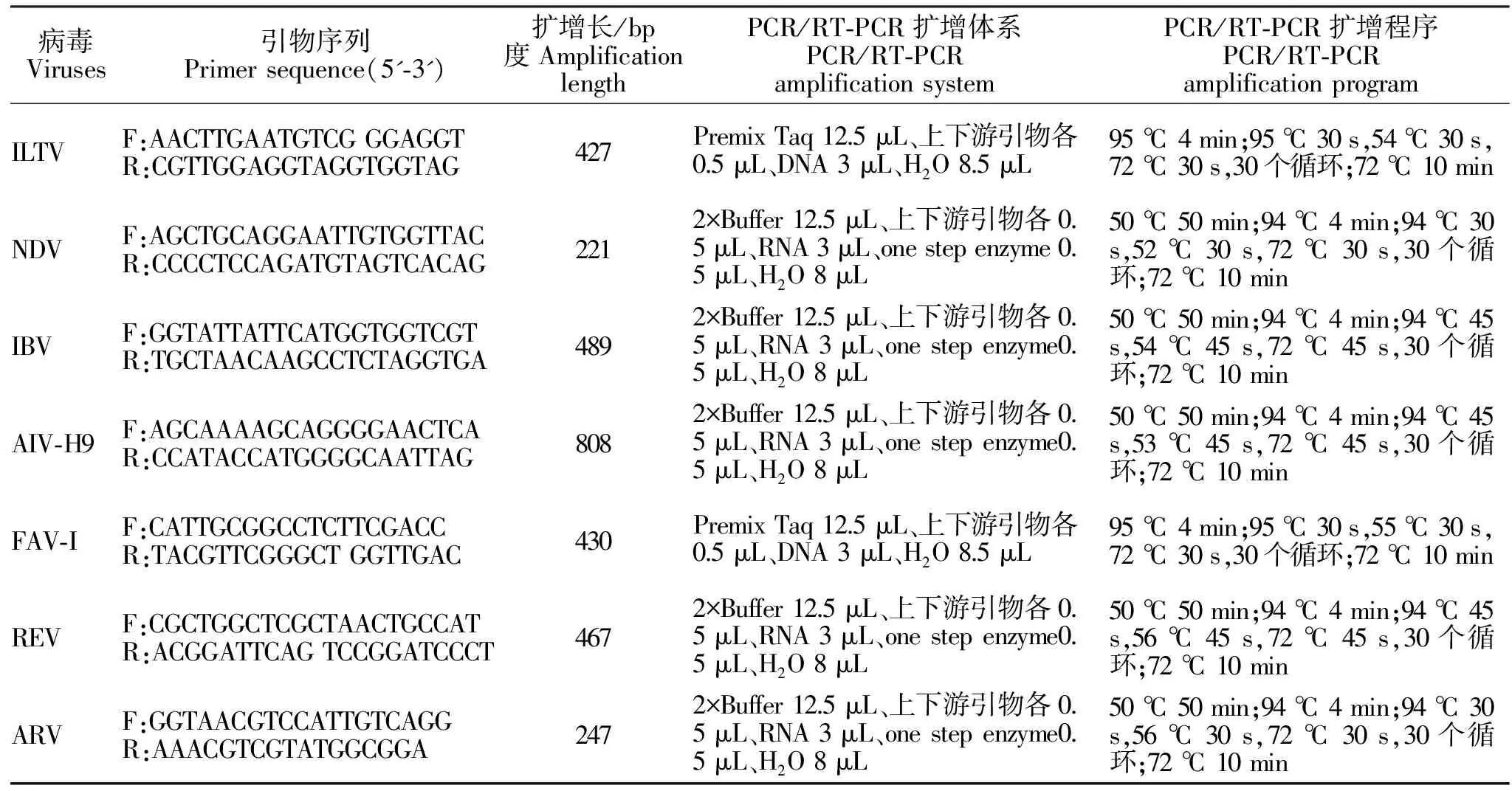
表1 引物与PCR扩增信息表Table 1 Information of primers and PCR amplification
5.2 病毒分离与鉴定
无菌采集病死鸡的喉头、气管等组织,将其与3倍体积灭菌生理盐水混合、碾磨,反复冻融3次,12 000 r/min离心10 min,取上清液经0.22 μm滤膜过滤除菌后,经绒毛尿囊膜途径接种10日龄SPF鸡胚(购自济南斯帕法斯家禽有限公司)10枚,0.2 mL/胚,37 ℃孵育至5 d,经盲传3代后,剖检鸡胚可见胚体全身具有出血点、绒毛尿囊膜增厚、绒毛尿囊膜表面具有大量白色痘斑等特征性病变,无菌收取鸡胚的尿囊液和绒毛尿囊膜。按照5.1的方法分别对A鸡群和B鸡群的分离毒株进行PCR检测,结果显示只有ILTV引物扩增为阳性,其余引物扩增均为阴性。
6 综合诊断结果
综合发病情况、临床特征、病理变化等临床诊断以及细菌观察与分离培养、病毒PCR检测与分离鉴定等实验室诊断结果,综合确诊此次疫病为ILT。
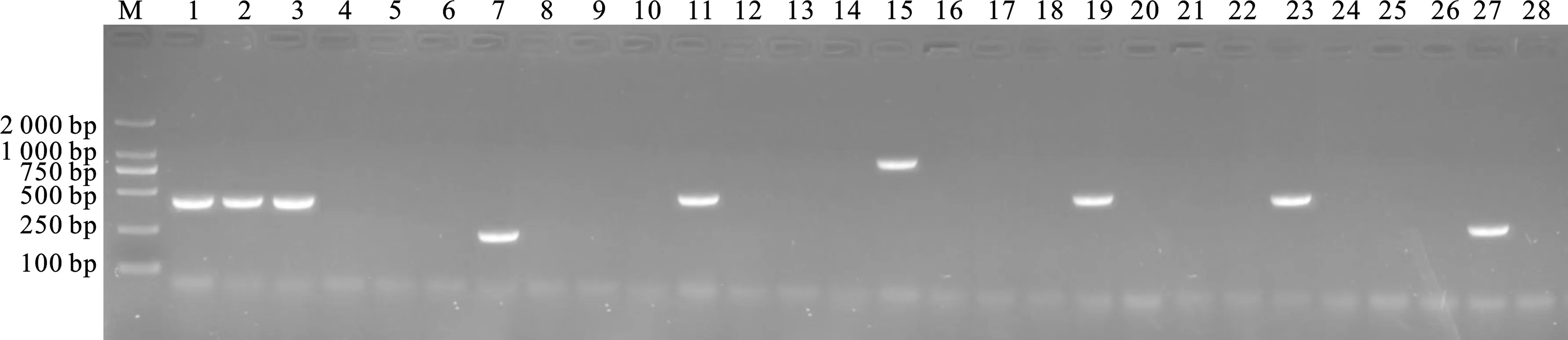
图1 PCR扩增结果M. DL-2 000 Marker;1. A鸡群ILTV;2. B鸡群ILTV;3. ILTV标准毒株对照;4. ILTV阴性对照;5. A鸡群NDV;6. B鸡群NDV;7. NDV标准毒株对照;8. NDV阴性对照;9. A鸡群IBV;10. B鸡群IBV;11. IBV标准毒株对照;12. IBV阴性对照;13. A鸡群AIV-H9;14. B鸡群AIV-H9;15. AIV-H9标准毒株对照;16. AIV-H9阴性对照;17. A鸡群FAV-I;18. B鸡群FAV-I;19. FAV-I标准毒株对照;20. FAV-I阴性对照;21. A鸡群ARV;22. B鸡群ARV;23.ARV标准毒株对照;24. ARV阴性对照;25. A鸡群REV;26. B鸡群REV;27. REV标准毒株对照;28. REV阴性对照.Fig.1 Results of PCR amplificationM. DL-2 000 Marker;1. A chicken flock ILTV;2. B chicken flock ILTV;3. ILTV standard strain control;4. ILTV negative control;5. A chicken flock NDV;6. B chicken flock NDV;7. NDV standard strain control;8. NDV negative control;9. A chicken flock IBV;10. B chicken flock IBV;11. IBV standard strain control;12. IBV negative control;13. A chicken flock AIV-H9;14. B chicken flock AIV-H9;15. AIV-H9 standard strain control;16. AIV-H9 negative control;17. A chicken flock FAV-I;18. B chicken flock FAV-I;19. FAV-I standard strain control;20. FAV-I negative control;21. A chicken flock ARV;22. B chicken flock ARV;23.ARV standard strain control;24. ARV negative control;25. A chicken flock REV;26. B chicken flock REV;27. REV standard strain control;28. REV negative control
7 治疗与预防方案
A鸡群因就诊时发病率较高,未敢紧急免疫,只采取了清肺平喘、止咳化痰、防继发感染等保守治疗。1月30日至2月4日饮服麻杏石甘汤、薄荷桉叶油及强力霉素,效果不理想;2月5日至2月10日,考虑到部分鸡只有腺胃炎、肌胃炎、肝炎的症状,在原方基础上又加上转移因子、葡萄糖氧化酶和胆汁酸方才治愈。
B鸡群因鸡群发病晚、发病率低、症状轻,遂采取紧急免疫,1月30日,利用转移因子稀释国产ILT活疫苗,以1.5羽份/只的剂量点眼接种,同时饮服麻杏石甘汤、薄荷桉叶油和强力霉素,前4 d病情加重,之后逐渐好转,2月8日完全痊愈。
1月31日,对未发病的9 200只青年鸡群实施紧急免疫,转移因子稀释ILT活疫苗,以1.2羽份/只的剂量点眼接种,除个别鸡出现免疫反应外,大群未发病。
8 讨 论
近年来ILT弱毒疫苗已在我国部分地区开始广泛使用,但由于ILT弱毒疫苗存在毒力返强风险,且弱毒疫苗株也能引起鸡群的潜伏感染,从而导致免疫鸡群和非免疫鸡群同样存在ILTV感染隐患。目前虽然不能确定“非典型”和“温和型”ILT病例是否由疫苗株的毒力返强所致[6],但“非典型”和“温和型”病例给ILT的诊断与防治确实增加了极大困难,尤其是“非典型”和“温和型”ILT病例的临床特征与传染性支气管炎、新城疫、禽流感等呼吸道疾病均极其相似,均表现为气喘、呼吸困难、咳嗽、啰音等,仅通过临床特征难以进行鉴别诊断,为避免误诊及漏诊的发生,需借助实验室方法进行确诊。ILTV实验室诊断方法主要有病毒分离、血清学和分子生物学方法,其中血清学方法检测ILTV的潜伏感染具有一定的滞后性,因ILTV可在鸡胚绒毛尿囊膜上形成明显的灰白色坏死灶或痘斑,可通过鸡胚绒毛尿囊膜接种途径分离病毒即可作出实验室诊断,而PCR方法作为常用的分子生物学诊断技术,具有操作简单、特异性强、敏感性高等优点,能够检测处于免疫耐受状态机体中的ILTV,可作为ILTV潜伏感染的实验室检测手段。本病例中采用PCR检测和病毒分离2种诊断方法综合确诊为ILTV感染,使诊断结果更加准确和可靠。
ILT是近几年老病新发疾病,结合目前我国养禽水平和生物安全现状,疫苗免疫接种和加强饲养管理仍是防控ILT的主要措施,养殖单位应根据自身情况选择合适的疫苗和免疫程序,确保鸡群具有一定的保护力。同时在日常养殖中应定期消毒,尽量采用全进全出的饲养模式,鸡舍要注意通风换气,保持舍内空气清新,无有害气体和灰尘,严谨饲喂发霉、变质饲料,使鸡群在良好、舒适的饲养环境中处于最佳的生长发育状态,可有效预防ILTV的感染。
针对ILT发病鸡群的治疗,紧急免疫仍然是最有效的措施,但是在实施之前必须做好鉴别诊断:有无低致病禽流感、新城疫、腺病毒等常发病毒病的混合感染,是否有白色念珠菌感染(嗉囊炎)、霉菌感染(肺、气囊结节、肌胃炎)、霉菌毒素感染(腺胃炎、肝炎)等引起的亚健康或免疫抑制,支原体、大肠杆菌、链球菌等条件性致病菌感染是否严重;临床诊断时至少解剖5只发病最早的鸡只,仔细剖检甄别,如有上述任何一种情况存在,宁可采取保守治疗措施,不可盲目紧急免疫,否则可能会造成巨大损失。本病例中的老鸡群死亡率达到30 %,与霉菌和霉菌毒素感染不无关系。笔者亲历9 500只320日龄鸡群,呼吸道病刚刚痊愈3天,又发生ILT,乡村兽医建议紧急接种进口ILT疫苗,结果导致3 000多只鸡死亡,不得已全群淘汰,损失惨重,这可能与低致病型禽流感有关。因此,望广大同仁临诊时要慎之又慎,不能确诊的要及时送检化验,争取最佳治疗时机。
参考文献:
[1] 王明辉,李菊梅,程思乐,等.1株鸡传染性喉气管炎病毒的分离和鉴定[J].畜牧与兽医,2015,47(7):96-98.
[2] 蒋露,李慧昕,韩宗玺,等.鸡传染性喉气管炎病毒LJS09株致病性的研究[J].中国预防兽医学报,2015,37(3):181-184.
[3] 李胜鹏,严专强,薛瑜,等.传染性喉气管炎病毒田间分离株重要基因的序列分析[J].中国兽医学报,2015,35(12):1 911-1 916.
[4] 忻效福,丁勇.鸡传染性喉气管炎老病新发防控[J].养殖与饲料,2017(2):70-71.
[5] 冷秋仙,王群义,刘红祥,等.鸡传染性喉气管炎流行新特点及防控措施[J].家禽科学,2016(2):44-45.
[6] 王瑞,殷冬冬,周晓雅,等.鸡传染性喉气管炎病毒安徽株AH-XY15的分离鉴定[J].中国兽医科学,2016,46(10):1287-1293.

