可吸收胶原膜的体内免疫反应评价
张林, 孙磊, 徐梦浛, 牛旭锋
(北京航空航天大学 生物与医学工程学院, 北京 100083)
引导组织再生术(Guided Tissue Regeneration, GTR)常用于牙周修复,主要是在伤口处使用一种闭塞膜形成一种物理屏障,阻止牙结缔组织向牙根面生长,为牙周膜、牙骨质和牙槽骨的修复提供空间和时间。GTR已经被提出作为根管治疗的辅助手段来促进骨再生[1],并且使用GTR以促进牙周再生已经取得了满意的结果[2],尤其在较严重的根尖周病变和贯穿病变的情况下。目前的研究发现,使用可吸收的屏障材料比不可吸收的材料,或者不使用屏障材料的效果要好[1]。理想的屏障材料需满足以下几个条件:生物相容的,能够作为屏障防止其他细胞类型向根面生长,允许营养物质和空气通过,允许组织整合进材料却又不影响其防止内皮细胞向下生长的功能,提供并维持一个靠近根面的空间,具有便于加工的结构等[1]。
胶原已经被用于骨修复,不仅因为它是骨基质的主要成分,具有良好的生物相容性和生物降解性,无细胞毒性,较低的免疫原性,易被加工成为不同的形式[3]。此外,胶原还是一种牙周膜成纤维细胞的趋化因子[4],能够阻挡内皮细胞的迁移,并且具有止血效应[5]。在胶原作为屏障材料的研究中都发现了牙再生的现象,并且5个月之后胶原全部降解[6]。可见,胶原作为引导膜治疗牙周病具有一定的优势,是一种较理想的材料,所以用于牙修复的胶原膜被广泛研究,但是其能否成为广泛应用的产品还得经过另一项检测,也就是免疫学评价,因为免疫原性是产生免疫毒性的主要原因。
众所周知,大多数胶原都来源于动物,因而提取的胶原中残留动物蛋白、DNA、细胞是难以避免的。有研究表明,胶原的结构、残留的非胶原蛋白和细胞、胶原的交联方式等都会对胶原的免疫原性产生影响[7]。因此,为了病人的安全和产品的广泛使用,进行免疫原性评价是十分必要的。
以往也有类似的研究,但是都不够深入全面,大多都只是停留在炎症的研究,而组织学检验和抗体检测是使用最广泛的评价方法[8-10]。在本实验中对猪来源的2种骨导膜进行了免疫学评价,希望为其广泛的应用于临床奠定基础。本实验制定了一套较完整的免疫原性检测方案,通过将其植入到BALB/c小鼠皮下,定期取样检测来分析胶原膜引起的免疫应答反应,检测指标涵盖了细胞免疫和体液免疫,局部免疫和系统免疫,免疫器官、免疫细胞和免疫分子,对胶原膜的临床应用具有重要意义。
1 实 验
1.1 动物与材料
动物实验已经获得了北京大学生物医学伦理委员会的批准,并严格按照其规定来饲养动物。本实验共需要20只6~8周,体重20 g左右的雌性BALB/c小鼠。实验共分为4组,每组5只,包括2个实验组(S1和S2,分别植入胶原膜1和胶原膜2),阳性对照组(PC,植入猪皮),阴性对照组(NC,只做手术,不植入)。材料由深圳兰度生物材料有限公司提供。
1.2 皮下植入
以50 mg/kg的比例腹腔注射w/v分数0.5%的戊巴比妥钠生理盐水溶液麻醉小鼠,待小鼠昏迷之后,选取一块背部脊柱两侧的皮肤,脱毛并用体积分数75%酒精消毒,用无菌手术剪剪开一个约1 cm的伤口并撑开皮肤,放入材料,缝合伤口(NC组不植入直接缝合)。总共在每只老鼠背部3个不同位置皮下植入各1次,一周一次。
1.3 取 样
1.3.1 取 血
分别在3次植入后第3天和第7天,分别剪去约1 cm长度的尾尖取血,用EP管收集,待血液分层之后,10 000 r/min 离心5 min,收集上清液于另一干净的EP管,标记,置于-20℃冰箱供检测抗体。到第14天时,直接摘除一只眼球取血,后面的处理同上。
1.3.2 脏器处理
第14天取血之后,拉颈处死小鼠,无菌环境下摘除脾和腋下淋巴结,浸泡于无菌磷酸盐缓冲液(Phosphate Buffer Solution, PBS)中。将脾脏研磨成单细胞悬液,800 r/min离心5 min,去上清,加入1 mL 红细胞裂解液,室温1 min,再加PBS至5 mL以终止反应,离心去上清,加入一定量 PBS悬浮细胞并混匀。取出少量稀释到适当倍数,进行细胞计数。淋巴结也经过类似的处理,只是不需要加红细胞裂解液,直接稀释计数。
1.3.3 局部组织处理
剪下最后一次植入部位的皮肤和材料,浸泡于w/v分数4%多聚甲醛中固定,供组织学分析。
1.4 细胞表型和流式细胞术
用于脾细胞表型识别和筛选的5种荧光单克隆抗体分别是anti-CD19 PE-Cy7、anti-TCR APC、 anti-CD4 FITC、anti-CD8 PerCP、anti-Ki67 PE。将单细胞悬液加入2 mL尖底离心管中,1 500 r/min离心5 min,弃上清液。加冷PBS 1 mL,离心洗涤,弃上清液。加入用PBS稀释的荧光素标记的抗体200 μL。用微量移液器轻轻吹打混匀,4℃或置冰上孵育0.5~1 h。离心弃上清液,加入冷PBS 1 mL,离心洗涤2次, 以除去未结合的多余抗体成分。向细胞中加入冷PBS 500 μL,吹打混匀,置流式管中,4℃避光保存,待测[11-12]。
1.5 细胞增殖
按每孔2×105的细胞数量取得细胞,离心去上清,加入1640培养基(含体积分数10%胎牛血清,体积分数1%双抗)200 μL,并按比例加入佛波酯(Phorbol-12-Myristate-13-Acetate, PMA)和离子霉素(Ionomycin, Iono)使之终浓度为100 ng/mL和1 000 ng/mL,混匀后加入96孔板,放入二氧化碳培养箱培养。48 h后用MTS试剂盒检测细胞增殖情况,具体来说,取出孔板,小心吸出上层培养液,每孔加20 μL MTS和80 μL 1640培养液混合液,培养箱孵育1 h,用酶标仪测490 nm处的吸光度。
1.6 酶联免疫吸附测试
用包被液以1∶1 000稀释包被抗体,每个孔100 μL,4℃过夜孵育。倒去包被液,每孔加入200 μL PBST(体积分数0.05% 吐温-20的PBS溶液)洗涤1 min,洗3次,用纱布包住拍干水分。加入200 μL PBSB(w/v分数1%牛血清白蛋白的PBS溶液)封闭液,室温放置2 h后,倾去液体,拍干水分。加入稀释好的样品(IgG 1∶100 000,IgM 1∶10 000)以及标准品(IgG 1∶25 000,IgM1∶5 000)100 μL,并设置空白对照,室温2 h。洗涤6次,拍干水分。辣根过氧化物酶标记的一抗用PBSB稀释1 000倍,每孔加100 μL,室温2 h,洗涤6次,拍干。加100 μL 3,3′,5,5′-四甲基联苯胺,黑暗孵育10 min(IgM)/20 min(IgG)后,加50 μL终止液(2 mol/L硫酸溶液),450 nm测吸光度[13]。
1.7 H&E
如文献[14]所述,皮肤组织经过w/v分数4%多聚甲醛固定之后,经过水洗,酒精梯度脱水,透明,石蜡包埋。石蜡块被切成3~5 μm的薄片,置于载玻片上,脱蜡之后再进行H&E染色,按标准步骤进行。
1.8 数据处理
所有数据都是由至少3个平行样本得出的,数据显示为mean±SD (均值±标准差),作图是采用GraphPad Prism软件,数据分析采用单因素方差分析,当*p<0.05,**p<0.01,***p<0.005时,差异被视为具有统计学意义,文中所有比较都是与NC组比。
2 结果与讨论
2.1 免疫器官及细胞计数
脾和淋巴结是淋巴细胞的主要栖息地,也是免疫反应发生的主要场所,因此观察脾和淋巴结的大小以及其中的免疫细胞数目能从一定程度上反映免疫反应的强弱。图1所示为3次免疫后第14天时小鼠的脾和淋巴结的形态,可以看到S1和S2组的脾和淋巴结与正常的脾和淋巴结对比,都没有表现出明显的大小变化,而PC组的脾出现了剧烈的膨大,比NC组的2倍还大,淋巴结也明显较大。脾细胞计数结果见图2(a),2个实验组的脾细胞数约为2×108,稍高于NC组的1×108,但差异无统计学意义。而PC组细胞数目也正如看到的急剧膨大的脾一样,远远高于NC组,约4.7×108。淋巴结细胞数目见图2(b),无论是PC组还是2个试验组,都与NC组的差异无统计意义,但是也能看到PC的淋巴结中的细胞数目(约8.5×107)高于其他组,约是NC组(约2.8×107)的3倍。无论是免疫器官还是其中的免疫细胞数目,结果都基本一致,即2种胶原膜对小鼠的免疫刺激都较小。

图1 脾和淋巴结形态Fig.1 Images of spleen and lymph nodes
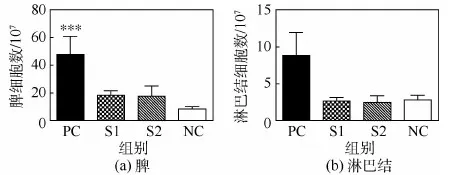
图2 脾和淋巴结的免疫细胞计数结果(***p<0.005)Fig.2 Immune cell population of spleen and lymph nodes (***p<0.005)
2.2 脾淋巴细胞表型
正常脾淋巴细胞中T细胞约占 40%,B细胞占60%,CD4/CD8=2∶1。CD4+T细胞与CD8+T细胞的比值变化能从一定程度上反应机体的免疫功能状态。本实验分析了脾淋巴细胞的表型,每个组有3个平行样本,规律类似,代表性流式图如图3所示,图中比例表示对应类别细胞占总测试细胞的比例。由图3可得到各组脾淋巴细胞中CD4+T细胞、CD8+T细胞和B细胞的含量百分比。对比试验组和对照组结果可以得出,S2组的脾细胞组成比例正常,与 NC 组无明显差异;S1组中,脾内 T细胞比例减少了约13%,B细胞比例轻微增多,但整体变化较PC组(T细胞比例与正常组比较下降了约22%,T、B细胞比例明显失衡)明显更小。且对比正常T细胞亚群CD4/CD8比例(约2.3)可知S1组和S2组CD4/CD8比例(分别为2.1和2.5)正常;而PC组CD4/CD8比偏低(约1.5)。由此实验结果可初步得出结论,胶原膜1的植入会引起小鼠轻微的免疫应答反应,但未影响其免疫系统的正常机能;而胶原膜2对小鼠的影响极小。
2.3 脾淋巴细胞活化
T细胞的活化通过2个亚群CD4+细胞和CD8+细胞反映,B细胞的活化则通过CD19+细胞反映。本实验对CD4+、CD8+和CD19+细胞表面的Ki67表达进行了检测,因为Ki67是与细胞活化和增殖相关的分子。每个组有3个平行样本,规律类似,代表性的流式分析图如图4所示。通过图4可以看出,各组别的CD4+和CD8+T细胞的活化状态无太大区别,但还是能看出PC组和S1组的CD4+T细胞活化相对较多,活化比例比NC组高出约5%;S1组和S2组的B细胞活化稍有增加,约为NC组(5.14%)的2倍,但S1(13.29%)多于S2(9.61%),PC组B细胞明显处于过度活跃状态中,活化率高达19.64%,大约是NC组的4倍。这些结果表明植入胶原膜引起了适当的免疫细胞激活,即小鼠对胶原膜作出了轻微免疫反应,对比2种胶原膜,胶原膜1引起的反应更明显。
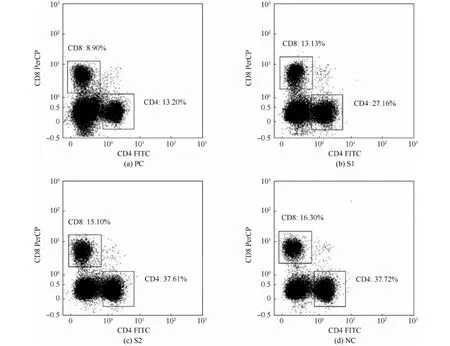
图3 流式细胞术分析脾淋巴细胞表型Fig.3 Splenic cells’ phenotype analysis by flow cytometry
2.4 淋巴细胞增殖
水溶性甲臜化合物(MTS)能被细胞线粒体中的脱氢酶还原为具有高度水溶性的有色甲臜产物,生成的甲臜物的数量与活细胞的数量成正比。用酶标仪在490 nm波长处测定其光吸收值,可间接反映活细胞数量。淋巴细胞的增殖能力代表了其向淋巴母细胞的转化情况,而淋巴母细胞的转化率可以反映免疫反应水平。本实验采用PMA和Iono体外刺激细胞增殖来检测细胞的活化情况,结果如图5所示,图中“**”表示PC组和NC组的吸光度差异具有高度的统计学意义。植入胶原膜第14天之后的老鼠的脾细胞和淋巴结细胞,均没有像PC组细胞那样表现出显著高于正常小鼠细胞的增殖能力,吸光度都在0.5左右,与正常小鼠的差异无统计学意义,也就是说明材料没有刺激大量的免疫细胞活化,即免疫反应微弱。
2.5 血清中抗体水平
抗体是由浆细胞分泌的用来鉴别和中和外来抗原的物质,在体液免疫中起着重要的作用。本实验检测了血清中的IgM和IgG,二者分别在初次免疫应答和再次免疫应答中起作用,因此IgG产生较晚。酶联免疫吸附测试结果显示各组中IgM浓度没有显著差异(本文未给出)。对此分析这可能是因为在3次植入免疫中,第1次植入时机体免疫主要为初次免疫应答,IgM水平较高;随着后续增强免疫的进行,机体免疫应答逐渐以再次免疫应答为主,初次免疫应答的水平逐渐减弱,故在3次免疫后第3天检测时机体初次应答水平已经处于较弱阶段,因此IgM浓度整体水平较低,故4组小鼠组间无明显差异。IgG浓度的检测结果如图6所示,S1组的IgG浓度一直处于上升趋势,但曲线斜率明显小于PC组,S1组第14天血清中的IgG浓度(约12 mg/mL)约是NC组(约5.5 mg/mL)的2倍;而S2组的IgG浓度在第7天出现了轻微地上升,从4 mg/mL到8 mg/mL,第14天时与第7天差别不大。总体来说,2个实验组与NC组的IgG浓度变化差异不大,尤其是S2组。Liu等[15]也有类似的发现,将猪源Ⅰ型胶原膜作为角膜原位移植到BALB/c小鼠后,在第14天的血清中也检测到了IgG,并且浓度随时间升高。而Patino等[16]的研究表明在Wistar大鼠的血清中没有检测到针对猪源胶原膜的抗体,这种差异可能是由于动物的种类不同而导致的。由此可见,本实验中的猪来源的胶原膜1有可能对小鼠产生了一定的刺激作用,以至于小鼠体内产生了适当的IgG抗体来中和这种外来抗原,而胶原膜2对小鼠的刺激是不明显的。
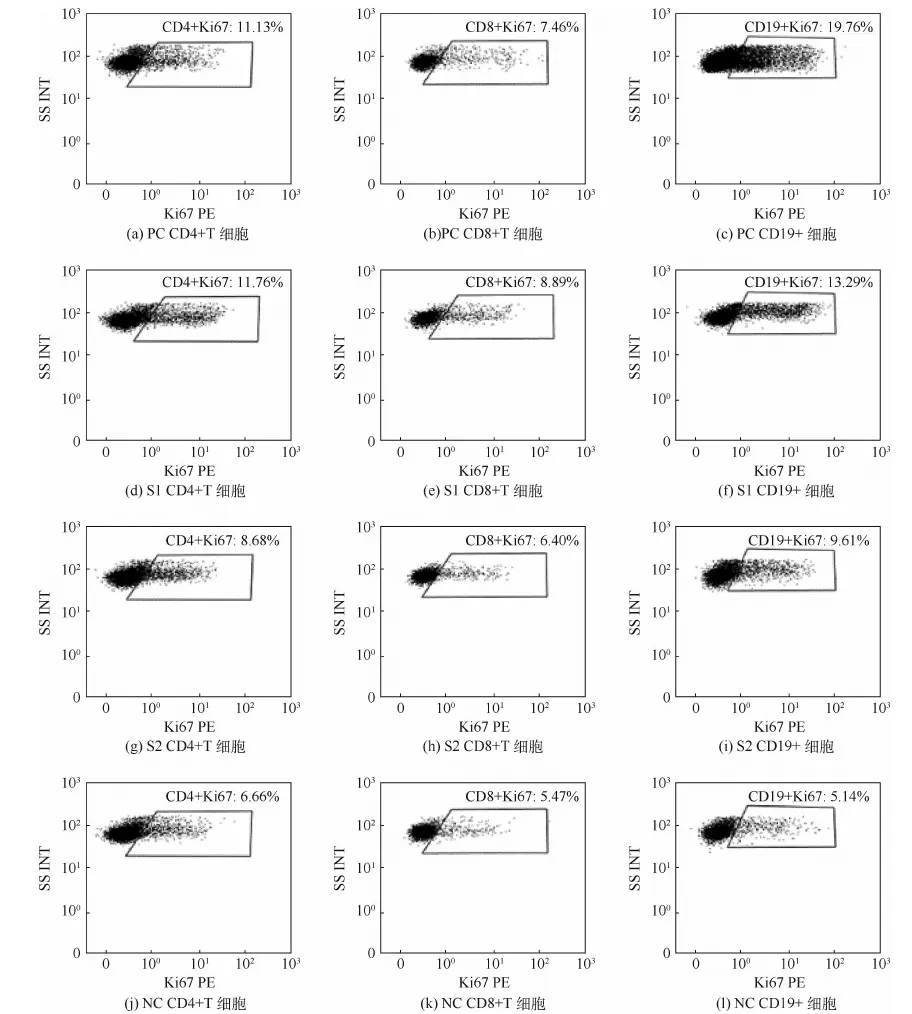
图4 CD4+T细胞、CD8+T细胞和CD19+细胞的Ki67表达情况Fig.4 Ki67 expression of CD4+T lymphocytes,CD8+T lymphocytes and CD19+ lymphocytes
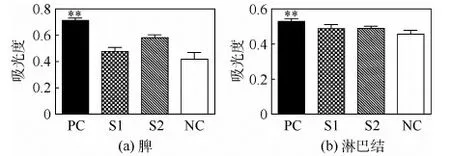
图5 脾和淋巴结细胞体外增殖情况 (**p<0.01)Fig.5 Proliferation in vitro of splenic cells and lymph nodes cells (**p<0.01)
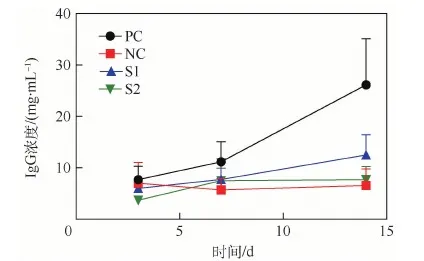
图6 血清中IgG浓度随时间的变化Fig.6 Variation of concentration of IgG in serum with time
2.6 细胞浸润
以上的实验都是针对系统性的免疫反应,细胞浸润测试则是用来评价局部免疫反应。局部炎症反应的一个特征是炎性细胞浸润,因此在本实验中笔者采用H&E染色来检查植入局部的炎症发生情况。代表性的H&E染色如图7所示,M为植入的材料,右图是左图的局部放大。植入之后第14天,在PC组的组织中,大量的细胞聚集在整个材料之中,也就是说炎症反应剧烈;与未植入的皮肤相比,在胶原膜1和胶原膜2的周围有稍多的细胞浸润,并且胶原膜1周围的细胞数量多于胶原膜2,但都只是围绕在材料周围。这种现象与以往的研究结果一致,Liu等[15]的研究在植入后第12天也发现细胞浸润现象只发生在胶原材料周围,而没有侵入其中。猜测可能是由于胶原本身的免疫原性比较低,以至于浸润细胞少且细胞浸润的速度慢。由此可见这2种材料会引起轻微的局部炎症反应,并且胶原膜1引起的炎症稍强于胶原膜2。
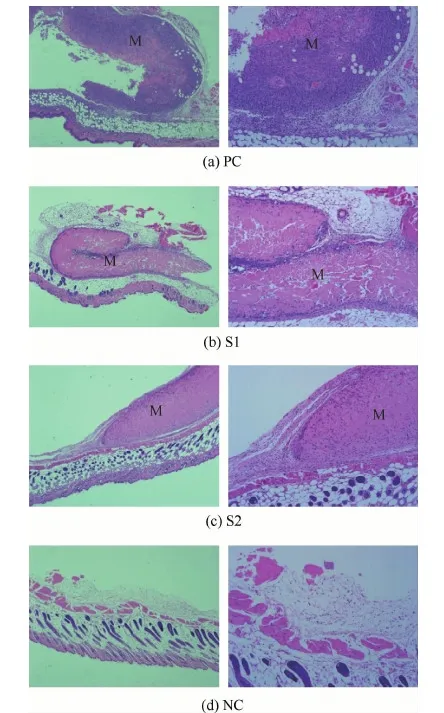
图7 植入部位H&E染色Fig.7 H&E staining of implantation sites
本文实验中的2种胶原膜唯一的差别在于胶原膜1是经过了过氧化氢灭菌处理,而胶原膜2没有。过氧化氢是一种强氧化剂,其灭活微生物的原理是通过解离高活性的羟基,攻击破坏微生物的细胞壁、DNA、脂类以及蛋白质等,对包膜病毒作用尤为明显,生成产物只有水和氧气,广泛应用于生物医药领域[17-18]。本实验中几乎所有的结果都表明胶原膜1在BALB/c小鼠中引起的免疫反应明显强于胶原膜2,推测主要原因是过氧化氢破坏了胶原的结构,使之抗原决定簇更多地暴露,从而增强了其免疫原性。有研究结果表明[19],当过氧化氢浓度低于2%(体积分数)时,主要以氧化基团与胶原的交联为主,而当过氧化氢浓度达到3%时,氧化能力变强,以至于破坏了胶原的结构,此时的作用以降解为主。
3 结 论
1) 本文提出了一套免疫原性检测方案,可以用于检测所有可植入生物材料的免疫原性,能为生物医用材料的生物安全性检测提供参考。
2) 胶原膜1在BALB/c小鼠中引起了轻微的系统性免疫反应,包括脾细胞数目和活化以及IgG抗体分泌增多,但是与未植入材料的老鼠无具有统计学意义的差异。另外,胶原膜1在植入局部引起了一定的细胞浸润,即炎症。
3) 胶原膜2在BALB/c小鼠中也引起了轻微的系统性免疫反应,主要是脾细胞数目增多,和B细胞活化增多,但是程度比胶原膜1要轻,还发生了反应程度比胶原膜1稍轻的局部炎症。
4) 2种胶原膜在BALB/c小鼠中引起的免疫反应较弱,比NC组稍强,远远不及PC组,因此,这2种胶原膜,尤其是胶原膜2,可被认为是安全可靠的骨修复材料,能被应用于临床试验。
致谢感谢北京大学医学部王巍老师在实验中给予的指导与帮助,感谢谷歌生物科技有限公司给予技术支持。
参考文献 (References)
[1] TSESIS I,ROSEN E,TAMSE A,et al.Effect of guided tissue regeneration on the outcome of surgical endodontic treatment:A systematic review and meta-analysis[J].Journal of Endodontics,2011,37(8):1039-1045.
[2] LEKOVIC V,CAMARGO P M,WEINLAENDER M,et al.Effectiveness of a combination of platelet-rich plasma,bovine porous bone mineral and guided tissue regeneration in the treatment of mandibular grade Ⅱmolar furcations in humans[J].Journal of Clinical Periodontology,2003,30(8):746-751.
[3] SUMITA Y,HONDA M J,OHARA T,et al.Performance of collagen sponge as a 3-D scaffold for tooth-tissue engineering[J].Biomaterials,2006,27(17):3238-3248.
[4] LU H K,LEE S Y,LIN F P.Elastic modulus,permeation time and swelling ratio of a new porcine dermal collagen membrane[J].Journal of Periodontal Research,1998,33(5):243-248.
[5] PITARU S,TAL H,SOLDINGER M,et al.Collagen membranes prevent apical migration of epithelium and support new connective tissue attachment during periodontal wound healing in dogs[J].Journal of Periodontal Research,1989,24(4):247-253.
[6] SCULEAN A,NIKOLIDAKIS D,NIKOU G,et al.Biomaterials for promoting periodontal regeneration in human intrabony defects:A systematic review[J].Periodontol 2000,2015,68(1):182-216.
[7] LYNN A K,YANNAS I V,BONFIELD W.Antigenicity and immunogenicity of collagen[J].Journal of Biomedical Materials Research Part B: Applied Biomaterials,2004,71(2):343-354.
[8] PENG Y Y,GLATTAUER V,RAMSHAW J A,et al.Evaluation of the immunogenicity and cell compatibility of avian collagen for biomedical applications[J].Journal of Biomedical Materials Research Part A,2010,93(4):1235-1244.
[9] ZIV O,AVTALION R R,MARGEL S.Immunogenicity of bioactive magnetic nanoparticles:Natural and acquired antibodies[J].Journal of Biomedical Materials Research Part A,2008,85(4):1011-1021.
[10] DILGIMEN A S,MUSTAFAEVA Z,DEMCHENKO M,et al.Water-soluble covalent conjugates of bovine serum albumin with anionic poly(n-isopropyl-acrylamide) and their immunogenicity[J].Biomaterials,2001,22(17):2383-2392.
[11] KREISER S,ECKHARDT J,KUHNT C,et al.Murine cd83-positive T cells mediate suppressor functions in vitro and in vivo[J].Immunobiology,2015,220(2):270-279.
[12] O’DONNELL H,PHAM O H,LI L X,et al.Toll-like receptor and inflammasome signals converge to amplify the innate bactericidal capacity of t helper 1 cells[J].Immunity,2014,40(2):213-224.
[13] WELCH R J,LITWIN C M.A comparison of brucella igg and igm elisa assays with agglutination methodology[J].Journal of Clinical Laboratory Analysis,2010,24(3):160-162.
[14] LIU H,WISE S G,RNJAK-KOVACINA J,et al.Biocompatibility of silk-tropoelastin protein polymers[J].Biomaterials,2014,35(19):5138-5147.
[15] LIU L,KUFFOVA L,GRIFFITH M,et al.Immunological responses in mice to full-thickness corneal grafts engineered from porcine collagen[J].Biomaterials,2007,28(26):3807-3814.
[16] PATINO M G,NEIDERS M E,ANDREANA S,et al.Cellular inflammatory response to porcine collagen membranes[J].Journal of Periodontal Research,2003,38(5):458-464.
[17] 方哲翔,王建华,袁平,等.医用胶原修复膜病毒灭活/去除工艺的验证和评价[J].中国生物制品学杂志,2016,29(12):1341-1345.
FANG Z X,WANG J H,YUAN P,et al.Validation and evaluation of inactivation/removal of medical collagen repair membrane[J].Chinese Journal of Biologicals,2016,29(12):1341-1345(in Chinese).
[18] 王朋.过氧化氢消毒灭菌技术介绍[J].化工与医药工程,2012,33(6):51-53.
WANG P.Introduction of sterilization technology with vaporized hydroge peroxide[J].Chemical and Pharmaceutical Engineering, 2012,33(6):51-53(in Chinese).
[19] 龚居霞,刘新华,但卫华,等.过氧化氢处理对Ⅰ型胶原结构和性能的影响[J].中国皮革,2015(1):10-13.
GONG J X,LIU X H,DAN W H,et al.Effects of hydrogen peroxide treatment on structure and performance of type Ⅰ collagen[J].China Leather,2015(1):10-13(in Chinese).

