长期施肥下我国农田土壤微生物及氨氧化菌研究进展
王慧颖,徐明岗,马 想,段英华
(中国农业科学院农业资源与农业区划研究所,耕地培育技术国家工程实验室,北京 100081)
土壤是生态系统的重要组成部分,土壤肥力是土壤的本质特性,是农业生产的基础。施肥是提高土壤肥力、维持作物高产稳产,以保障粮食安全和农业可持续发展的重要农业生产措施[1]。化肥中含有大量的营养元素,化肥的施用对于提高土壤肥力,促进粮食增产至关重要[2]。但在过去的几十年里,化肥尤其含氮化肥的大量施用带来的土壤退化、生物多样性下降和环境污染等问题亟待解决[3]。作为养分更均衡的有机肥,它所释放的稳定、持久养分更利于作物的生长,然而有机肥中的养分释放速度较缓慢,不能及时满足作物生长需求。很多研究表明,有机肥与化肥的配施不仅有利于提高和稳定土壤肥力,且可增产稳产[4]。然而,单施化肥或有机无机肥配施下土壤肥力的演变规律及机制,尤其是生物学机制尚不清楚。土壤肥力的演变,是一个相对缓慢的过程,通过长期定位试验对土壤进行系统的观察和监测是了解土壤肥力演变规律并探索其机制的重要和必需途径[5-6]。20世纪80年代以来,中国科研院所和农业大专院校陆续在不同农业生态区建立了一批农田土壤肥料长期试验,以研究不同类型土壤和不同施肥制度条件下土壤肥力长期演变规律、肥料利用率及肥料的农学效应和生态环境效应、不同水热梯度带农田土壤肥力质量和环境质量的演变规律等,这些土壤长期定位试验对于研究不同施肥管理措施对农田土壤养分循环的影响及其环境效应等发挥了重要作用[7]。
作为应用最为广泛的管理方式,施肥通过改变土壤养分状况及微生物的群落结构和功能,从而影响土壤质量、生物肥力、生产力以及农田生态系统的稳定性[8-9]。土壤中存在大量微生物,它们进行着一系列复杂的生物化学反应,是土壤养分循环的主要动力和植物有效养分的储备库[10-11]。土壤微生物及其控制的生物过程通过影响土壤结构、有机物的组成以及碳、氮、磷、钾等元素的物质循环,从而对维持农田生态系统的长期稳定具有十分重要作用[12-13]。农田土壤中,一些重要的微生物参数如微生物数量、微生物碳氮量、酶活性、细菌真菌数量比、多样性指数及群落结构等能够作为判断土壤肥力和健康状况的指标[14-15]。微生物群落对不同施肥处理的响应会在时间尺度上产生差异,年际变化对微生物的影响不可忽略,很多驱动系统响应的过程也可能随时间减弱或增强[16-17],因此研究长期定位施肥下的土壤微生物对农田生态系统的影响及其驱动因素具有重要意义。
如图1所示,土壤养分与微生物是相互作用的。一方面,土壤养分作用于微生物:长期施肥改变土壤养分含量,进而导致微生物的同化过程、代谢活性和群落组成发生变化[18-20];同时土壤养分作为土壤酶的代谢底物,其含量的变化也会影响酶的活性[21-23]。另一方面,微生物也能作用于土壤养分:由于土壤微生物活性的改变引起的自身代谢、死亡和沉积等作用变化,进而影响养分的积累[24-25];而且,不同的微生物群落组成会引起微生物群落所分泌的酶及微生物生物量发生变化,从而影响土壤养分循环[26-27],其中功能微生物在养分循环中扮演重要角色。本文梳理了基于我国农田长期定位试验网络的大量研究工作中土壤微生物学方面的研究进展,包括土壤微生物生物量和酶活性、真菌细菌数量比例、细菌群落结构和多样性,并重点分析了参与土壤氮循环关键环节—氨氧化过程的氨氧化菌的研究现状,讨论了施肥对土壤微生物影响机制的研究现状与不足,以期为土壤生物学的未来研究方向提供参考依据,为我国农田土壤肥力的提升以及化肥和有机肥的合理施用提供理论支撑。
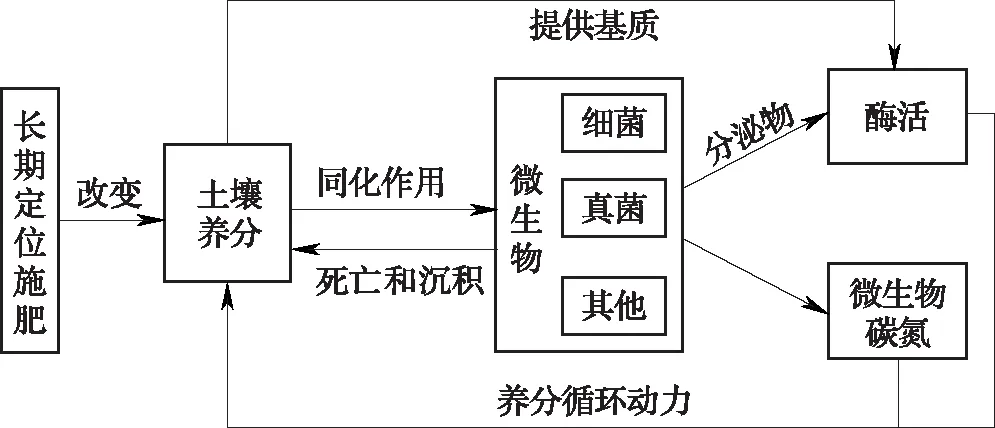
图1 土壤微生物对土壤养分变化的响应及反馈过程
1 长期施肥对土壤微生物量及酶活的影响
1.1 微生物数量/生物量
土壤中的微生物主要包括细菌和真菌等类群,它们在土壤肥力的形成和养分的吸收转化过程中起着重要作用[28-29]。土壤中微生物的数量能够指示土壤养分的转化能力和肥力高低。测定土壤微生物量的方法有许多,由最初的平板计数、之后的BIOLOGY微平板计数、磷脂脂肪酸法(PLFA),到目前广泛应用的荧光定量PCR等分子学研究方法均能表示土壤微生物的数量[30]。众多研究表明,施肥可显著影响土壤中大多数微生物的生长发育[8-10]。通常认为,施用化肥能提高土壤养分含量,进而满足微生物生长的养分需求[31]。然而,在对长期施肥下的土壤微生物数量进行研究时发现,与不施化肥相比,施用化肥会显著降低土壤微生物数量[32-33]。这可能是因为长期施用化肥可引起土壤酸化,而土壤pH的降低也是微生物数量减少的重要原因之一。有机肥的施用不仅能缓解由化肥引起的土壤酸化问题,而且可直接增加根系生物量及根系分泌物,为微生物繁衍提供大量的碳源,因此长期施用有机肥或有机肥与化肥的合理配施能够显著提高微生物的数量[34-36]。
广义上的土壤微生物量包括土壤微生物量碳、氮、磷和硫,其中土壤微生物生物量碳(SMBC)是土壤有机质中最为活跃的部分,可以敏感地反映出土壤有机碳的变化,是土壤生物学评价的重要指标之一[30];微生物生物量氮(SMBN)是土壤活性氮的重要储备库,是植物氮营养的重要来源[37-38],因此,目前对微生物量的研究一般集中在微生物生物量碳和微生物生物量氮方面。与不施肥相比,均衡施用化肥能显著提高SMBN[34,39-43],这可能是因为施肥后作物产量的提高使得作物根茬数增加,从而为微生物提供了较多的碳源,而且化肥能直接为微生物提供大量氮源,促进微生物对氮素的同化利用及生长。Geisseler等[43]对全球64个长期施肥试验点的107个土壤样品进行分析时发现,所有化肥处理均能提高微生物生物量,他认为这是化肥处理提高了土壤中有效养分含量,进而提高了微生物活性的结果。也有研究表明,长期施用化肥引起的土壤酸化及土壤碳氮比降低等问题抑制了微生物活性,不利于土壤微生物量的累积[41,44-45]。不一致的结论可能是由于所研究的土壤类型不同,而不同类型土壤的养分和pH值对化肥的响应不同,从而导致微生物生物量对长期施用化肥的响应不一致。尽管微生物生物量对化肥的响应不尽相同,但施用有机肥可使之提高这一结论在各种土壤类型中均已得到证实[40-43]。与不施有机肥相比,长期施用有机肥后,红壤的微生物生物量碳、氮分别显著提高了25%和4%[42];潮土的微生物生物量碳、氮分别增加了36%和130%[46];黑土的微生物生物量碳提高了45.7%~75.2%,微生物生物量氮提高了218%~260%[47]。这是由于有机肥不仅为微生物提供了能量来源,而且各种养分资源较为丰富且均匀,可促使养分在土壤中积累进而更利于微生物的代谢。
1.2 真菌和细菌数量比例
土壤有机物不仅是植物所需养分的重要来源,同时能明显改善土壤肥力,土壤中各种来源和形态的有机物最终都必须经过微生物分解矿化才能重新进入土壤生物地球化学循环,因此微生物对有机质的分解在农田生态系统中发挥着巨大作用。土壤有机物的降解途径分为真菌途径和细菌途径两大类,其中真菌主要分解难分解、具有高碳氮比的有机物,此类有机物的营养循环时间较长,如秸秆、几丁质和木质素等;细菌主要分解易被分解、有较高的碳周转和营养循环速度的有机物[48]。土壤真菌/细菌数量比例(F/B)可作为反映土壤肥力和健康状况的指标,有研究指出较高的F/B值能够表征微生物对周围环境的积极响应,代表农田生态系统具有较高的可持续性[49-50]。
长期施用有机肥后,F/B值在不同类型土壤中的结果不同。长期施用有机肥后,红壤的F/B值显著增加[51]。其原因可能为:(1)细菌的碳氮比较低(为3~5),而真菌的碳氮比却高达11~13,有机肥的高碳氮比及其难分解性能刺激真菌的生长[48];(2)有机肥中较高的含磷量更利于真菌生长,且与真菌相比,细菌对磷的响应较弱,因此,有机肥的施用导致F/B值升高[52]。然而,长期施用有机肥的潮土和黑土中,F/B值并未发生显著变化[21],甚至从15显著降低至5[50],其原因可能为:(1)有机肥在潮土中既促进了真菌的生长代谢,又有利于细菌中革兰氏阴性菌的生长(革兰氏阳性菌数量无显著变化),因此F/B无显著变化[21];(2)有学者认为,施用有机肥利于黑土和潮土中有机质的矿化和养分的循环,且细菌和真菌分别为r-策略的富营养菌和K-策略的贫营养菌,因此有机肥更利于细菌的生长繁殖,导致土壤F/B值降低;(3)研究表明在pH值<7范围内,细菌相对丰度与土壤pH值呈正比,而真菌的丰度对pH的变化并不敏感[43]。有机肥的施用通常会提高土壤pH值,进而促进细菌生长[4],所以有机肥处理下的F/B显著下降。
1.3 酶活性
土壤酶是具有加速土壤生化反应速率功能的蛋白质,酶活性可反映土壤养分(碳、氮、磷等)转化能力和土壤微生物活性[53]。王灿等[54]认为土壤酶活性与施肥方式密切相关,其与作物产量之间的相关性优于土壤养分和作物产量的相关性,可作为评价土壤肥力对施肥处理响应的重要指标。近年来,国际上对土壤质量越来越关注,对土壤酶研究的深度和广度不断增加[55]。脲酶、蔗糖酶、磷酸酶和过氧化氢酶为土壤中与碳、氮、磷养分循环及氧化还原相关的主要酶类。表1系统整理了与不施肥相比,施用化肥和/或有机肥后,这4种酶的变化及其主要影响因素。
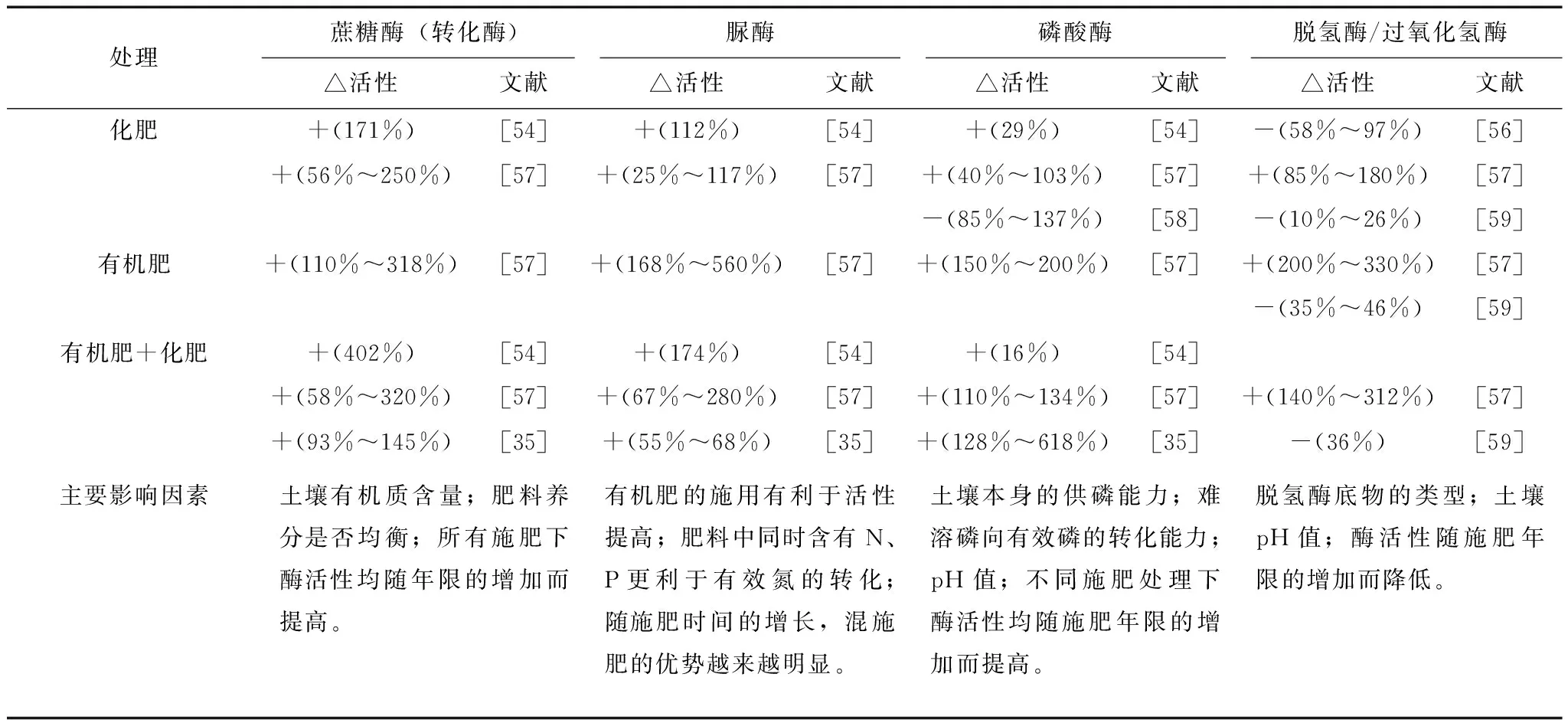
表1 长期不同施肥对土壤酶活性的影响及其主要影响因素
注:△活性代表不同施肥处理与CK相比对土壤酶活性的提高或降低程度。其值为正代表提高程度,为负代表降低程度。
蔗糖酶也被称为转化酶,能裂解二糖分子中果糖基的β-葡萄糖苷碳原子处的键,使蔗糖水解为葡萄糖和果糖,可反映土壤有机碳积累、分解与转化的规律,是评价土壤熟化程度和肥力水平的指标[55-56]。一般情况下,土壤肥力越高,蔗糖酶活性越高。由表1可见,化肥和有机肥处理均能显著提高蔗糖酶的活性[35,54,57],其中有机肥最高可提高蔗糖酶活性至3.2倍[57]。化肥之所以能提高土壤蔗糖酶活性,是因为与不施肥相比,肥料中的养分施入后更利于土壤养分比例的调节,为有机质转化提供有利环境[55]。有机肥提高蔗糖酶活性的原因是其提供了大量的转化酶的诱导物—有机质,为蔗糖酶提供了更丰富的酶促机制,从而为微生物活动和酶活性的提高创造了有利条件[57]。
脲酶是指示土壤氮循环过程的重要酶类,可将有机物中的碳-氮键水解生成氨、二氧化碳和水,促进有机氮向矿质氮的转化[55],其活性与土壤的微生物数量、有机质含量和全氮含量呈正相关。由表1可见,施用不同肥料均可不同程度地提高土壤脲酶活性,其中施用化肥能提高25%~117%,化肥配施有机肥可提高67%~280%[57]。另外,对长期施肥下封丘潮土脲酶活性的分析发现,其年际变化规律在不同施肥处理间亦不同,施用化肥处理的土壤脲酶活性随时间没有明显变化,而有机肥处理下土壤脲酶活性随施肥年份的增加显著提高[57]。
磷酸酶能够催化土壤中磷酸单酯和磷酸二酯水解,指示有机磷向有效磷的转化过程。磷酸酶是一种适应性酶,土壤含磷量的差异会导致不同土壤类型下的磷酸酶活性对施肥的响应不同[58]。如,由于不施肥的北京褐潮土的供磷能力较低,有机磷需矿化才能满足作物所需,而有机磷矿化则会刺激作物根系分泌较多磷酸酶,因此在不施肥的褐潮土中磷酸酶含量较高,反而由于长期施用化肥处理的土壤含磷量能满足作物所需,故无需分泌较多磷酸酶,因此其磷酸酶活性降低[59]。相反,在不施肥情况下,河南封丘潮土中的磷足够满足作物需求,长期施用化肥使其含磷量更高,此时需要更多的磷酸酶将磷进行转化,故长期施用化肥的潮土的磷酸酶提高了40%~103%(表1)。一般来说,磷酸酶又被分为酸性磷酸酶和碱性磷酸酶,这两种酶的活性受土壤pH的显著影响。王灿等[54]在对湖北水稻土的酸性磷酸酶和碱性磷酸酶研究时发现,由于此试验区土壤偏碱性,故所有施肥处理的碱性磷酸酶的活性显著高于酸性磷酸酶活性;他还发现,土壤pH的降低使得酸性磷酸酶含量提高了98%,而碱性磷酸酶含量降低了16%。
脱氢酶属于氧化还原酶体系,反应中称被氧化的底物为氢供体或电子供体[60-61]。当被氧化的底物为过氧化氢时,也可将之称为过氧化氢酶。研究认为,细菌、真菌以及植物根系所分泌的过氧化氢会对植物以及土壤产生毒害,过氧化氢酶的存在能减弱过氧化氢的毒害作用[61]。不同类型土壤的脱氢酶活性不同,其原因主要有两点:一、脱氢酶活性与土壤通气性和土壤质地相关,一般认为,砂砾含量较高、通气性较好的土壤利于其氧化还原电位(Eh)和自身氧化能力的提高,但脱氢酶底物也会因此减少,故此时会降低脱氢酶的活性;二、不同类型土壤的脱氢酶底物含量的差异较大,脱氢酶活性与土壤中的底物含量呈正比。同时,脱氢酶活性在不同土壤类型下对施肥处理的响应也不一致。对于部分类型土壤,脱氢酶和过氧化氢酶活性在长期有机肥或/和化肥施用下显著高于不施肥处理下的活性(表1)[57,60];但对于北京潮土,长期施肥导致过氧化氢酶活性降低10%~97%[56,59],这可能由于未施肥的潮土中含有大量电子供体,而施肥后电子供体减少所致。大量研究表明土壤pH值也是影响过氧化氢酶活性的重要因子。Sun等[62]在对红壤、紫砂壤以及灰漠土中的过氧化氢酶进行研究时发现,长期化肥处理的灰漠土及红壤pH值的降低导致过氧化氢酶活性被抑制,而pH值无显著变化的紫砂壤的过氧化氢酶活性并无明显改变。这可能是由于土壤pH值下降会刺激还原反应的进行,因此过氧化氢酶活性下降[63]。
2 长期施肥对土壤细菌群落的影响
2.1 细菌数量
细菌约占土壤微生物数量的70%~90%,它不但参与土壤有机物与无机物的转化,而且在维持整个农田生态系统的稳定中发挥重要作用[64]。大量研究表明土壤中的细菌数量主要受pH值及碳、氮、磷等养分含量的影响[19]。其中,长期施用氮肥不仅可显著降低土壤pH值,也会造成土壤养分不均衡,因此显著降低土壤中细菌的数量[65]。磷也是影响细菌生长的重要因素,与无磷处理相比,含磷处理的红壤中细菌数量显著提高[15]。长期施用养分均衡的化肥能满足细菌的养分需求,会显著提高细菌数量[11,15,65]。长期有机肥化肥配施不仅有利于土壤有机碳的累积,且可使土壤pH值保持在7左右,故此时的细菌数量显著高于不施肥和化肥处理[32-34,66]。另外,由于有机肥中含有大量能直接供细菌生长的养分和能源,因此配施肥中有机肥所占比例也能显著影响细菌的含量[51],如化肥配施60%有机肥的处理下土壤细菌数量显著高于配施30%有机肥的处理[33]。
2.2 细菌多样性
在农田生态系统中,细菌的多样性与土壤质量、作物产量及农田生态系统的稳定性密切相关[12]。有学者认为由于土壤环境的改变导致细菌对环境的适应性发生了变化,细菌多样性也因此受到影响[26],长期不同施肥处理导致土壤理化性状等发生了显著变化,进而影响了细菌的多样性。一般认为,均衡施肥为细菌提供的均衡养分能满足各类细菌的生长和代谢,故多样性显著提高[67]。而由于长期只施氮肥会促进与氮循环相关的细菌的生长代谢,此时其它养分的不足会抑制对这些养分需求量较大的细菌的生长,因此细菌多样性指数明显降低[8,64,67]。一般认为,有机物料比化肥更能为微生物提供全面且充足的营养,对大多数微生物生长代谢具有良好的刺激作用,使得细菌的均匀度和多样性指数更高[32]。然而,Ge等[18]对封丘砂壤的研究发现,长期施用有机肥虽能提高细菌多样性指数,但却显著降低了细菌均匀度指数,这可能是因为不同土壤类型下的细菌种类对有机肥的利用率不同,封丘砂壤中的不同种类细菌对有机肥的利用率差异较大,导致其细菌均匀度指数下降。也有学者认为微生物多样性指数提高的原因一方面是只增加了微生物的种类,另一方面是只丰富了某一细菌种群的多样性[18,68],由此可见,Ge等[18]的分析结果中多样性指数增加而均匀度指数降低的原因属于后者。
除土壤养分含量外,细菌的多样性与土壤pH值的相关性更高。一般情况下,土壤pH值在7左右时,适合大多数细菌的生长,多样性指数也最高。众多研究结果表明化肥处理会显著降低细菌的群落多样性[69],这可能就是由于化肥处理引起了土壤酸化,绝大部分细菌的活性也因此被抑制所致。施用有机肥能中和含氮化肥导致的土壤酸化,进而提高细菌的多样性[64]。
2.3 细菌群落结构
生态对策也称为生活史对策,是指生物在进化过程中对其某些特定的生态压力所采取的生活史或行为模式,土壤中不同微生物的r-和K-选择连续体作为土壤生态对策,分别用富营养类群(Copitroph)和贫营养类群(Oligotraph)描述r-选择者和K-选择者[70]。其中富营养类群能够有效消耗土壤易降解碳库,对养分要求较高,生长速率较高,主要包括变形杆菌(Proteobacteria)中的大部分类群和放线菌(Actinobacteria)、拟杆菌(Bacteroidetes)等;而贫营养类群可消耗难降解的有机碳库,虽生长速率较慢,但是却具有较高的养分亲和力,主要包括酸杆菌(Acidobacteria)、绿弯菌(Chloroflexi)等[71-72]。研究表明,由于富营养类群和贫营养类群不同的生长特性,富营养类群对土壤氮素的需求量比贫营养类群大,因此富营养类群需要生活在碳氮比较低的富营养环境中[71-72]。长期定位施肥可通过不断改变微生物所需的碳氮资源,从而显著改变细菌群落组成[73],富营养细菌类群和贫营养细菌类群也会随之发生显著变化,因此其相对丰度可作为指示和预测土壤养分的微生物指标之一。通过研究长期施肥下土壤微生物群落结构的变化及其驱动因子,能够为如何人为调控土壤微生物群落结构、获得高产稳产的微生物区系提供理论依据。
有关长期不施肥、施用化肥和有机肥对土壤细菌群落结构影响的研究,我国近些年在红壤、潮土和黑土等典型农田土壤中取得了突破性的进展。图2总结了长期不同施肥下,8种主要细菌门类在哈尔滨黑土(HEB)、郑州潮土(ZZ)、常熟黏土(CS)和祁阳红壤(QY)中的变化。不同肥料能通过改变土壤中的碳氮养分驱动细菌群落向富营养型或贫营养型转变。在ZZ、CS和QY 3种土壤中施用有机肥(M或NPKM处理)均能提高富营养类群Bacteriodetes和Proteobacteria的丰度,同时根据Fierer等[74]所提出的富营养类群集中在有机碳矿化速率较快的环境中的理论,推断长期施用有机肥提高了土壤中有机碳的矿化速率,有利于改善土壤肥力。而在这3种类型土壤中,贫营养类群Acidobacteria对有机肥的响应不完全一致:ZZ中显著提高、CS中无显著变化、QY中显著降低,这可能由于供贫营养类群利用的难降解有机碳含量在不同土壤类型中的含量有所差异。Fierer等[74]发现添加氮源同时利于农田和草地两个生态系统中富营养类群Proteobacteria和Bacteriodetes的生长,不利于贫营养类群Acidobacteria的生长。然而,我国学者的研究结果与Fierer等[74]的结果不尽相同:Bacteriodetes的丰度在ZZ、CS和QY中显著提高,而在HEB中无显著变化;Proteobacteria在HEB和ZZ土壤中显著提高,在另两个土壤中无显著变化;Acidobacteria在HEB和CS中被显著降低,在QY中被提高,而在ZZ中无显著变化。由此可见,农田生态系统中的细菌群落对化学氮肥的响应会因土壤类型不同而产生差异。
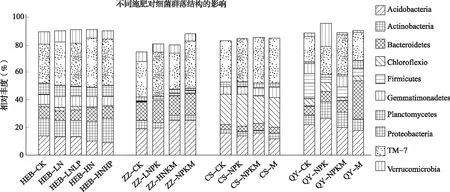
图2 长期不同施肥处理下主要细菌门类的丰度
注:HEB、ZZ、CS和QY分别代表哈尔滨黑土、郑州潮土、常熟黏土和祁阳红壤。CK为不施肥处理;N、NP和NPK为化肥处理,其中LN、LNHP和LNPK代表低量化肥处理,HN、HNHP和HNPK代表高量化肥处理;M为有机肥处理;NPKM为有机无机混施肥处理。纵坐标代表每种菌的序列数占序列总数的百分比。HEB、ZZ、CS和QY数据分别源自Zhou等[75]、Li等[76]、Zhao等[67]和Xun等[77]。
除土壤中的碳氮养分能驱动细菌群落结构发生变化外,pH值是影响微生物群落的另一关键因子[78],且pH能够很好地预测细菌群落组成[75]。土壤细菌群落之所以受pH的驱动,是因为细菌的主要菌群受pH的影响较大[79]。如,Xun等[77]研究表明细菌群落中受pH影响较大的优势菌种为Firmicutes和α-Proteobacteria,且它们均与土壤pH显著正相关,在添加有机肥的土壤中丰度较高;Zeng等[80]发现,随施氮量增加引起的pH下降导致Acidobacteria、α-Proteobacteria、Bacteroidetes以及Chloroflexi的丰度降低,而Actinobacteria及β-Proteobacteria的结果与之相反。同时,土壤微生物又是土壤养分循环的主要动力,如Actinobacteria为分解有机物的主要细菌类群[74,81],Proteobacteria中含有大量参与土壤氮循环的种群[82],Chloroflexi中的Anaerolineae具有分解复杂有机物的能力[83-84]。因此可通过施肥将土壤调节为利于有益菌群生长代谢的pH值和养分环境,进而调控土壤肥力。
3 长期施肥对氨氧化细菌和氨氧化古菌的影响
氮的存在形态显著影响作物生长,作物对氮肥的需求是否得到满足基本决定了作物产量的高低。土壤中氮素形态的转化主要包括无机氮的固定、有机氮的氨化、铵态氮的硝化及硝态氮的反硝化4个过程,且均由微生物驱动。其中,铵态氮氧化为硝态氮的过程被称为硝化过程。由于植物可利用氮素的形态仅有硝态氮和铵态氮,因此硝化作用在很大程度上影响了土壤氮素对作物的有效性[83]。同时,硝化作用也是连接固氮作用与反硝化作用的中间环节,而反硝化的产物N2O占生物圈释放到大气中N2O总量的70%~90%[84-85],因此硝化作用还与过量氮肥投入导致的环境问题直接相关,被认为是氮循环的中心环节。
氨氧化作用也称亚硝化作用,是硝化作用的第一个反应步骤,同时也是限速步骤,是全球氮循环的关键环节,参与此过程的主要微生物为氨氧化细菌(AOB)和氨氧化古菌(AOA),它们被认为是研究土壤微生物生态学的模式生物[86],其群落结构变化可更有效表征土壤理化性状的改变[10,87]。因此,AOA和AOB一直是研究硝化速率限制因素、N2O产生机制及环境的改变如何影响功能微生物等问题的热点。近些年在农田生态系统的研究中,有关氨氧化菌对长期施肥响应的关注度越来越高。
施用氮肥不仅能够改善土壤中氮素的有效性,提高土壤微生物的硝化能力和硝化速率,同时也会改变与硝化过程密切相关的AOA和AOB的群落[9-10,87-88]。长期施用氮肥可显著降低红壤和黄棕壤中AOA和AOB的数量,这可能是氮肥导致土壤酸化,也可能是长期施用氮肥导致土壤养分不均衡,因此不利于氨氧化菌的生长[9-10]。Chu等[19]对潮土的研究发现,长期施用氮肥,AOB的多样性明显高于不施肥处理,由此可见,氮肥的施用虽会降低部分土壤中AOB的丰度,但又能满足各种氨氧化细菌对氮素的需求,因此多样性显著提高。通过比较施用化肥和有机无机肥配施下的硝化微生物,学者认为硝化微生物活性受无机氮肥的影响更大[89-90],且研究发现长期施用化学氮肥使得Nitrosospiracluster3成为AOB的优势菌种[10,19]。然而,以上结论均通过长期定位试验获得,与短期试验结果不尽相同。短期培养实验中,添加氮肥4周[91]、6周和8周[92]后均未发现AOB群落的显著改变。
amoA基因是编码氨氧化酶的α-亚族,由于其核苷酸序列被完整地保存,同时具有产生能量代谢的基本特征,故被作为研究AOA和AOB的标志基因[93]。长期施用有机肥可显著提高土壤中amoA基因的表达量,据此可推测长期施用有机肥能够提高土壤中AOA和AOB的数量[94]。也有研究发现施用有机肥不仅能够提高土壤中AOA和AOB的数量,也能影响其群落组成[93-95]。研究表明,不均衡化肥处理下的AOA序列被分到clusterM组,且与贫营养环境下的AOA序列相似,而均衡化肥及有机肥处理下的AOA序列被分到clusterS一组[95]。然而,氨氧化菌在不同类型土壤中对施肥的响应并不一致:与长期不施肥和施用化学氮肥相比,向氮肥中加入有机肥后显著改变了河南潮土[19]、黑垆土[96]和石灰性紫色土[97]中的AOB的群落结构,但AOB群落在湖南红壤的所有处理中无显著变化,且在不同处理下的AOB序列的相似度高达98%[10]。

4 展望
4.1 加强长期定位试验中微生物过程的联网研究
土壤微生物指标很容易受人为活动干扰,施肥对其影响较大,如何深入研究微生物对不同施肥方式的响应及其影响因素这一问题亟待解决。长期定位试验不仅能够准确反映不同施肥处理下土壤微生物数量、活性、多样性以及土壤肥力变化,还能通过时间序列的变化来反映微生物如何驱动土壤肥力变化。综合长期施肥对微生物群落和细菌群落结构的改变,能预测不同施肥对微生物的影响及其驱动因素。由长期施用含氮化肥所带来的土壤酸化和养分不均衡等土壤环境引起的微生物数量及活性显著下降,微生物多样性降低等问题,足够从生物学角度证明长期施用含氮化肥会破坏农田生态系统的稳定,且不利于土壤肥力的提升。然而,长期有机肥与含氮化肥配施所引起的积极的生物学效应证明合理配施有机肥是当前农田保肥稳产,生态系统稳定发展的最佳选择。
然而,当前有关长期施肥对土壤微生物的大部分研究只在某一特定长期定位点进行。研究表明,不同土壤类型及不同区域气候下的土壤微生物对长期施肥的响应不同,如,在处于亚热带季风气候的红壤中长期施用化肥降低土壤F/B值,也会显著提高酸杆菌(Acidobacteria)的相对丰度,但在处于温带大陆性季风气候的黑土中长期施用化肥的结果恰与之相反。上文已提及有机肥利于富营养类群的生长,而化肥对来自不同点位的细菌群落结构的影响却不一致。因此,结合多点位的气候变化及土壤差异等因素,在大尺度上综合研究微生物对长期施肥的响应规律有待深入挖掘。对于普遍规律的探索,应考虑将微生物数据与更佳的数学模型相结合,对全国长期定位施肥点进行联网研究,将肥料—环境因子—微生物三者建立定性和定量的数学模型,研究结果将为如何在全国所有气候下不同类型的土壤中有效施肥提供更可靠的理论依据。
4.2 加强对功能菌及其对养分循环过程的调控研究
如今对长期施肥下功能微生物的研究大多集中在碳、氮循环的某个或某些特定微生物功能基因,因此会弱化其他微生物功能基因在驱动整个养分循环中的作用。若想更深入理解驱动土壤养分循环的微生物因子,应全面分析参与养分循环的功能基因,将田间试验与室内培养相结合,采用原位技术,如同位素标记等手段将功能基因与施肥措施以及土壤养分、植物生理生态过程之间建立耦合关系,进而为合理施肥提供更完善的理论依据。在此基础上,利用同位素标记和定量PCR等方法,将参与养分循环的功能基因与其作用的底物、产物及土壤环境相结合进行定量研究,进一步定量阐述影响各类功能基因的因子及各功能基因如何调控整个养分循环过程。如,在研究氮循环过程时,将整个氮循环的功能基因丰度与氮肥利用率相结合,进一步定量阐述施肥如何影响各类氮循环相关基因及各功能基因如何调控整个氮循环及氮肥利用过程。研究结果以功能菌和功能基因为枢纽,建立肥料—土壤因子—功能基因/功能菌—养分利用率的相关定量模型,为养分的管理提供反馈或者建议,这样才能真正发挥功能菌和功能基因对有效施肥的指导性作用。
4.3 加强对真菌和原生动物及其调控养分循环过程的机制研究
除细菌外,作为微生物重要组成部分的真菌和原生动物也是土壤养分的主要调控者。真菌是土壤中复杂有机物的主要分解者,其微生物量及其分泌物具有重要的土壤碳汇功能;原生动物及在根际广泛分布的菌根真菌在土壤碳氮养分的调节中发挥重要作用。但由于目前真菌序列的测试精度较低、分类不健全,研究原生动物的方法受限,导致对真菌和原生动物的群落组成及每个物种在农田土壤中发挥的具体作用仍认识不足。因此,与集中于细菌群落的大量研究相比,有关长期施肥对真菌群落和原生动物的影响及它们对农田土壤养分的调控的研究尚待加强。另外,细菌、真菌及原生动物的交互作用也不容忽视,如它们对养分的竞争作用、在养分转化和运移过程中的协助关系、原生动物对细菌的捕食等也在很大程度上影响整个农田生态系统的养分调节。因此,今后的研究应更多地关注如何改进对原生动物及真菌的研究和分类方法,加强对真菌和原生动物的认识,这样有助于更深入地揭示土壤微生物对长期施肥农田土壤的响应及微生物在养分循环过程中的交互作用。
4.4 提高土壤微生物学研究对生产的实际指导意义
目前,对土壤酶、生物量、多样性、群落结构的研究方法与技术均日渐成熟。随着现代分子生物学技术的不断发展,从基因水平入手,通过对微生物遗传物质的分析,能更客观地反映自然环境中微生物生态多样性的状况。尤其高通量测序技术和基因探针技术的出现,不断刷新人们对土壤微生物这一“生物暗物质”的认识,使得深入挖掘土壤微生物资源,定量描述土壤微生物参与的养分循环贡献过程和定向调控微生物功能成为可能。但是,当前对现代分析生物学技术的应用只停留在通过此技术刷新对土壤微生物认识的阶段,只有进一步探究不同土壤微生物的功能特性及其生态位点,并将其与土壤养分循环及作物对养分吸收利用相结合,才能将此技术的研究成果更有效地应用到实际农业生产中。
例如,现阶段对氨氧化菌这一参与硝化过程的关键微生物的研究已成为探索氮循环的热点。虽已有大量关于不同施肥如何影响氨氧化菌的研究成果,但如何将这些研究结论应用到有效改善由于施肥导致的氮肥利用率低、环境恶化等问题中应加以重视。通过对氨氧化菌在不同施肥环境下对硝化作用的贡献及硝化抑制剂的研究将有助于解决以上问题。同时,早在19世纪末Sergei Winogradsky提出硝化过程分为上述的亚硝化作用和硝化作用,分别由氨氧化菌(ammoniaoxidizer)及亚硝酸盐氧化细菌(nitriteoxidizingbacteria)完成。然而最新研究发现3种不同培养细菌[104-105]和一种非培养细菌能够各自进行从氨氮到硝态氮的完全硝化过程,此种群被称之为完全氧化菌(Comammox),且这3种细菌都属于Nitrospira,但在此之前Nitrospira一直被认为只能完成亚硝态氮氧化为硝态氮这一步骤。这一发现打破了以往对硝化作用的认识,如果能筛选出高效优势的完全氧化菌菌种,可能会颠覆对相关问题的研究。
综上,从提高细菌、真菌和原生动物在调节养分过程的交互作用的关注度,加强长期定位试验中微生物过程的联网研究,深入探究功能菌及其对养分循环过程的调控,提高土壤微生物学研究对生产的实际指导意义这几方面着手,深入对长期施肥下土壤微生物的研究,建立相应的施肥—土壤—微生物的定量模型,才能利用微生物为科学施肥提供更可靠的理论依据,同时为其在土壤学及农业生产中的应用提出更合理的建议。
参考文献:
[1] Miao Y,Stewart B A,Zhang F.Long-term experiments for sustainable nutrient management in China.A review[J].Agronomy for Sustainable Development,2011,31(2):397-414.
[2] 张北赢,陈天林,王兵.长期施用化肥对土壤质量的影响[J].中国农学通报,2010,26(11):182-187.
[3] 黄国勤,王兴祥,钱海燕,等.施用化肥对农业生态环境的负面影响及对策[J].生态环境学报,2004,13(4):656-660.
[4] Diacono M,Montemurro F.Long-term effects of organic amendments on soil fertility.A review[J].Agronomy for Sustainable Development,2010,30(2):401-422.
[5] Cochran W G.Long-term agricultural experiments[J].Supplement to the Journal of the Royal Statistical Society,1939,6(2):104-148.
[6] Xu M G,Tang H J,Yang X Y,et al.Best soil managements from long-term field experiments for sustainable agriculture[J].Journal of Integrative Agriculture,2015,14(12):2401-2404.
[7] Fauci M F,Dick R P.Soil microbial dynamics:Short-and long-term effects of inorganic and organic nitrogen[J].Journal of Soil Science Society of America,1994,58(3):801-806.
[8] 魏巍,许艳丽,朱琳,等.长期施肥对黑土农田土壤微生物群落的影响[J].土壤学报,2013,50(2):372-380.
[9] 裴雪霞,周卫,梁国庆,等.长期施肥对黄棕壤性水稻土氨氧化细菌多样性的影响[J].植物营养与肥料学报,2011,17(3):724-730.
[10] He J Z,Shen J P,Zhang L M,et al.Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices[J].Environmental Microbiology,2007,9(9):2364-2374.
[11]魏丹,杨谦,张军政,等.黑土区长期施肥细菌群落结构和功能多样性变化[C].//中国土壤学会第七届海峡两岸土壤肥料学术交流研讨会论文集(下).北京:中国土壤学会,2008.61-69.
[12]宋长青,吴金水,陆雅海,等.中国土壤微生物学研究10年回顾[J].地球科学进展,2013,28(10):1087-1105.
[13]张薇,魏海雷,高洪文,等.土壤微生物多样性及其环境影响因子研究进展[J].生态学杂志,2005,24(1):48-52.
[14]Chu H,Lin X,Fujii T,et al.Soil microbial biomass,dehydrogenase activity,bacterial community structure in response to long-term fertilizer management[J].Soil Biology & Biochemistry, 2007,39(11):2971-2976.
[15]He J Z,Zheng Y,Chen C R,et al.Microbial composition and diversity of an upland red soil under long-term fertilization treatments as revealed by culture-dependent and culture-independent approaches[J].Journal of Soils and Sediments,2008,8(5):349-358.
[16]Xun W,Xiong W,Huang T,et al.Swine manure and quicklime have different impacts on chemical properties and composition of bacterial communities of an acidic soil[J].Applied Soil Ecology,2016,100:38-44.
[17]Li C,Yan K,Tang L,et al.Change in deep soil microbial communities due to long-term fertilization[J].Soil Biology & Biochemistry,2014,75:264-272.
[18]Ge Y,Zhang J B,Zhang L M,et al.Long-term fertilization regimes affect bacterial community structure and diversity of an agricultural soil in northern China[J].Journal of Soils and Sediments,2008,8(1):43-50.
[19]Chu H,Fujii T,Morimoto S,et al.Community structure of ammonia-oxidizing bacteria under long-term application of mineral fertilizer and organic manure in a sandy loam soil[J].Applied and Environmental Microbiology,2007,73(2):485-491.
[20]Su J Q,Ding L J,Xue K,et al.Long-term balanced fertilization increases the soil microbial functional diversity in a phosphorus-limited paddy soil[J].Molecular Ecology,2014,24(1):136-150.
[21]Ai C,Liang G,Sun J,et al.Responses of extracellular enzyme activities and microbial community in both the rhizosphere and bulk soil to long-term fertilization practices in a fluvo-aquic soil[J].Journal of Geoderma,2012,173(2):330-338.
[22]任祖淦,陈玉水,唐福钦,等.有机无机肥料配施对土壤微生物和酶活性的影响[J].植物营养与肥料学报,1996,2(3):279-283.
[23]Zhang Y F,Zhong W H,Li Z P,et al.Effects of long-term different fertilization on soil enzyme activity and microbial community functional diversity in paddy soil derived from quaternary red clay[J].Journal of Ecology & Rural Environment,2006,22(4):39-44.
[24]Liang C,Gutknecht J L M,Balser T C.Microbial lipid and amino sugar responses to long-term simulated global environmental changes in a California annual grassland[J].Frontiers in Microbiology,2015,6:385-394.
[25]Xun W,Zhao J,Xue C,et al.Significant alteration of soil bacterial communities and organic carbon decomposition by different long-term fertilization management conditions of extremely low-productivity arable soil in South China[J].Environmental Microbiology,2015,18(6):1907-1917.
[26]张平究,李恋卿,潘根兴,等.长期不同施肥下太湖地区黄泥土表土微生物碳氮量及基因多样性变化[J].生态学报,2004,24(12):2818-2824.
[27]刘恩科,赵秉强,李秀英,等.长期施肥对土壤微生物量及土壤酶活性的影响[J].植物生态学报,2008,32(1):176-182.
[28]Sharma S K,Ramesh A,Sharma M P,et al.Microbial community structure and diversity as indicators for evaluating soil quality[M]//Biodiversity,biofuels,agroforestry and conservation agriculture.Netherlands :Springer,2010:317-358.
[30]胡婵娟,刘国华,吴雅琼.土壤微生物生物量及多样性测定方法评述[J].生态环境学报,2011,20(Z1):1161-1167.
[32]邬奇峰,陆扣萍,毛霞丽,等.长期不同施肥对农田土壤养分与微生物群落结构的影响[J].中国农学通报,2015,31(5):150-156.
[33]罗希茜,郝晓晖,陈涛,等.长期不同施肥对稻田土壤微生物群落功能多样性的影响[J].生态学报,2009,29(2):740-748.
[34]臧逸飞,郝明德,张丽琼,等.26年长期施肥对土壤微生物量碳、氮及土壤呼吸的影响[J].生态学报,2015,35(5):1445-1451.
[35]陈欢,曹承富,张存岭,等.长期施肥砂姜黑土微生物学特征差异及评价[J].植物营养与肥料学报,2015,21(6):1563-1571.
[36]Ftde V,Hoffland E,Nvan E,et al.Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J].Soil Biology & Biochemistry,2006,38(8):2092-2103.
[37]贾伟,周怀平,解文艳,等.长期秸秆还田秋施肥对褐土微生物碳、氮量和酶活性的影响[J].华北农学报,2008,23(2):138-142.
[38]王淑英,樊廷录,丁宁平,等.长期施肥下黄土旱塬黑垆土供氮能力的变化[J].植物营养与肥料学报,2015,21(6):1487-1495.
[40]徐阳春,沈其荣,冉炜.长期免耕与施用有机肥对土壤微生物生物量碳、氮、磷的影响[J].土壤学报,2002,39(1):89-96.
[41]马晓霞,王莲莲,黎青慧,等.长期施肥对玉米生育期土壤微生物量碳氮及酶活性的影响[J].生态学报,2012,32(17):5502-5511.
[42]孙凤霞,张伟华,徐明岗,等.长期施肥对红壤微生物生物量碳氮和微生物碳源利用的影响[J].应用生态学报,2010,21(11):2792-2798.
[43]Geisseler D,Horwath W R.Short-term dynamics of soil carbon,microbial biomass,and soil enzyme activities as compared to longer-term effects of tillage in irrigated row crops[J].Biology and Fertility of Soils,2009,46(1):65-72.
[44]梁斌,周建斌,杨学云.长期施肥对土壤微生物生物量碳、氮及矿质态氮含量动态变化的影响[J].植物营养与肥料学报,2010,16(2):321-326.
[45]毕明丽,宇万太,姜子绍,等.施肥和土壤管理对土壤微生物生物量碳、氮和群落结构的影响[J].生态学报,2010,30(1):32-42.
[46]刘恩科,梅旭荣,赵秉强,等.长期不同施肥制度对土壤微生物生物量碳、氮、磷的影响[J].中国农业大学学报,2009,14(3):63-68.
[47]骆坤,胡荣桂,张文菊,等.黑土有机碳、氮及其活性对长期施肥的响应[J].环境科学,2013,34(2):676-684.
[48]Ingwersen J,Poll C,Streck T,et al.Micro-scale modelling of carbon turnover driven by microbial succession at a biogeochemical interface[J].Soil Biology & Biochemistry,2008,40(4):864-878.
[49]Michaels S,Johannes R.Considering fungal:bacterial dominance in soils-Methods,controls,and ecosystem implications[J].Soil Biology & Biochemistry,2010,42(9):1385-1395.
[50]Bailey V L,Smith J L,Hjr B.Fungal-to-bacterial ratios in soils investigated for enhanced C sequestration[J].Soil Biology & Biochemistry,2002,34(7):997-1007.
[51]Elfstrand S,Hedlund K,Martensson A.Soil enzyme activities,microbial community composition and function after 47 years of continuous green manuring[J].Applied Soil Ecology,2007,35(3):610-621.
[52]白震,张明,闫颖,等.长期施用氮、磷及有机肥对农田黑土PLFA的影响[J].浙江大学学报(农业与生命科学版),2008,34(1):73-80.
[53]Bruggen A H C V,Semenov A M,Zeiss M R.In search of biological indicators for soil health and disease suppression[J].Applied Soil Ecology,2000,15(1):13-24.
[54]王灿,王德建,孙瑞娟,等.长期不同施肥方式下土壤酶活性与肥力因素的相关性[J].生态环境,2008,17(2):688-692.
[55]薛冬,姚槐应,何振立,等.红壤酶活性与肥力的关系[J].应用生态学报,2005,16(8):1455-1458.
[56]孙瑞莲,赵秉强,朱鲁生,等.长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用[J].植物营养与肥料学报,2003,9(4):406-410.
[57]王俊华,尹睿,张华勇,等.长期定位施肥对农田土壤酶活性及其相关因素的影响[J].生态环境,2007,16(1):191-196.
[58]Kaur T,Brar B S.Organic matter,microbial biomass and enzyme activity of soils under maize-wheat cropping system[J].Journal of Soils and Crops,2008,18(1):24-30.
[59]李娟,赵秉强,李秀英,等.长期有机无机肥料配施对土壤微生物学特性及土壤肥力的影响[J].中国农业科学,2008,41(1):144-152.
[60]边雪廉,赵文磊,岳中辉,等.土壤酶在农业生态系统碳、氮循环中的作用研究进展[J].中国农学通报,2016,32(4):171-178.
[61]Frankenberger W T,Dick W A.Relationships between enzyme activities and microbial growth and activity indices in soil[J].Soil Science Society of America Journal,1983,47(5):945-951.
[62]Sun L,Xun W,Huang T,et al.Alteration of the soil bacterial community during parent material maturation driven by different fertilization treatments[J].Journal of Soil Biology & Biochemistry,2016,96:207-215.
[63]孙锋,赵灿灿,李江涛,等.与碳氮循环相关的土壤酶活性对施用氮磷肥的响应[J].环境科学学报,2014,34(4):1016-1023.
[64]袁红朝,秦红灵,刘守龙,等.长期施肥对红壤性水稻土细菌群落结构和数量的影响[J].中国农业科学,2011,44(22):4610-4617.
[65]徐万里,唐光木,葛春辉,等.长期施肥对新疆灰漠土土壤微生物群落结构与功能多样性的影响[J].生态学报,2015,35(2):468-477.
[66]Sradnick A,Murugan R,Oltmanns M,et al.Changes in functional diversity of the soil microbial community in a heterogeneous sandy soil after long-term fertilization with cattle manure and mineral fertilizer[J].Applied Soil Ecology,2013,63(63):23-28.
[67]Zhao J,Ni T,Li J,et al.Effects of organic-inorganic compound fertilizer with reduced chemical fertilizer application on crop yields,soil biological activity and bacterial community structure in a rice-wheat cropping system[J].Sensors & Actuators B:Chemical,2016,99(18):1-12.
[68]Sun H Y,Deng S P,Raun W R.Bacterial community structure and diversity in a century-old manure-treated agroecosystem[J].Applied & Environmental Microbiology,2004,70(10):5868-5874.
[69]Zhou J,Xia B,Treves D S,et al.Spatial and resource factors influencing high microbial diversity in soil[J].Applied & Environmental Microbiology,2002,68(1):326-334.
[70]Fierer N,Bradford M A,Jackson R B.Toward an ecological classification of soil bacteria[J].Ecology,2007,88(6):1354-1364.
[71]Chen Z,Luo X,Hu R,et al.Impact of long-term fertilization on the composition of denitrifier communities based on nitrite reductase analyses in a paddy soil[J].Microbial Ecology,2010,60(4):850-861.
[72]Fontaine S,Barot S.Size and functional diversity of microbe populations control plant persistence and long-term soil carbon accumulation[J].Ecology Letters,2005,8(10):1075-1087.
[73]Fox C A,MacDonald K B.Challenges related to soil biodiversity research in agroecosystems-I[J].Canadian Journal of Soil Science,2003,83(Special Issue):231-244.
[74]Fierer N,Lauber C L,Ramirez K S,et al.Comparative metagenomic,phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J].Isme Journal,2012,6(5):1007-1017.
[75]Zhou J,Guan D,Zhou B,et al.Influence of 34-years of fertilization on bacterial communities in an intensively cultivated black soil in northeast China[J].Soil Biology & Biochemistry,2015,90:42-51.
[76]Li F,Chen L,Zhang J,et al.Bacterial community structure after long-term organic and inorganic fertilization reveals important associations between soil nutrients and specific taxa involved in nutrient transformations[J].Frontiers in Microbiology,2017,8:187-198.
[77]Xun W B,Huang T,Zhao J,et al.Environmental conditions rather than microbial inoculum composition determine the bacterial composition,microbial biomass and enzymatic activity of reconstructed soil microbial communities[J].Soil Biology & Biochemistry,2015,90:10-18.
[78]Ling N,Zhu C,Xue C,et al.Insight into how organic amendments can shape the soil microbiome in long-term field experiments as revealed by network analysis[J].Soil Biology & Biochemistry,2016,99:137-149.
[79]Rousk J,Bååth E,Brookes P C,et al.Soil bacterial and fungal communities across a pH gradient in an arable soil[J].Isme Journal,2010,4(10):1340-1351.
[80]Zeng J,Liu X,Song L,et al.Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J].Soil Biology & Biochemistry,2015,92:41-49.
[81]Chen P,Zhang L,Guo X,et al.Diversity,biogeography,and biodegradation potential ofActinobacteriain the deep-sea sediments along the Southwest Indian Ridge[J].Frontiers in Microbiology,2016,7:1340.

[83]Zhou G,Zhang J,Zhang C,et al.Effects of changes in straw chemical properties and alkaline soils on bacterial communities engaged in straw decomposition at different temperature[J].Scientific Reports,2016,6:22186-22198.
[84]贺纪正,张丽梅.土壤氮素转化的关键微生物过程及机制[J].微生物学通报,2013,40(1):98-108.
[85]张玉树,丁洪,秦胜金.农业生态系统中氮素反硝化作用与N2O排放研究进展[J].中国农学通报,2010,26(6):253-259.
[86]Li C,Di H J,Cameron K C,et al.Effect of different land use and land use change on ammonia oxidiser abundance and N2O emissions[J].Journal of Soil Biology & Biochemistry,2016,96:169-175.
[87]Olsson P A,Hansson M C,Burleigh S H.Effect of P availability on temporal dynamics of carbon allocation and glomus intraradices high-affinity P transporter gene induction in arbuscular mycorrhiza[J].Journal of Applied and Environmental Microbiology,2006,72(6):4115-4220.
[88]Oved T.Influence of effluent irrigation on community composition and function of ammonia-oxidizing bacteria in soil[J].Applied & Environmental Microbiology,2001,67(8):3426-3433.
[89]Zhang L M,Hu H W,Shen J P,et al.Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J].Isme Journal,2012,6(5):1032-1045.
[90]Webster J R,Mulholland P J,Tank J L,et al.Factors affecting ammonium uptake in streams-an inter-biome perspective[J].Freshwater Biology,2003,48(48):1329-1352.
[91]Shen J P,Zhang L M,Zhu Y G,et al.Abundance and composition of ammonia-oxidizingbacteria and ammonia-oxidizing archaea communities of an alkaline sandy loam[J].Environmental Microbiology,2008,10(6):1601-1611.
[92]Avrahami S,Conrad R.Patterns of community change among ammonia oxidizers in meadow soils upon long-term incubation at different temperatures[J].Applied & Environmental Microbiology,2003,69(10):6152-6164.
[93]Chen Z,Liu J,Wu M,et al.Differentiated response of denitrifying communities to fertilization regime in paddy soil[J].Microbial Ecology,2012,63(2):446-459.
[94]Norton J M,Alzerreca J J,Suwa Y,et al.Diversity of ammonia monooxygenase operon in autotrophic ammonia-oxidizing bacteria[J].Archives of Microbiology,2002,177(2):139-149.
[95]Wakelin S A,Colloff M J,Harvey P R,et al.The effects of stubble retention and nitrogen application on soil microbial community structure and functional gene abundance under irrigated maize[J].Fems Microbiology Ecology,2007,59(3):661-670.
[96]刘桂婷,程林,王保莉,等.长期不同施肥对黄土旱塬黑垆土氨氧化细菌多样性的影响[J].中国农业科学,2010,43(13):2706-2714.
[97]Xia W,Zhang C,Zeng X,et al.Autotrophic growth of nitrifying community in an agricultural soil[J].Isme Journal,2011,5(7):1226-1236.
[98]辜运富,云翔,张小平,等.不同施肥处理对石灰性紫色土微生物数量及氨氧化细菌群落结构的影响[J].中国农业科学,2008,41(12):4119-4126.
[99] Gubryrangin C.Archaea rather than bacteria control nitrification in two agricultural acidic soils[J].Fems Microbiology Ecology, 2010,74(3):566-574.
[100] Yao H Y,Gao Y M,Graeme W,et al.Links between ammonia oxidizer community structure,abundance,and nitrification potential in acidic soils[J].Applied & Environmental Microbiology,2011,77(13):4618-4625.
[101] Di H J,Cameron K C,Shen J P,et al.Nitrification driven by bacteria and not archaea in nitrogen-rich grassland soils[J].Nature Geoscience,2009,2(2):621-624.
[102] Shen J P,Zhang L M,Di H J,et al.A review of ammonia-oxidizing bacteria and archaea in Chinese soils[J].Frontiers in Microbiology,2012,3:296-303.
[103] van Kessel M A,Speth D R,Albertsen M,et al.Complete nitrification by a single microorganism[J].Nature,2015,528(7583):555-559.
[104] Daims H,Lebedeva E V,Pjevac P,et al.Complete nitrification by Nitrospira bacteria[J].Nature,2015,528(7583):504-509.
[105] Pinto A J,Marcus D N,Ijaz U Z,et al.Metagenomic evidence for the presence of comammox nitrospira-like bacteria in a drinking water system[J].Msphere,2016,1(1):54-69.

