荒漠肉苁蓉中苯乙醇苷类与多糖含量的测定及抗氧化作用研究△
覃文婷,王小明,徐荣,宿美凤,雒晓梅,常晓燕,陈君,石钺*
(1.北京中医药大学 中药学院,北京 100029;2.中国医学科学院中国协和医科大学 药用植物研究所,北京 100193)
荒漠肉苁蓉CistanchedeserticolaY.C.Ma为列当科多年寄生植物,具有补肾壮阳、润肠通便、延缓衰老、消除疲劳、提高免疫力、保肝护肝等功能,被载入《中华本草》《中华人民共和国药典》等医药名录。荒漠肉苁蓉在内蒙古、新疆、宁夏等地均有分布,其主要有效成分为苯乙醇苷类和多糖类成分。近代药理研究表明,苯乙醇苷类与多糖均为天然抗氧化剂,在体内外均有明显的抗氧化作用,可清除超氧自由基、羟自由基等多种自由基,显著提高衰老小鼠血清和肺中的超氧化物歧化酶(SOD)活性,脂质过氧化物(LPO)、一氧化氮浓度等明显降低[1-5]。已有文献中对苯乙醇苷类成分的化学结构、药理活性研究较多,而荒漠肉苁蓉多糖的含量检测、抗氧化活性的研究较少,现制备荒漠肉苁蓉总苷、醇提物及多糖,测定其有效成分含量,同时采用体外清除DPPH自由基考察三者抗氧化活性,提高肉苁蓉活性成分的利用率,为荒漠肉苁蓉中苯乙醇苷化合物和多糖的药理、生物活性研究提供参考。
1 仪器与试药
1.1 仪器
全波长多功能酶标仪(infinite M1000 Pro,瑞士Tecan);RE-2000A旋转蒸发器(上海亚荣生化仪器厂);KQ-250DE型数控超声清洗器(昆山市超声仪器有限公司);METTLER-AB135十万分之一电子分析天平(METTER-TOLEDO,Switzerland)。
1.2 试药
荒漠肉苁蓉(中国医学科学院药用植物研究所销售部)经中国医学科学院药用植物研究所徐荣副研究员鉴定为荒漠肉苁蓉CistanchedeserticolaY.C.Ma干燥带鳞叶的肉质茎;葡萄糖(纯度:99.5%,批号:SLBR0495V,SIGMA);DPPH(梯希爱化成工业发展有限公司,批号:PRPDE-JO);屈臣氏蒸馏水(杭州哇哈哈屈臣氏有限公司);乙腈(色谱纯,Honeywell Burdick & Jackson,USA);甲酸(色谱纯,Dikma Technologies Inc.,Beijing);其余试剂均为分析纯。
Trolox(奎诺二甲基丙烯酸酯,纯度:98.0%;批号:RQ17L1107,上海瑞永生物科技有限公司);松果菊苷(成都曼思特生物科技有限公司,纯度:98.88%,批号:MUST-17030701);2’-乙酰毛蕊花糖苷(成都曼思特生物科技有限公司,纯度:99.28%,批号:MUST-17031504);管花苷A(成都曼思特生物科技有限公司,纯度:98.57%,批号:MUST-16080111);毛蕊花糖苷(成都曼思特生物科技有限公司,纯度:99.57%,批号:MUST-17020715);异毛蕊花糖苷(成都曼思特生物科技有限公司,纯度:99.77%,批号:MUST-17041816)。
2 方法与结果
2.1 荒漠肉苁蓉苯乙醇苷类成分及多糖的制备
取适度粉碎的荒漠肉苁蓉置于圆底烧瓶,用70%乙醇回流提取2次,每次2 h,过滤,合并收集70%乙醇回流液,浓缩真空干燥,得到醇提物浸膏;药渣挥干至无醇味,以水提醇沉法得到荒漠肉苁蓉粗多糖;上述醇提物浸膏过AB-8大孔树脂进行纯化,先用水去除杂质,再用50%乙醇洗脱,直至无色,收集洗脱液,浓缩蒸干,得到荒漠肉苁蓉总苷。
2.2 荒漠肉苁蓉总苷、醇提物中5种苯乙醇苷类成分含量的测定
2.2.1 UPLC色谱条件 色谱柱:Waters Acquity UPLC©BEH C18(100 mm×2.1 mm,1.7 μm);流动相:乙腈(A)-0.1%甲酸水(B);流速:0.3 mL·min-1;进样体积:2 μL;柱温:30 ℃;波长:330 nm;梯度洗脱条件:0~8 min,2%A;8~16 min,12%A;16~19 min,16%A;19~22 min,16%A~22%A;22~25 min,22%A;25~30 min,22%A~25%A;30~32 min,25%A;32~35 min,25%A~30%A;35~38 min,30%A~40%A;38~40 min,40%A~50%A。
2.2.2 标准曲线的绘制 分别精密称取松果菊苷1.69 mg、毛蕊花糖苷0.70 mg、管花苷A 1.06 mg、异毛蕊花糖苷0.99 mg、2’-乙酰毛蕊花糖苷0.85 mg,分别用2 mL甲醇溶解,依次稀释到适当浓度,绘制标准曲线,结果见表1。

表1 5种苯乙醇苷类成分标准曲线
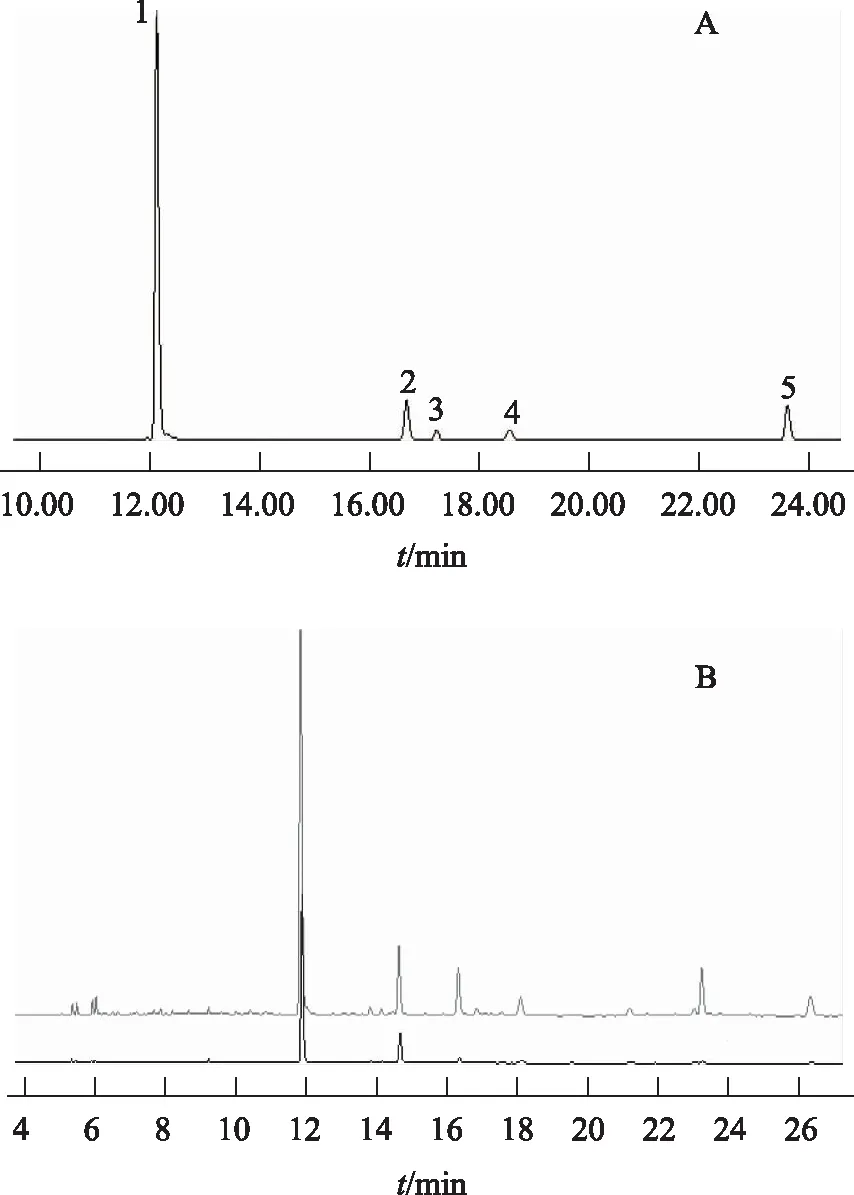
注:A.对照品;B.总苷、醇提物;按出峰时间顺序峰1~5分别为松果菊苷、毛蕊花糖苷、管花苷A、异毛蕊花糖苷、2’-乙酰毛蕊花糖苷。图1 对照品、总苷、醇提物UPLC图
2.2.3 方法学考察 精密度试验:按照2.2.1项色谱条件,总苷样品溶液连续进样6次,计算结果显示,5种苯乙醇苷类成分峰面积RSD均小于3.0%(n=6),表明仪器精密度良好。
稳定性试验:在上述色谱条件下,总苷样品溶液分别在0、4、8、16、24 h进样,测得5种苯乙醇苷类成分含量在24 h内稳定,RSD均小于3.0%(n=5)。
重复性试验:精密称取总苷样品10.0 mg,2 mL蒸馏水溶解,在上述色谱条件下进样,5种苯乙醇苷类成分峰面积RSD均小于3.0%(n=5),表明该方法重现性良好。
加样回收试验:以总苷样品进行加样回收试验,以样品已知含量的80%、100%、120%等比例加入各对照品适量,平行测定3份,考察结果见表2。
2.2.4 各样品5种苯乙醇苷类成分含量的测定 称取2.1项下制得醇提物与总苷样品,配制成质量浓度为5 mg·mL-1的供试品溶液,测定其中5种苯乙醇苷含量[6-8],结果见表3。
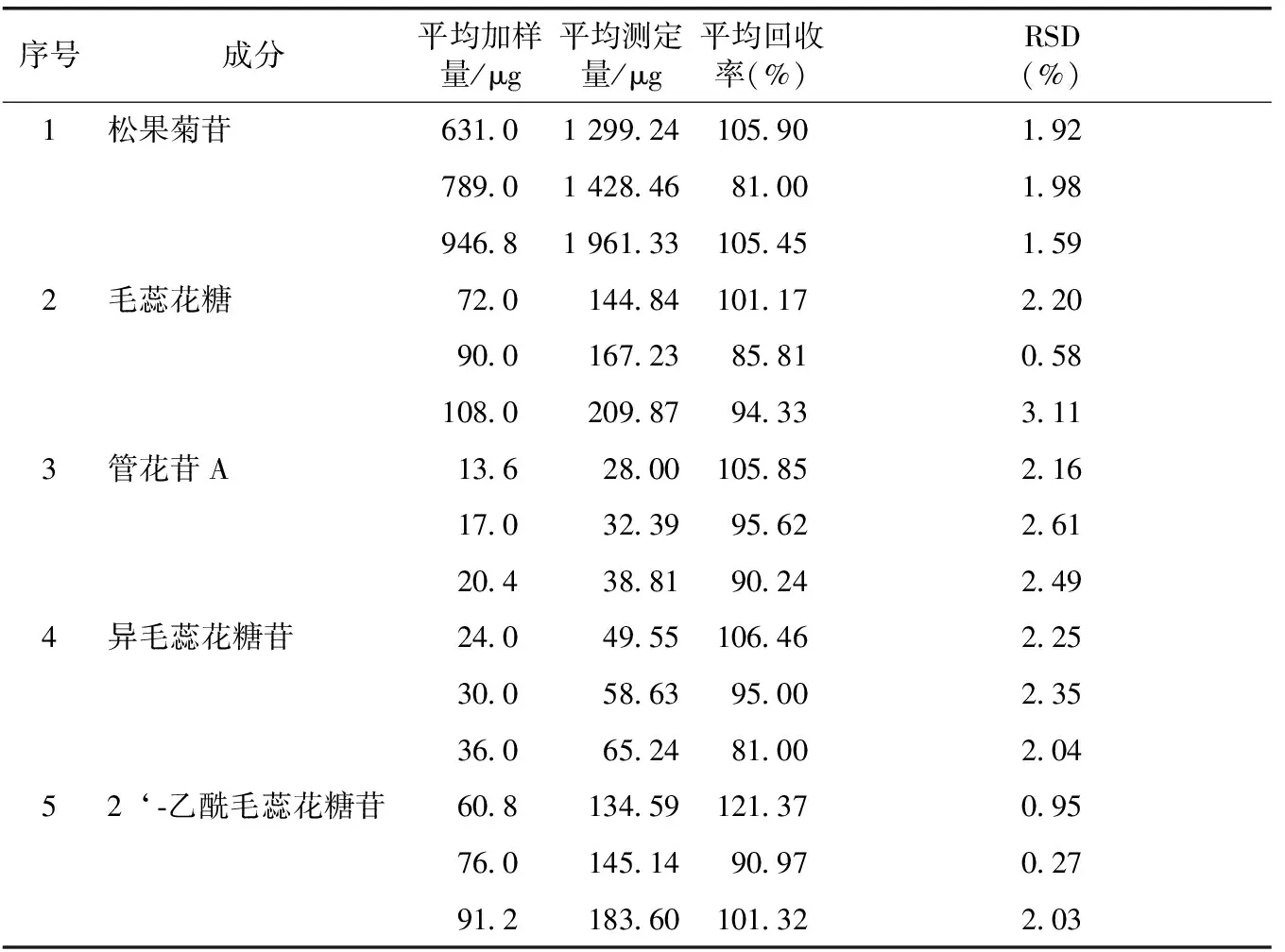
表2 加样回收试验结果(n=3)
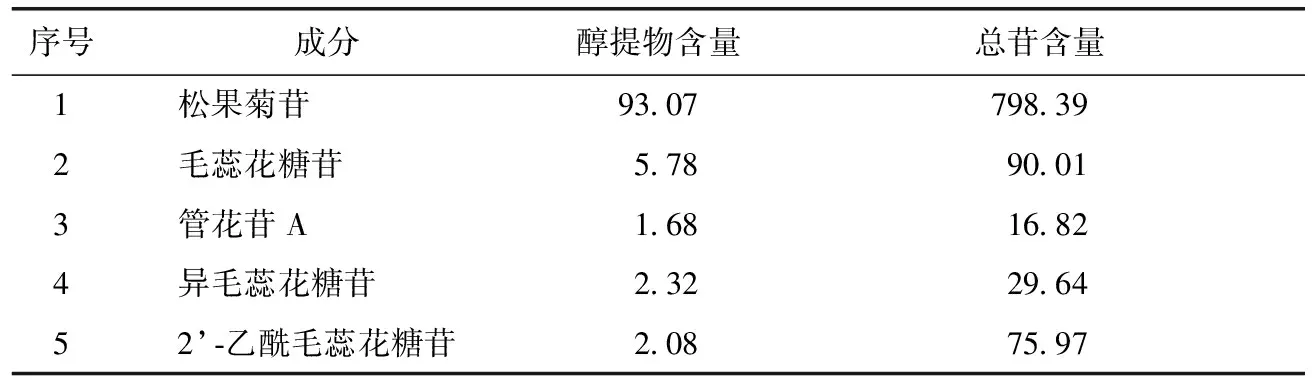
表3 样品含量测定结果 μg
2.3 多糖含量的测定
2.3.1 葡萄糖标准曲线的绘制 精密称取葡萄糖适量,蒸馏水溶解,配制成质量浓度为80 μg·mL-1的葡萄糖储备液,依次稀释成质量浓度为40、20、5、2.5 μg·mL-1系列溶液,充分混匀后取2 mL置于具塞试管,再精密加入1 mL 6%苯酚溶液,5 mL浓硫酸,水浴加热20 min,取出,流水冷却,于490 nm处测定吸光度[9-10],得到回归方程Y= 8.892 9X+0.022 8,r=0.999 4,表明样品浓度在2.5~80 μg·mL-1呈现良好的线性关系。
2.3.2 方法学考察 精密度试验:取2 mL多糖储备液按2.3.1项下操作测定其吸光度,连续进样6次,RSD为1.78%,表明仪器精密度良好。
稳定性试验:取2 mL多糖储备液在2.3.1项下操作,测定反应后0、20、40、60、80、120 min后样品吸光度,RSD值为1.99%,表明2 h稳定性良好。
重复性试验:精密称取多糖样品2.5 mg,平行5份,上述操作下测定多糖平均含量为86.87%,RSD值为1.90%。
加样回收率:精密移取已知含量的多糖样品溶液1 mL,分别等比例加入80%、100%、120%葡萄糖标准溶液,按上述操作测定其吸光度,结果见表4。
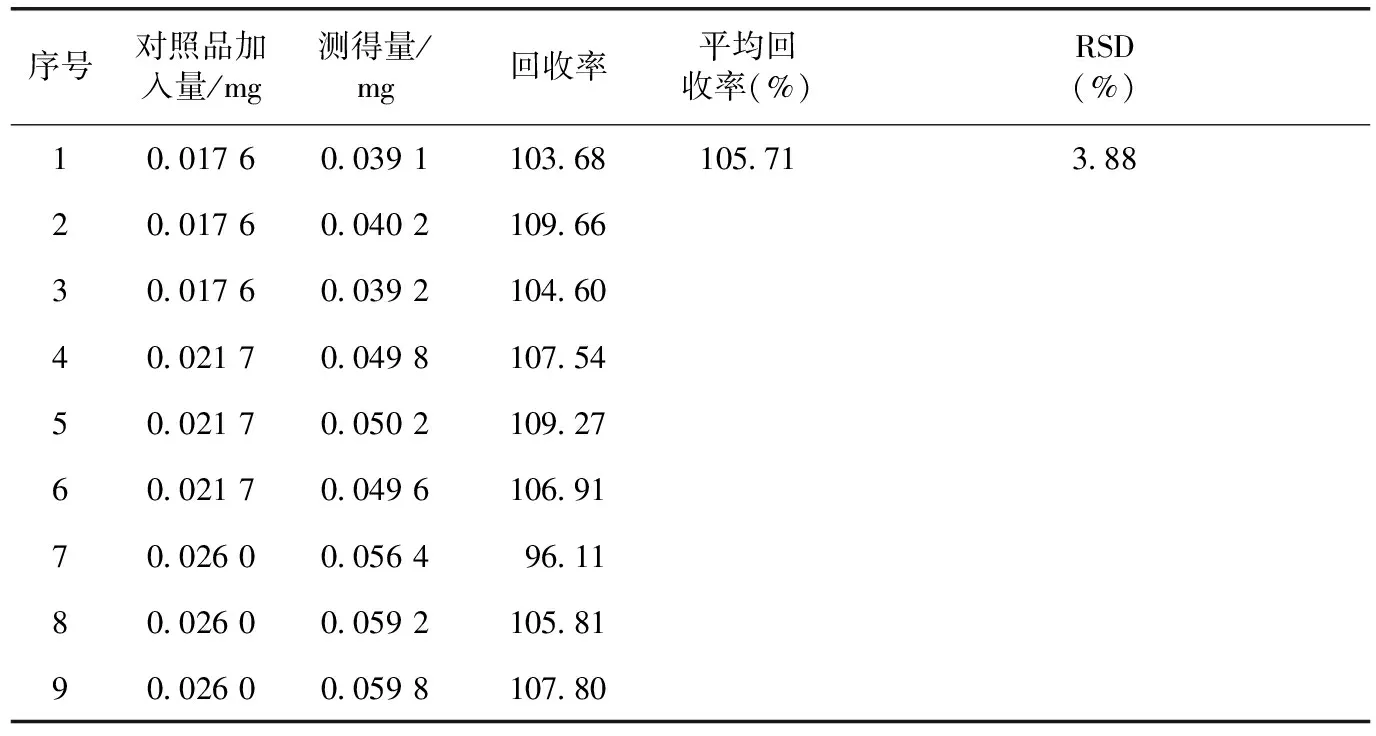
表4 加样回收率测定结果(n=9)
注:样品平均含量为0.021 7 mg·mL-1。
2.3.3 多糖含量的测定 精密称取2.5 mg多糖样品,蒸馏水定容至100 mL容量瓶,配制成C1浓度(0.025 mg·mL-1)的供试品溶液,同样按上述操作测定样品吸光度,根据回归方程得出样品中的质量浓度为C2(0.021 7 mg·mL-1),多糖质量分数为:W =C2/C1×V(稀释倍数),测得多糖中平均含量为86.87%,RSD为1.90%(n=5)。
2.4 荒漠肉苁蓉苯乙醇苷类成分及多糖清除DPPH自由基能力的测定
2.4.1 DPPH自由基乙醇溶液的配制 精密称取DPPH自由基粉末3.32 mg于100 mL棕色容量瓶中,加95%乙醇定容至刻度,超声5 min,充分混匀,得到浓度约为0.08 mmol·L-1的DPPH自由基储备液,现用现配,避光放置。
2.4.2 多糖样品溶液的配制 称取多糖12.5 mg定容于10 mL的容量瓶中,以水溶解,得到1.25 mg·mL-1的多糖储备液,分别稀释成0.078 125、0.156 25、0.312 5、0.625、1.25 mg·mL-1的系列溶液。
2.4.3 荒漠肉苁蓉醇提物及总苷样品溶液的配制 分别称取样品10 mg定容于10 mL容量瓶,以水溶解,得到1 mg·mL-1的样品储备液,依次稀释成12.5、25、50、100、200 μg·mL-1的系列溶液。
2.4.4 测定方法 参照文献方法[11-15],将1 mL的DPPH自由基乙醇溶液分别与1 mL不同浓度的样品试液反应,充分混匀,暗室静置反应30 min,以蒸馏水调零,于519 nm处用酶标仪测定样品溶液与DPPH自由基反应后的吸光度A2,同时测定空白组(1 mL不同浓度样品试液+1 mL蒸馏水)吸光度A1和对照组(1 mL DPPH自由基乙醇溶液+1 mL 蒸馏水)吸光度A0,每组平行测定3份,取平均值计算其清除DPPH自由基能力,通过GraphPad prism 5计算IC50的样品试液浓度。
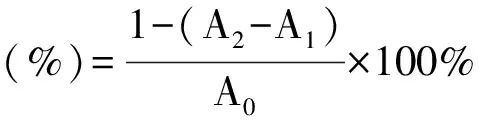
(1)
2.4.5 荒漠肉苁蓉苯乙醇苷类成分及多糖清除·DPPH能力的测定结果 见图2及表5。

序号受试物IC50/μg·mL-11醇提物44 572多糖类261 33总苷14 394Trolox3 66
由以上结果可知,Trolox抗氧化能力最强,与其相比,苯乙醇苷类成分具有较强的抗氧化能力,且其清除DPPH自由基能力与含量呈现正相关,在浓度达到一定程度时,清除率保持在稳定水平;70%醇提物经纯化后,其效强增加2倍;与苯乙醇苷类成分相比,多糖抗氧化能力较弱,其效强仅为苷类成分的1/18,据此推测,苯乙醇苷类成分可能是发挥抗氧化作用的主要药效物质基础。
3 讨论
为更全面地评价荒漠肉苁蓉中有效成分的含量与活性,此次实验中建立的UPLC色谱条件能使5种苯乙醇苷类成分在40 min内获得良好的分离度,在250~350 nm进行全波长扫描,苯乙醇苷类成分在330 nm处有最大吸收;含量测定结果表明,荒漠肉苁蓉中所含松果菊苷含量最高,其次为毛蕊花糖苷,两者含量总和达到1.9%,符合《中华人民共和国药典》标准,而醇提物经AB-8大孔吸附树脂纯化后,两者含量显著增加,达到17%,含量提高约9倍;所测的5种苯乙醇苷类成分中,管花苷A的含量最少,仅为0.33%,但经分离纯化后,达到3.36%,说明使用大孔吸附树脂能够很好地分离纯化苯乙醇苷,不仅高效,且操作简便安全;本实验所建立的UPLC测定方法简便快速、重复性好、结果准确。搜索近4年苯乙醇苷类成分含量检测的相关文献可知,研究人员均采用HPLC、UPLC或与质谱联用建立色谱条件,色谱条件会依据药物性质、仪器性能等因素作出相应调整。有研究[16-17]建立HPLC色谱条件检测肉苁蓉不同加工方式对苯乙醇苷类成分含量的影响,结果表明,蒸制肉苁蓉切片5~7 min时苯乙醇苷含量有显著提高。Wang X等[18]建立UPLC色谱条件检测肉苁蓉不同部位中苯乙醇苷类成分含量,研究显示,不同部位中苯乙醇苷类成分含量差异明显,且呈规律性变化。
综合所述,建立HPLC/UPLC色谱条件对苯乙醇苷类成分进行定性定量分析已成为一种成熟手段,且UPLC色谱系统可使化学成分获得更佳的分离效果,在保证分析结果质量的同时,提高工作效率。
在前期摸索测定多糖含量时,测得多糖中蛋白含量小于3%,同时在查阅已有文献后,获知苯酚硫酸法操作简便、重复性好,且基本不受蛋白质的影响,故采用苯酚硫酸法进行实验,结果测得多糖平均含量为86.87%,但该实验反应剧烈,操作时应注意安全。
体外抗氧化实验前期摸索中发现,清除DPPH自由基实验中药物灵敏度高于清除超氧阴离子自由基、羟基自由基这2项实验中所测结果,又由于测定体外总抗氧化能力(T-AOC)试剂盒所需样品量少,容易引起误差,故本文采用体外清除DPPH自由基实验评价苯乙醇苷类成分与多糖的抗氧化能力,且在上述Peng F、Wang X等人实验中同样采用此方法,说明体外清除DPPH自由基实验简单快速、结果可靠。文章结果显示,苯乙醇苷类成分抗氧化能力显著高于多糖,醇提物、总苷与多糖的抗氧化效价比分别为1∶6、1∶18,且经纯化后得到的总苷抗氧化能力高于醇提物,效价比为1∶3,这与李丽等[19]、吴海虹等[20]得到的观点一致,同时在杨建华等[21]的研究中表明,苯乙醇苷类成分抗氧化能力除与含量相关外,也与其所连接的苷元、酚羟基的数量与位置、空间位阻的大小等因素相关。中药多糖的抗氧化相关研究显示,不同种多糖清除DPPH自由基能力差异较大,提取工艺、炮制方法、分子量段等因素都会影响多糖的抗氧化能力[22-28]。
文章首次同时对荒漠肉苁蓉中苯乙醇苷类成分与多糖进行含量与抗氧化能力的测定,为全面评价荒漠肉苁蓉品质,提高有效成分利用率提供数据参考。
[1] 高晓霞,陈君,彭艳丽.肉苁蓉多糖药理作用研究概况[J].食品与药品,2015,17(2):136-139.
[2] 丁燕,张开梅,苍小鑫,等.肉苁蓉属化学成分及生物活性研究进展[J].大连工业大学学报,2016,35(6):395-402.
[3] 赵微,潘英妮.肉苁蓉苯乙醇苷类成分药理作用研究进展[J].亚太传统医药,2013,9(5):77-79.
[4] 方鉴.肉苁蓉的药理研究进展[J].光明中医,2017,32(14):2140.
[5] 曲正义,金银萍,张玉伟,等.列当属药用植物化学成分、生物活性及临床应用研究进展[J].中国实验方剂学杂志,2018,5(1):209-216.
[6] 韩国庆,李彩峰,王晓琴,等.列当中苯乙醇苷类成分的含量测定[J].中国中药杂志,2015,40(21):4218-4222.
[7] 张瑜,杨健,詹志来,等.UPLC-MS/MS测定不同产地吊石苣苔中苯乙醇苷类成分含量[J].中国现代中药,2017,19(4):504-508.
[8] 易满,封传华,汤小林,等.不同产地车前草中总苯乙醇苷和毛蕊花糖苷含量测定[J].中国中医药信息杂志,2017,24(9):84-86.
[9] 李莉,曹进.分光光度法测定肉苁蓉多糖含量[J].食品安全质量检测学报,2017,8(7):2419-2423.
[10] 范传颍,陶正明,吴志刚.苯酚硫酸法与蒽酮硫酸法测定铁皮石斛中多糖含量的比较[J].浙江农业科学,2013(7):799-801.
[11] 谈利红.体外抗氧化评价体系在中药中的拓展应用[D].重庆:重庆医科大学,2016.
[12] 刘伯言.肉苁蓉苯乙醇苷的提取、纯化和抗氧化活性研究[D].北京:北京林业大学,2014.
[13] 王力伟.肉苁蓉成分的分离鉴定、定量分析及生物活性研究[D].呼和浩特:内蒙古大学,2016.
[14] 刘洋,修效友,汪维云.响应面分析法优化肉苁蓉苯乙醇苷提取反应及其抗氧化反应研究[J].安徽农业大学学报,2015,42(2):294-298.
[15] 俞慧红,竺巧玲,戴飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-176.
[16] Peng F,Xu R,Wang X,et al.Effect of the Steaming Process on Quality of Postharvest Cistanche deserticola for Medicinal Use during Sun Drying[J].Biol Pharm Bull,2016,39(12):2066-2070.
[17] Peng F,Chen J,Wang X,et al.Changes in Levels of Phenylethanoid Glycosides,Antioxidant Activity,and Other Quality Traits in Cistanche deserticola Slices by Steam Processing[J].Chem Pharm Bull(Tokyo),2016,64(7):1024-1030.
[18] Wang X,Wang J,Guan H,et al.Comparison of the Chemical Profiles and Antioxidant Activities of Different Parts of Cultivated Cistanche deserticola Using Ultra Performance Liquid Chromatography-Quadrupole Time-of-Flight Mass Spectrometry and a 1,1-Diphenyl-2-picrylhydrazyl-Based Assay[J].Molecules,2017,22(11):E2011.
[19] 李丽,刘质净,时东方,等.车前草中苯乙醇苷类化合物的抗氧化活性研究[J].江苏农业科学,2010(1):275-277.
[20] 吴海虹,玄国东,刘春泉,等.肉苁蓉苯乙醇苷的纯化及其抗氧化活性研究[J].食品科学,2008(6):190-193.
[21] 杨建华,胡君萍,热娜·卡斯木,等.肉苁蓉属植物中六种苯乙醇苷类化合物抗氧化活性的构效关系研究[J].中药材,2009,32(7):1067-1069.
[22] 汪瑞敏,朱秋劲,张春花,等.不同提取方法对天麻多糖抗氧化活性的影响[J].食品科技,2015,40(3):208-213.
[23] 姜宁,刘晓鹏,陈芳,等.厚朴多糖提取工艺及其体外抗氧化活性[J].食品科学,2015,36(6):12-17.
[24] 赵永安,陈冠,陶遵威.苦豆子多糖及其衍生物的体外抗氧化活性[J].中国实验方剂学杂志,2013,19(5):229-232.
[25] 徐丛玥,林款,梁征,等.不同提取方法对米邦塔仙人掌粗多糖体外抗氧化性的影响[J].食品工业科技,2018,39(3):56-60.
[26] 严成,严夏.枸杞多糖提取工艺比较及体外抗氧化性研究[J].食品科学,2008,29(7):183-187.
[27] 李寒冰,苗静静,李根林,等.生、熟地黄的体外抗氧化活性测定方法研究[J].中国医药指南,2012,10(9):393-395.
[28] 郝杰,查学强,鲍素华,等.霍山石斛不同分子量多糖体外抗氧化研究[J].食品科学,2009,30(15):94-98.

