Numb蛋白及Numb/Notch信号通路对人胰腺癌细胞株放疗敏感性的影响
卢晓玉
河南省肿瘤医院病理科,郑州 450000
胰腺癌是恶性程度最高的消化道肿瘤之一,居全球肿瘤死亡原因的第4位,在中国居第6位[1]。胰腺癌早期容易发生胰周侵袭和远处转移,导致其预后效果差,5年总体生存率低于5%[2]。因此,寻找与胰腺癌侵袭和转移有关的分子标志物,对胰腺癌的早期诊断及判断预后有至关重要的作用。Numb是在神经发育中被发现的第一个呈不对称分布的蛋白,是细胞命运决定子,通过不对称分裂对细胞分裂和分化的调控起重要作用[3]。近年来研究发现,Numb的突变或表达异常而导致细胞增殖与分化的不平衡与肿瘤的发生有着很大关系。Numb参与多种肿瘤信号通路的调控,与肝癌、乳腺癌、肺癌等均有关[4-7]。本研究主要探讨Numb蛋白及其Numb/Notch信号通路对人胰腺癌细胞株放疗敏感性的影响,旨在为胰腺癌的治疗寻找新的靶标,现报道如下。
1 材料与方法
1.1 材料
人胰腺癌MIA PaCa-2细胞株购自中国医学科学院上海细胞库。
1.2 仪器与试剂
10%胎牛血清购自美国Hyclone公司,DMEM培养基购自美国Gibco公司,0.25%胰酶购自美国Gibco公司,MTT溶液购自美国Sigma公司,DMSO购自美国Amresco公司,Trizol试剂购自美国Invitrogen公司,BCA蛋白购自美国Thermo公司,Numb、Notch1、Hes1和Hes5一抗购自美国CST公司,辣根过氧化物酶二抗购自英国Abcam公司;CO2培养箱购自美国Thermo公司,FACS Vantage流式细胞仪购自美国BD公司,ND-1000紫外/可见光分光光度计购自美国Nanodrop公司。
1.3 细胞培养
人胰腺癌MIA PaCa-2细胞株用含10%胎牛血清的DMEM培养基在5%CO2、37℃、湿度95%的CO2培养箱内培养。培养细胞呈单层生长,贴壁率应达90%。传代时常规倒掉培养液,磷酸盐缓冲溶液(phosphate buffered solution,PBS)冲洗 2次,0.25%胰酶消化,见细胞间隙增大,倾去胰酶,DMEM培养基吹打使其成单细胞悬液,常规传代。
1.4 电离辐射
取对数期生长的胰腺癌MIA PaCa-2细胞株,制备适宜细胞密度的悬液,接种细胞到合适的培养皿中,置于培养箱中培养12 h。釆用Varian 21 EX直线加速器,6 MV高能X线照射,剂量率3 Gy/min,分别以不同剂量(0、1、3、5 Gy)垂直辐射细胞,照射范围10 cm×10 cm。将细胞放回培养箱,继续培养48 h。
1.5 实验方法
1.5.1 MTT比色法实验 将MIA PaCa-2细胞接种到96培养孔板中,每孔接种3×105个细胞,每孔200 μl,培养12 h后进行X射线照射。继续培养48 h后,每孔加20 μl 5 mg/ml MTT溶液显色。4 h后弃液,每孔加入剂量为150 μl的DMSO,轻匀摇动10 min。酶联免疫检测仪上490 nm处测定各孔吸光度值。
1.5.2 细胞凋亡检测 将MIA PaCa-2细胞接种到6孔板中,每孔接种3×103个细胞,培养12 h后进行X射线照射。继续培养48 h后,离心收集各组细胞,PBS冲洗 2次,加入200 μl Binding Buffer振荡混匀,加入2.5 μl Annexin V-FITC再次混匀,室温避光反应10~15 min,上机前加5 μl PI,立即用流式细胞仪检测。
1.5.3 划痕实验 用记号笔在6孔板背后每隔0.5~1 cm均匀划一道横线。将3×103个细胞种入划好线的6孔板中,培养过夜。次日待细胞密度为80%~90%时,用枪头垂直于背后的横线划痕。划完后,进行X射线照射。继续培养48 h后,每孔随机选择8个有划痕穿过的视野,观察划痕处细胞运动情况,拍照取样,计算相对划痕宽度(相对于0 h划痕宽度的百分率),反映细胞迁移能力。
1.5.4 Transwell实验 将Matrigel基质胶4℃溶解过夜,用无血清DMEM培养基稀释,加入每个Transwell小室的上室铺膜,每次间隔10 min。接种细胞悬液于Transwell上室,每孔接种3×104个细胞,将0.5 ml含10%胎牛血清的DMEM培养基加入24孔板下室。采用结晶紫染色10 min。培养12 h后进行X射线照射。继续培养48 h后,各组穿过Matrigel基质胶的细胞数量作为评价其侵袭能力的指标。
1.5.5 实时荧光定量RT-PCR检测 按Trizol试剂说明书提取总RNA。溶解RNA后,使用ND-1000紫外/可见光分光光度计测量260 nm和280 nm下吸光度,调整RNA的浓度用于qRT-PCR。引物序列详见表1。qRT-PCR反应体系按试剂盒说明书操作,反应条件:95℃预变性30 s;95℃变性10 s;60℃退火20 s,70℃延伸10 s,共进行40个循环,以β-actin为内参,采用相对定量法计算,用2-ΔΔCt表示目的基因的相对表达倍数。

表1 qRT-PCR引物序列
1.5.6 Western blot检测 Numb、Notch1、Hes1和Hes5蛋白表达 裂解细胞后,4℃条件下12 000 r/min离心10 min,吸取上清置于-20℃保存。BCA蛋白定量检测后,将裂解好的蛋白样品用双蒸水稀释;转入96孔板中,每孔200 μl;37℃恒温30 min,冷却至室温;酶标仪490 nm波长检测样品吸光度值,计算样品蛋白浓度。电泳先用60 V,待进入分离胶后改用120 V。随后,用湿转电转移法将蛋白质转移到PVDF膜上,电转移2 h,取下PVDF膜,5%脱脂牛奶封闭,室温下孵育1~2 h。加入Numb、Notch1、Hes1和Hes5一抗,4 ℃过夜,TBST冲洗3次,每次10 min,加入辣根过氧化物酶二抗,室温1 h,TBST洗3次,每次10 min。进行化学发光,X光片压片、显影、定影,数据分析。
1.6 统计学方法
采用SPSS 22.0和GraphPad Prism 6对数据进行统计分析。计量资料采用均数±标准差(±s)进行描述,多组间比较采用方差分析,两两比较采用LSD-t检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 电离辐射对细胞增殖和凋亡的影响
MTT检测辐射细胞活性结果显示:MIA PaCa-2细胞在1、3、5 Gy的放射剂量下,细胞吸光度值均低于未受辐射细胞的吸光度值,差异有统计学意义(P﹤0.05),详见图1。细胞凋亡实验结果显示:MIA PaCa-2细胞在1、3、5 Gy的放射剂量下,细胞总凋亡率均高于未受辐射细胞的总凋亡率,差异有统计学意义(P﹤0.05),详见图2。
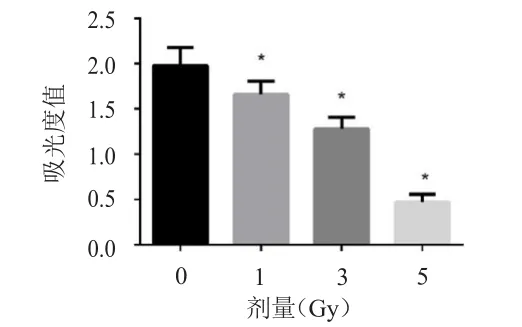
图1 MTT法检测不同剂量X射线作用后MIAPaCa-2胰腺癌细胞增殖情况
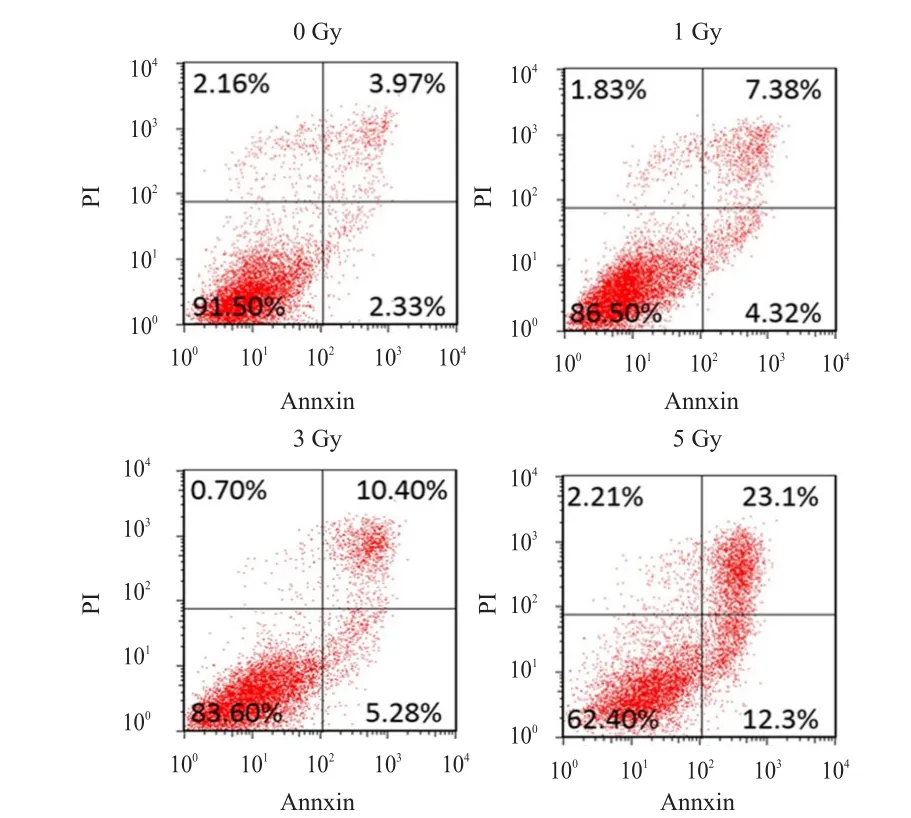
图2 不同剂量X射线作用对MIAPaCa-2胰腺癌细胞凋亡的影响
2.2 电离辐射对细胞侵袭和迁移能力的影响
细胞划痕实验结果显示:在0、1、3、5 Gy放射剂量作用48 h后,MIA PaCa-2细胞相对划痕宽度分别为(16.54±1.38)%、(37.33±1.62)%、(47.25±1.62)%、(60.89±1.35)%,在1、3、5 Gy的放射剂量下受辐射的MIA PaCa-2细胞的迁移能力与未受辐射细胞比较,差异均有统计学意义(P﹤0.05),详见图3。Transwell侵袭实验结果显示:0~5 Gy放射剂量作用48 h后,受辐射的MIA PaCa-2细胞在1、3、5 Gy的放射剂量下,受辐射的细胞穿过小室底膜的数目均较未受辐射的细胞减少,差异有统计学意义(P﹤0.05),详见图4。

图3 细胞划痕实验检测不同剂量X射线作用对MIAPaCa-2胰腺癌细胞迁移的影响(×100)

图4 Transwell实验检测不同剂量X射线作用对MIAPaCa-2胰腺癌细胞侵袭的影响(结晶紫染色,×200)
2.3 电离辐射对Numb/Notch信号通路及下游信号分子的影响
在不同剂量电离辐射的作用下,采用qRT-PCR和Western blot方法检测Numb/Notch信号通路的经典下游分子 Numb、Notch1、Hes1和 Hes5的表达。与未受辐射的细胞相比,受辐射的细胞中Numb的mRNA和蛋白表达量增加,Notch1、Hes1和Hes5的mRNA和蛋白表达量降低,差异均有统计学意义(P﹤0.05)。另外,随着辐射剂量的增加,Notch1、Hes1和Hes5的表达量降低。(图5)
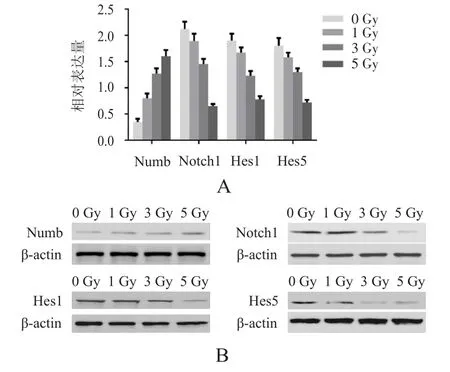
图5 不同剂量X射线作用对MIAPaCa-2胰腺癌细胞Numb/Notch信号通路相关蛋白表达水平的影响
3 讨论
早前已有相关研究表明Numb与肿瘤有关,且在不同类型肿瘤组织中表达有所不同。例如在肝癌、肺癌及唾液腺癌中Numb表达下降,而在星形细胞瘤和宫颈鳞状细胞癌中表达上调[8-9]。同时,Numb/Notch信号通路也在肿瘤发展进程及抗肿瘤治疗过程中扮演重要角色[10-12]。本研究的主要创新之处在于首次报道了Numb/Notch信号通路对人胰腺癌细胞株放疗敏感性的影响,具有新颖性。本研究通过培养人胰腺癌MIAPaCa-2细胞株,分别以0、1、3、5 Gy剂量辐射细胞,探讨Numb/Notch信号通路对人胰腺癌细胞株放疗敏感性的影响,为胰腺癌的治疗寻找新的靶标。本研究主要提示Numb蛋白及Numb/Notch信号通路在胰腺癌细胞中均呈激活状态,且Notch信号通路在胰腺癌细胞中激活的强弱与放射剂量的大小有关,本研究为深入了解胰腺癌发病的分子机制和寻找新的分子靶向治疗靶点奠定理论基础。
本实验细胞分为4组,对照组不作任何处理,其余3组接受不同剂量的电离辐射。具体分析发现:MTT实验和流式细胞术显示,随着辐射剂量的增加,人胰腺癌MIA PaCa-2细胞的增殖活力均有所下降,明显低于未受辐射的细胞,提示人胰腺癌细胞株在电离辐射下增殖活力具有剂量依赖性。细胞划痕实验和Transwell实验结果显示,随着辐射剂量的增加,MIA PaCa-2细胞的迁移和侵袭能力减弱,低于未受辐射的细胞,提示人胰腺癌细胞株MIA PaCa-2具有较高放疗敏感性。qRT-PCR和Western blot方法检测结果显示,细胞随着辐射剂量的增加,Numb表达量增加(P﹤0.05),Notch1、Hes1和Hes5的mRNA和蛋白表达量较未受辐射的细胞的表达量降低(P﹤0.05)。众所周知,靶向治疗时代的到来提示关注分子信号通路及其相关机制在肿瘤治疗中的作用[13-15]。细胞克隆增殖具有无节制的特点,调控细胞增殖、迁移、侵袭能力可有效逆转细胞生长周期,抑制肿瘤生长速度[16-17]。本研究发现,人胰腺癌细胞系在电离辐射下生长、迁移和侵袭能力具有剂量依赖性,且Numb/Notch信号通路在胰腺癌细胞中呈激活状态。Numb/Notch信号通路作为一种经典的信号通路,具有高度保守性[18]。Numb/Notch信号通路的激活能够上调下游Notch1表达,促进宫颈癌细胞的发展,而低表达的Notch1能够促使细胞凋亡减少[19];在非小细胞肺癌中,Notch2受体也呈现高表达[20]。在本研究中我们推测,电离辐射背景下,Numb/Notch信号通路通过上调Numb表达抑制Notch1、Hes1和Hes5表达,从而影响细胞生长、迁移和侵袭。
综上所述,Numb/Notch信号通路在胰腺癌细胞中的强弱与X射线放射剂量的大小和胰腺癌细胞对放疗的敏感程度有关。本研究意义在于证实Numb/Notch信号通路活性与胰腺癌放疗敏感性的关联,未来我们将设计相关阻断药阻断胰腺癌细胞中Numb/Notch信号通路,探究阻断Numb/Notch信号通路在提升放疗敏感性中的可行性及临床意义。
[1]盛伟伟,董明,刘峥嵘,等.Numb与上皮细胞间质转分化相关蛋白在胰腺癌中表达的相关性及其临床病理学意义[J].中华外科杂志,2016,54(12):929-934.
[2]Sheng W,Dong M,Zhou J,et al.Down regulation of CAII is associated with tumor differentiation and poor prognosis in patients with pancreatic cancer[J].J Surg Oncol,2013,107(5):536-543.
[3]盛伟伟,董明,周建平,等.Numb、MDM2和p53在胰腺癌中表达的相关性及临床病理学意义[J].中华外科杂志,2014,52(9):675-681.
[4]Gulino A,Di Marcotullio L,Screpanti I.The multiple functions of Numb[J].Exp Cell Res,2010,316(6):900-906.
[5]万健,唐才喜,冯斌,等.原发性肝癌中Numb和VEGF的表达及临床意义[J].中国普通外科杂志,2015,24(1):39-44.
[6]Rennstam K,Mcmichael N,Berglund P,et al.Numb protein expression correlates with a basal-like phenotype and cancer stem cell markers in primary breast cancer[J].Breast Cancer Res Treat,2010,122(2):315-324.
[7]Siddique HR,Feldman DE,Chen CL,et al.NUMB Phosphorylation Destabilizes p53 and Promotes Self-renewal of Tumor-Initiating Cells by NANOG-dependent Mechanism in Liver Cancer[J].Hepatology,2015,62(5):1466-1479.
[8]Maiorano E,Favia G,Pece S,et al.Prognostic implications of NUMB immunoreactivity in salivary gland carcinomas[J].Int J Immunopathol Pharmacol,2007,20(4):779-789.
[9]Chen H,Chen X,Ye F,et al.Symmetric division and expression of its regulatory gene Numb in human cervical squamous carcinoma cells[J].Pathobiology,2009,76(3): 149-154.
[10]Takebe N,Nguyen D,Yang SX.Targeting notch signaling pathway in cancer:clinical development advances and challenges[J].Pharmacol Ther,2014,141(2):140-149.
[11]苏进,邓小峰,刘波,等.Notch信号通路在胆管癌中的研究进展[J].中国普通外科杂志,2015,24(8):1175-1180.
[12]Pastò A,Serafin V,Pilotto G,et al.NOTCH3 signaling regulates MUSASHI-1 expression in metastatic colorectal cancer cells[J].Cancer Res,2014,74(7):2106-2118.
[13]李汛,白仲添.生物靶向分子在肝细胞癌治疗中的作用[J].西部医学,2014,26(7):817-821.
[14]Wang Z,Liu P,Chen Q,et al.Targeting AMPK signaling pathway to overcome drug resistance for cancer therapy[J].Curr Drug Targets,2016,17(8):853-864.
[15]Justilien V,Fields AP.Molecular pathways:novel approaches for improved therapeutic targeting of Hedgehog signaling in cancer stem cells[J].Clin Cancer Res,2015,21(3):505-513.
[16]叶静梅,谭获,李扬秋.弥漫性大B细胞淋巴瘤患者外周血T细胞受体Vα与T细胞受体Vβ亚家族T淋巴细胞的分布与克隆性增殖特点[J].国际输血及血液学杂志,2015,38(1):1-7.
[17]张宝芹.干细胞表面标志CD133在肝癌中的表达及其阳性亚群增殖特性[J].中国组织工程研究,2017,21(9):1319-1323.
[18]Ding X,Zhu F,Li T,et al.Numb protects renal proximal tubular cells from puromycin aminonucleoside-induced apoptosis through inhibiting notch signaling pathway[J].Int J Biol Sci,2011,7(3):269-278.
[19]Sun Y,Zhang R,Zhou S,et al.Overexpression of Notch1 is associated with the progression of cervical cancer[J].Oncol Lett,2015,9(6):2750-2756.
[20]Baumgart A,Mazur PK,Anton M,et al.Opposing role of Notch1 and Notch2 in a Kras(G12D)-driven murine nonsmall cell lung cancer model[J].Oncogene,2015,34(5):578-588.

