盐酸羟胺强化Fe(Ⅲ)-EDDS/过硫酸盐处理水溶液中TCE
顾小钢 (上海市城市建设设计研究总院(集团)有限公司,土壤修复研究中心,上海 200125)
近年来,随着我国城市化和工业化快速发展,城市中遗留了大量污染场地.氯代烃(如三氯乙烯,TCE)作为重要的化工原料和有机溶剂,由于生产、使用、存储等过程的不当操作[1],导致其成为污染场地检出率较高的有机污染物之一.
过硫酸盐(PS)是一种新型氧化剂,广泛用于治理场地有机污染物.过硫酸盐常温下比较稳定,在热、光、过渡金属、碱、过氧化氢等活化条件下,能够产生硫酸根自由基(SO4•−)、羟基自由基(•OH)、超氧阴离子自由基(O2•−)等活性氧自由基(ROS),从而有效降解目标污染物[2-7].与芬顿反应相似,Fe(Ⅱ)活化过硫酸盐(简写为Fe(Ⅱ)/PS,式1)具有速度快、成本低、易操作等优点,能够有效去除水溶液中的 TCE.但是,Fe(Ⅱ)直接活化过硫酸盐过程中铁有效性较低,存在 pH值适用范围窄、活性自由基易被过量Fe(Ⅱ)消耗、持续活化能力差等不足[8-9].
研究表明,加入螯合剂能可以提高铁有效性,强化过硫酸盐活化效率[10].乙二胺四乙酸(EDTA)是最常用的金属螯合剂之一,但其自身具有毒性且难以生物降解.S,S'-乙二胺-N,N'-二琥珀酸三钠(EDDS)是EDTA的同分异构体,具有易生物降解、环境友好的特点[11].作者前期研究发现,EDDS螯合Fe(Ⅲ)能够显著提高Fe(Ⅲ)/PS降解水溶液中 TCE的效率[12].但是,Fe(Ⅲ)-EDDS/PS体系受溶液 pH 值、Cl−和 HCO3−的影响仍比较明显.
铁活化高级氧化体系中加入还原性物质,如盐酸羟胺、硫代硫酸钠、抗坏血酸等,能够促进活化体系中 Fe(Ⅱ)循环再生,从而改善氧化剂活化效率及污染物去除效率[13].盐酸羟胺自身与氧化性自由基反应速率较低,且反应后生成的最终产物为无机物质,常用于强化铁活化高级氧化体系[12].研究表明,加入HAH能够显著提高Fenton或铁活化过碳酸盐氧化效率[13,15].此外,HAH也能够促进 Fe(Ⅱ)活化过硫酸盐工艺降解有机污染物[14,16-17].目前,尚无 HAH 强化 Fe(Ⅲ)活化过硫酸盐的研究.因此,本研究拟在前期关于Fe(Ⅲ)-EDDS/PS去除TCE的基础上,考察HAH强化Fe(Ⅲ)-EDDS/PS工艺降解TCE的效果,分析工艺参数(PS和 HAH初始浓度)及水质条件(初始pH值和阴离子)的影响,最后验证强化体系中活性氧自由基类型(主要考察 SO4•−、•OH 和O2•−),并探究其对TCE 降解的贡献度.
1 材料与方法
1.1 试剂及仪器
试剂:过硫酸钠、三氯乙烯、四氯化碳(CT)均为分析纯,购自国药集团化学试剂有限公司.EDDS(35%水溶液)购自 Sigma-Aldrich上海公司,盐酸羟胺、硫酸铁、正己烷、硝基苯、苯甲醚、异丙醇、叔丁醇、1,4-苯醌、氯化钠、碳酸氢钠、硫酸、氢氧化钠均为分析纯,购自阿拉丁试剂(试剂)有限公司.
主要仪器:气相色谱仪(Agilent 7890A)、磁力搅拌器(85-2,上海闵行虹浦仪器厂)、低温恒温槽(SDC-6,宁波新芝生物科技股份有限公司)、pH计(Mettler-Toledo DELTA320)、超纯水仪(ELGA Classic DI).
1.2 试验方法
采用带夹层的玻璃制圆柱体(内径 5cm、高12cm、有效容积250mL)作为反应器.反应器置于磁力搅拌器上,转速恒定为 600r/min,采用低温恒温槽控制反应温度为(20±0.5)℃.硫酸铁与EDDS混合搅拌15min后,将其加入TCE水溶液,最后投加过硫酸盐开始反应,反应液总体积为250mL(实验时间内 TCE挥发量<3%).既定时间取样分析,每组实验设 2个平行.考察溶液初始pH值影响时,采用 0.1mol/L NaOH和 0.1mol/L H2SO4调节,其他反应均不调节溶液 pH 值.所有溶液均采用超纯水配制,TCE初始浓度为0.15mmol/L.根据前期研究结果,本研究中Fe(Ⅲ)/EDDS物质的量比设为 4/1,Fe(Ⅲ)初始浓度为1.8mmol/L.
1.3 分析方法
试验中采用气相色谱仪测定三氯乙烯、四氯化碳、硝基苯、苯甲醚浓度.三氯乙烯和四氯化碳采用DB-VRX色谱柱(长60m、内径250µm、膜厚1.4µm)、ECD检测器分析,进样口与检测器温度分别为 240、260℃,柱温 75℃,进样量 1µL,分流比 20:1.硝基苯和苯甲醚采用 HP-5色谱柱(长30m、内径250µm、膜厚0.25µm)、FID检测器分析,进样口与检测器温度分别为200、250℃,柱温150℃,进样量1µL,分流比20:1.过硫酸盐和溶解性铁离子浓度分别采用碘化钾、邻菲啰啉分光光度法测定.
2 结果与讨论
2.1 HAH强化Fe(Ⅲ)-EDDS/PS降解TCE的效果
图 1显示了 TCE 在 Fe(Ⅲ)/PS、Fe(Ⅲ)-EDDS/PS和Fe(Ⅲ)-EDDS/PS/HAH体系中的降解效果, 过硫酸盐和盐酸羟胺投加量均为7.5mmol/L.Fe(Ⅲ)/PS体系中,60min内TCE去除率为 12.8%,表明 Fe(Ⅲ)直接活化过硫酸盐效率较低.Fe(Ⅲ)-EDDS/PS体系中,反应前0.5min内TCE去除率为12.4%,之后TCE去除率缓慢升高至75.3%(60min),表明加入EDDS能够有效提高溶液中铁有效性,提高 TCE去除率.Fe(Ⅲ)-EDDS/PS体系中进一步加入 HAH后,能够明显强化TCE去除效率.60min内TCE基本完全降解,且前 0.5min内去除率达 89.0%.由此推断,加入HAH能够促进Fe(Ⅲ)还原为Fe(Ⅱ),进而强化过硫酸盐活化效果.Zou等[18]研究发现HAH不仅能加速 Fe(Ⅱ)/Fe(Ⅲ)循环,还可以强化活性氧自由基产率,从而促进 Fe(Ⅱ)活化过一硫酸盐降解苯甲酸.

图1 HAH强化Fe(Ⅲ)-EDDS/PS降解TCE的效果Fig.1 HAH enhancing Fe(Ⅲ)-EDDS/PS for TCE degradation
2.2 过硫酸盐、盐酸羟胺初始浓度的影响
Fe(Ⅲ)/EDDS物质的量比设为4/1,考察过硫酸盐和盐酸羟胺初始浓度对TCE降解效果的影响.由图2a可以看出,不投加过硫酸盐时TCE基本不发生降解,过硫酸盐浓度由1.50mmol/L增加到7.50mmol/L时,TCE去除率随过硫酸盐浓度升高而增强,60min内去除率分别达71.2%、93.8%和99.7%.继续增加过硫酸盐浓度至11.25mmol/L,TCE降解效果没有进一步增强.因此后续实验将过硫酸盐初始浓度设为7.50mmol/L.
HAH除了能够促进Fe(Ⅱ)/Fe(Ⅲ)循环,还能通过非自由基途径消耗过硫酸盐,并且 HAH中的 Cl−可能与 SO4•−反应生成低活性自由基[16].因此,考察了HAH初始浓度对TCE降解效果的影响,结果如图2b所示.实验条件下,加入HAH显著提高了 Fe(Ⅲ)-EDDS/PS工艺降解 TCE的效率,TCE去除率随 HAH浓度(1.50~7.50mmol/L)增大而升高.HAH初始浓度为 7.50mmol/L时,60min内TCE基本完全去除.继续增加HAH投加量至11.25mmol/L,0~10min内TCE降解效率受到轻微抑制,10~60min 降解效果与7.50mmol/L相近.因此,适量的 HAH 能够促进Fe(Ⅱ)再生,有利于活化过硫酸盐,而 HAH 浓度过高时可能抑制 TCE降解,后续实验中将 HAH浓度设为7.50mmol/L.
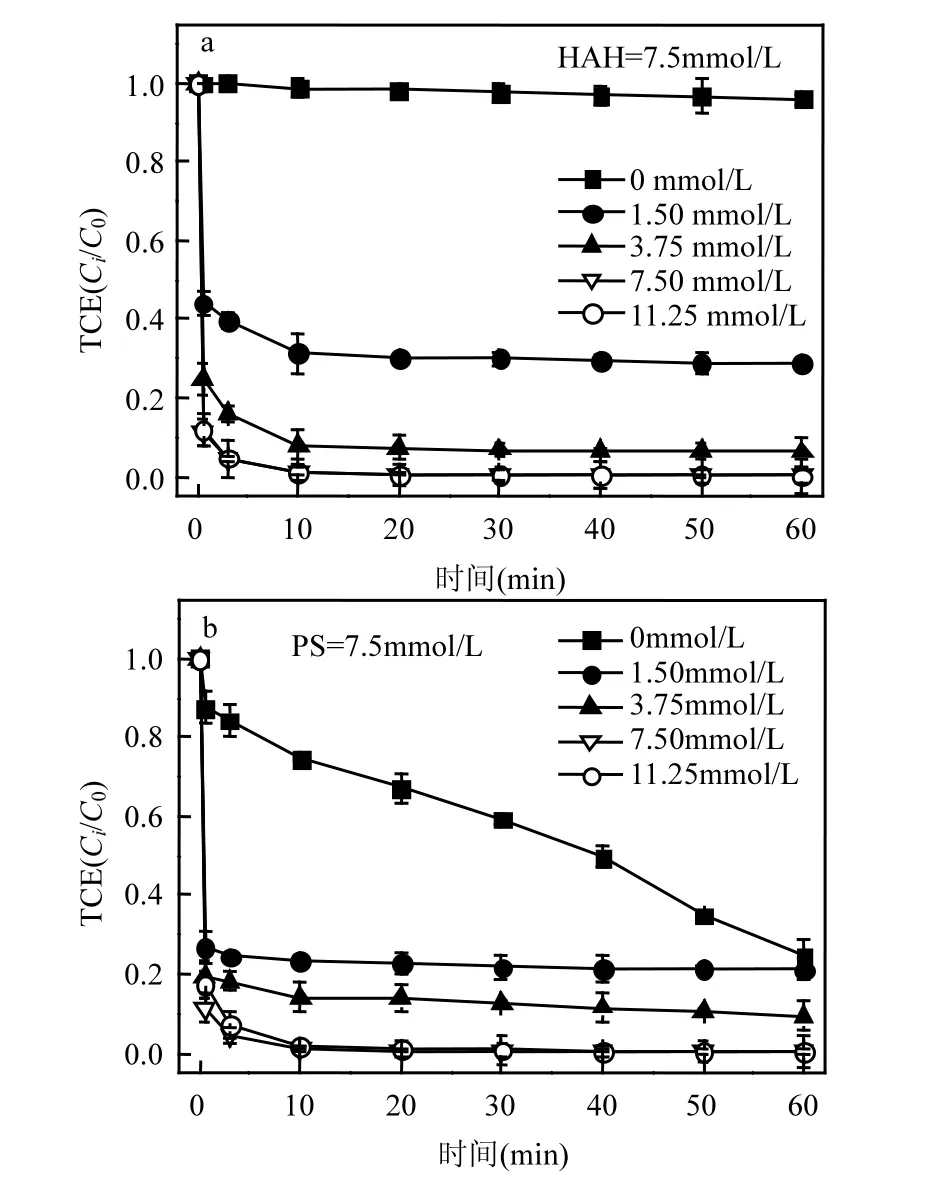
图2 PS、HAH初始浓度对TCE降解效果的影响Fig.2 Effects of PS or HAH initial concentration on TCE degradation
2.3 溶液初始pH值的影响
考察了溶液(含 Fe(Ⅲ)-EDDS、TCE、HAH的溶液)初始pH值对Fe(Ⅲ)-EDDS/PS/HAH降解TCE的影响(图3).原始溶液初始pH值为2.7,加入过硫酸盐反应60min后降至1.6.实验调节初始pH值为3、5、7时,对TCE降解基本没有影响,反应60min后TCE均基本完全去除,此时溶液pH值下降至2.0~2.2.但是,调节溶液初始pH值为8、9、11,反应终止时 TCE去除率均低于 30%,而此时溶液pH值也维持在较高值(6.4~7.2).由此可见,初始溶液为酸性或中性,反应终止时 pH<3,对Fe(Ⅲ)-EDDS/PS/HAH降解TCE基本没有影响;而当溶液初始 pH值为碱性(pH=8、9或 11)时, TCE降解受到明显抑制,且在这种情况下,反应终止时溶液pH值均<6.

图3 溶液初始pH值对TCE降解效果的影响Fig.3 Effect of initial solution pH on TCE degradation
2.4 Cl−和 HCO3−的影响
由于Cl−和HCO3−均能够消耗体系中产生的SO4•−或•OH[19],因此选择 Cl−和 HCO3−为代表,考察地下水阴离子对 Fe(Ⅲ)-EDDS/PS/HAH降解TCE的影响.作者前期研究发现[12], Fe(Ⅲ)-EDDS/PS体系中加入 1~100mmol/L 的 Cl−后,TCE降解率由97.0%下降至30.9%.但在本研究中,加入低浓度 Cl−(1、10mmol/L),对 TCE 降解基本没有影响(图 4a).Cl−投加量为 100mmol/L时,60min内 TCE去除率仍达 92.6%.表明在Fe(Ⅲ)-EDDS/PS体系加入HAH后,不仅能够有效促进TCE降解,同时能够降低Cl−对TCE降解的抑制作用.
图 4b 为 HCO3−对 Fe(Ⅲ)-EDDS/PS/HAH 降解 TCE 的影响.当 HCO3−浓度为 1、10mmol/L时,60min内 TCE降解基本不受影响,此时溶液pH 值均<2.5.增加 HCO3−浓度至 25、50、100mmol/L则明显抑制TCE降解,60min内TCE去除率分别为 27.7%、23.7%、19.8%,并且反应终止时溶液pH值均>6.反应终止时TCE去除率和溶液 pH值的关系与 2.3节结论一致.因此,Fe(Ⅲ)-EDDS/PS/HAH体系中加入高浓度HCO3−(25~100mmol/L)不仅会消耗活性氧自由基,同时能够改变溶液pH值,从而抑制TCE降解.需要注意的是,Fe(Ⅲ)-EDDS/PS体系中加入10mmol/L的HCO3−能够明显抑制TCE降解[12],而加入 HAH后能够缓解低浓度 HCO3−对 TCE降解的抑制作用.
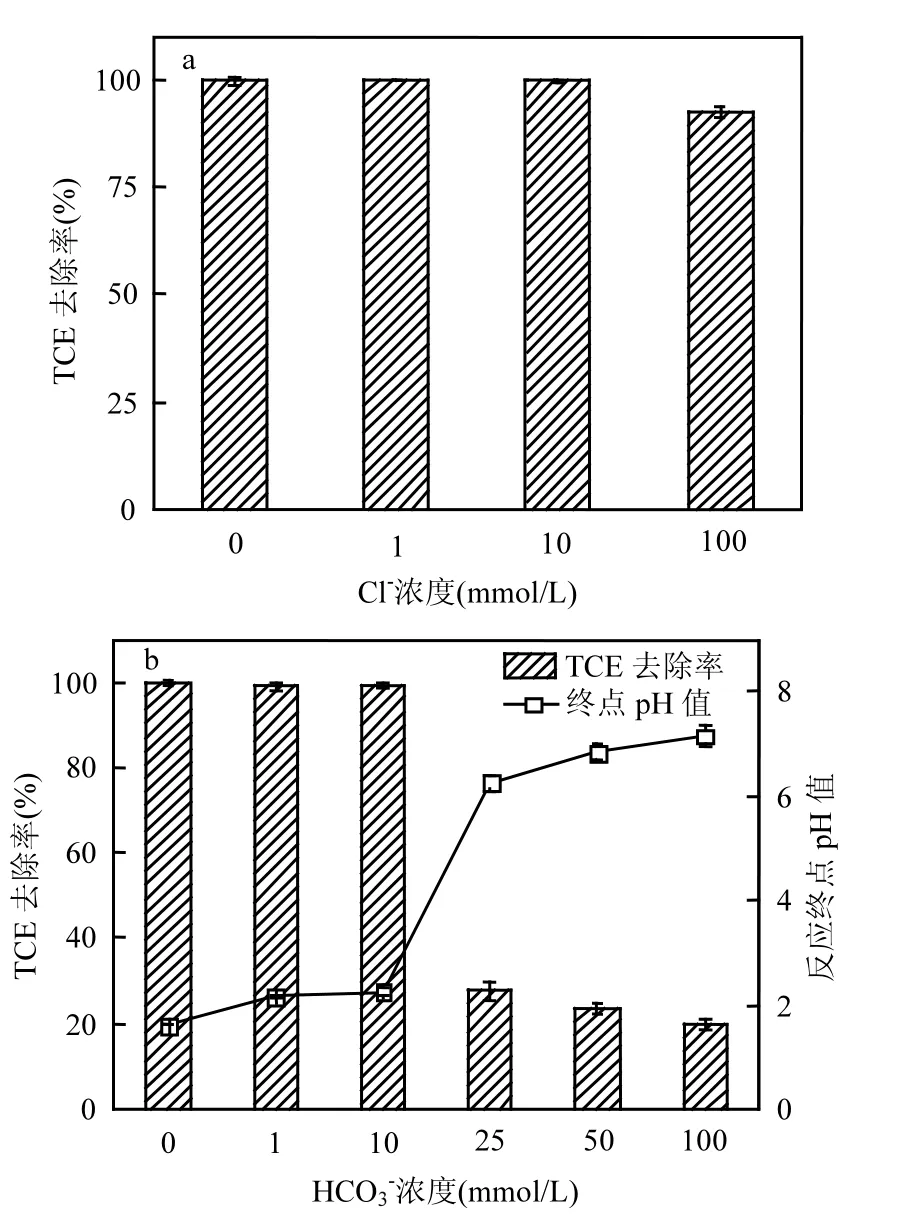
图4 Cl−和HCO3−对TCE降解效果的影响Fig.4 Effect of Cl− or HCO3− on TCE degradation
2.5 活性氧自由基鉴定
2.5.1 化学探针降解实验(无 TCE) 通过Fe(Ⅲ)-EDDS/PS/HAH 体系中自由基探针降解情况,判断可能存在的活性氧自由基.选择硝基苯作 为•OH 探 针 (k•OH=3.9×109L/(mol·s), kSO4•−<106L/(mol·s))[20],苯甲醚作为 SO4•−和•OH 的共同探 针 (k•OH=6.0×109L/(mol·s), kSO4•−=4.9×109L/(mol·s))[20],四 氯 化 碳 作 为 O2•−探 针 (kO2•−=1.6×1010L/(mol·s))[21],硝基苯、苯甲醚、四氯化碳初始浓度分别为2、2、0.05mmol/L.反应时间为240min,结果如图5所示.前期空白实验表明,硝基苯与苯甲醚在反应时间内基本无挥发,四氯化碳空白挥发损失 9.1%.240min内,硝基苯去除率为16.5%,推断体系中存在•OH;苯甲醚去除率为25.9%,则反应过程中至少存在 SO4•−或•OH 中的一种.为进一步验证 SO4•−,在苯甲醚降解过程中加入过量的叔丁醇(2mol/L),以完全消耗溶液中的•OH,而不消耗 SO4•−(k•OH=5.2× 108L/(mol·s),kSO4•−<106L/(mol·s))[20].结果显示,加入叔丁醇后苯甲醚降解效果受到抑制,但仍有17%去除率,表明该体系中同时存在 SO4•−和•OH.反应终止时,四氯化碳去除率为 69.1%(其中挥发损失 9.1%),表明 Fe(Ⅲ)-EDDS/PS/HAH 能够产生 O2•−.Miao等[15]研究了多种还原剂对 Fe(Ⅱ)、Fe(Ⅲ)活化过碳酸钠降解四氯乙烯的影响,发现加入 HAH对生成O2•−具有促进作用.

图5 自由基探针的降解效果Fig.5 The degradation performance of radical probe compounds
2.5.2 自由基清扫实验(含 TCE) 为进一步判断 SO4•−、•OH、O2•−各自对 TCE 降解的贡献情况,在Fe(Ⅲ)-EDDS/PS/HAH降解TCE体系中针对性的加入自由基清扫剂,通过对TCE降解的抑制程度判断各自由基的贡献度.选择叔丁醇作为•OH 清扫剂(k•OH=5.2×108L/(mol·s), kSO4•−<106L/(mol·s)),异丙醇作为 SO4•−和•OH 共同清扫剂(k•OH=2.0×109L/(mol·s),kSO4•−=8.2×107L/(mol·s))[20],1,4- 苯 醌 作 为 O2•−清 扫 剂 (kO2•−=9.6×108L/(mol·s))[22],叔丁醇、异丙醇、1,4-苯醌初始浓度分别为300、500、50mmol/L.反应时间为60min,结果如图 6所示.前期实验表明清扫剂浓度均过量,可认为能够完全清扫相对应的自由基.与控制组相比,加入叔丁醇后TCE去除率下降了28.5%(99.7%~71.2%),由此推断•OH 对 TCE降解的贡献度为 28.5%.加入 IPA后 TCE去除抑制率为78.0%(99.7%~21.7%),表明SO4•−与•OH的总贡献度为 78.0%,则 SO4•−贡献度为 49.5%(78.0%~28.5%).假定 TCE 降解只受 SO4•−、•OH、O2•−作用,则可推断出 O2•−贡献度为 22.0%(100%~78%).但是,加入 1,4-苯醌后 TCE去除率与控制组相比下降了 48.5%(99.7%~51.2%),与异丙醇实验组推算结果存在差异.可能是由于1,4-苯醌消耗了部分 SO4•−或•OH,导致 TCE 去除率下降,这也与作者前期的试验结论一致[12].因此,Fe(Ⅲ)-EDDS/PS/HAH 体系中 TCE 降解由 SO4•−、•OH、O2•−共同作用所致,其中 SO4•−为主导自由基,根据清扫实验推算结果,SO4•−、•OH、O2•−的贡献度分别为49.5%、28.5%和22.0%.需要指出的是,Fe(Ⅲ)-EDDS/PS体系中 TCE降解的主导自由基为•OH[12],加入 HAH 后,主导自由基转变为SO4•−.

图6 自由基清扫剂对TCE降解效果的影响Fig.6 Effect of radical scavengers on TCE degradation
3 结论
3.1 Fe(Ⅲ)-EDDS/PS体系中加入HAH能够强化TCE去除效率.
3.2 溶液初始pH值为酸性或中性时,TCE去除几乎没有影响,碱性条件下TCE降解受到抑制.
3.3 Cl−(1~100mmol/L)和 低 浓 度 HCO3−(1~10mmol/L)对 TCE降解基本没有影响,高浓度HCO3−(25~100mmol/L)抑制效果明显.
3.4 Fe(Ⅲ)-EDDS/PS体系中加入HAH后SO4•−产率增强,TCE降解的主导自由基由•OH转变为SO4•−.
参考文献:
[1]陆 强,李 辉,林匡飞,等.上海浦东某氯代烃场地地下水污染现状调查 [J]. 环境科学学报, 2016,36(5):1730-1737.
[2]Matzek L W, Carter K E. Activated persulfate for organic chemical degradation: A review [J]. Chemosphere, 2016,151:178-188.
[3]朱思瑞,高乃云,鲁 仙,等.热激活过硫酸盐氧化降解水中双酚A [J]. 中国环境科学, 2017,37(1):188-194.
[4]骆靖宇,李学艳,李青松,等.紫外活化过硫酸钠去除水体中的三氯卡班 [J]. 中国环境科学, 2017,37(9):3324-3331.
[5]张丽娜,钟 华,张俊涛,等.热,碱和 Fe3O4激活过硫酸钠降解二恶烷的对比研究 [J]. 中国环境科学, 2017,37(10):3741-3747.
[6]郭佑罗,关小红,高乃云,等.紫外/过硫酸盐工艺降解水中氯贝酸的研究 [J]. 中国环境科学, 2016,36(7):2014-2019.
[7]刘佳露,卢 伟,张凤君,等.活化过硫酸盐氧化地下水中苯酚的动力学研究 [J]. 中国环境科学, 2015,35(9):2677-2681.
[8]Ahn S, Peterson T D, Righter J, et al. Disinfection of ballast water with iron activated persulfate [J]. Environmental Science &Technology, 2013,47(20):11717-11725.
[9]Liang C, Bruell C J, Marley M C, et al. Persulfate oxidation for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate–thiosulfate redox couple [J]. Chemosphere,2004,55(9):1213-1223.
[10]Wu X, Gu X, Lu S, et al. Degradation of trichloroethylene in aqueous solution by persulfate activated with citric acid chelated ferrous ion [J]. Chemical Engineering Journal, 2014,255:585-592.
[11]Huang W, Brigante M, Wu F, et al. Assessment of the Fe(III)–EDDS complex in fenton-like processes: From the radical formation to the degradation of bisphenol A [J]. Environmental Science & Technology, 2013,47(4):1952-1959.
[12]Gu X, Wang Y, Miao Z, et al. Degradation of trichloroethylene in aqueous solution by persulfate activated with Fe(III)–EDDS complex[J]. Research on Chemical Intermediates, 2017,43(1):1-13.
[13]Chen L, Ma J, Li X, et al. Strong enhancement on fenton oxidation by addition of hydroxylamine to accelerate the ferric and ferrous iron cycles [J]. Environmental Science & Technology,2011,45(9):3925-3930.
[14]Wu X, Gu X, Lu S, et al. Strong enhancement of trichloroethylene degradation in ferrous ion activated persulfate system by promoting ferric and ferrous ion cycles with hydroxylamine [J].Separation and Purification Technology, 2015,147:186-193.
[15]Miao Z, Gu X, Lu S, et al. Enhancement effects of reducing agents on the degradation of tetrachloroethene in the Fe(II)/Fe(III)catalyzed percarbonate system [J]. Journal of Hazardous Materials, 2015,300:530-537.
[16]Han D, Wan J, Ma Y, et al. Enhanced decolorization of orange G in a Fe(II)-EDDS activated persulfate process by accelerating the regeneration of ferrous iron with hydroxylamine [J]. Chemical Engineering Journal, 2014,256:316-323.
[17]Tan C, Gao N, Chu W, et al. Degradation of diuron by persulfate activated with ferrous ion [J]. Separation and Purification Technology, 2012,95:44-48.
[18]Zou J, Ma J, Chen L, et al. Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(III)/Fe(II) cycle with hydroxylamine [J].Environmental Science & Technology, 2013,47(20):11685-11691.
[19]Criquet J, Leitner N K V. Degradation of acetic acid with sulfate radical generated by persulfate ions photolysis [J]. Chemosphere,2009,77(2):194-200.
[20]Liang C, Su H-W. Identification of sulfate and hydroxyl radicals in thermally activated persulfate [J]. Industrial & Engineering Chemistry Research, 2009,48(11):5558-5562.
[21]Lutze H V, Bakkour R, Kerlin N, et al. Formation of bromate in sulfate radical based oxidation: Mechanistic aspects and suppression by dissolved organic matter [J]. Water Research,2014,53:370-377.
[22]Monteagudo J M, Durán A, San Martin I, et al. Roles of different intermediate active species in the mineralization reactions of phenolic pollutants under a UV-A/C photo-fenton process [J].Applied Catalysis B: Environmental, 2011,106(1/2):242-249.

