超声强化作用下厌氧氨氧化工艺启动运行性能
张典典,汪 涛,邵敬敬,李 琳,王志强 (河北工业大学能源与环境工程学院,天津 300401)
随着人类社会的发展,大量含有氮、磷的废水排入天然水体,使水体富营养化问题日益严重,赤潮和水华等水生态失衡现象频频出现.氮素污染源中的主要污染物是氨态氮,因此加强高氨氮污水的处理对防治水体富营养化至关重要.但是,传统的硝化反硝化脱氮工艺在处理高浓度氨氮废水时,往往需要在反硝化阶段投加有机碳源作为电子受体,在硝化阶段进行曝氧,同时需要进行酸碱性调节,这就大大增加了工艺的运行成本;剩余污泥产量高,进一步增加了污泥处置费用[1].
厌氧氨氧化(Anammox)是一种适合处理高氨氮、低C/N废水的新型污水生物脱氮工艺.它的基本原理是 Anammox菌在厌氧环境中以NO2--N为电子受体,氧化 NH4+-N同时生成 N2的生物反应过程[2].功能菌种为自养厌氧型,生长缓慢,与传统的脱氮工艺相比,可大幅节约有机碳源和曝氧的成本[3],减少剩余污泥量.该工艺因其操作简单、脱氮效率高、无二次污染等诸多优点受到了水处理领域研究学者的青睐.然而,Anammox菌的生长代谢极其缓慢(生长速率为0.0003h-1)[2],世代时间长达11d,致使Anammox工艺的启动周期冗长,而且启动过程中对外界环境如溶解氧(DO)、有机物、pH值和温度等因素的变化敏感度高[4-5],如何实现Anammox工艺的快速启动和稳定运行是实现Anammox工业化应用需要克服的重要难题.
为解决上述问题,研究学者试图从添加化学药剂、施加物理能场等方面提高Anammox菌活性,加快Anammox启动进程.Yin等[6]向上升流固定床反应器接种传统活性污泥和石墨烯的混合物,石墨烯浓度为 100mg/L,运行温度为 35℃,pH值为7.0左右,DO低于0.5mg/L,在进水氮负荷为460gN/(m3⋅d)的情况下,Anammox 启动耗时由67d缩短至 49d.Liu等[7]在填有无纺布填料的固定床反应器外设置永久磁场,磁场强度为 60mT,操作温度为 35℃,pH 值为(8.0±0.1),DO 小于0.05mg/L,结果发现,永磁场的施加能使Anammox启动周期缩短 1/4,当启动阶段的总氮容积负荷为 2000mgN/(L⋅d)时,总氮去除负荷由无 磁 场 添 加 的 1200~1482mgN/(L⋅d)提 高 至1600~1780mgN/(L⋅d),提高了 30%.
超声波是一种声能场,具有作用条件温和、无二次污染、适用范围广等诸多优点.低强度、低频率超声波能产生和缓的空化作用,可通过改善微生物细胞膜的通透性、提高生物酶活性和加快电子传递速率等来增强目标微生物的生长活性和菌群竞争力[8].基于此,本研究利用超声波强化 Anammox菌活性,通过超声波批式实验筛选出最优的超声参数,在最优的超声辐照条件下采用固定床反应器接种传统活性污泥启动Anammox工艺,从Anammox启动周期和脱氮性能等方面考察超声强化 Anammox启动和运行过程.
1 材料和方法
1.1 实验装置和接种污泥
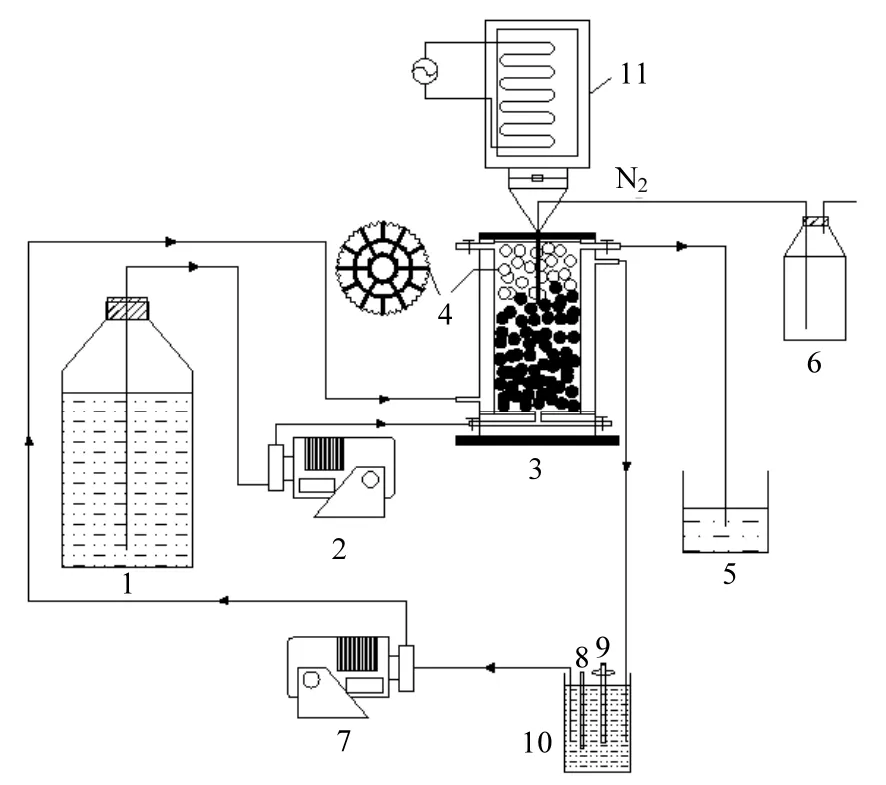
图1 实验装置Fig.1 The diagram of experimental device
本实验采用有机玻璃材质的固定床反应器,有效容积为 2.6L,见图1.反应器外部设置超声波发生器,超声波振子没入反应器内液面以下.反应器设有有机玻璃外管套,恒温热水在外管套中循环,维持反应器温度在 35℃左右.恒温热水来自恒温水箱,通过恒温加热棒实现温度控制.恒温水箱内的水温由温度计实时监控,避免温度波动对Anammox反应性能带来的干扰.反应器内部随机填满蜂窝状聚丙烯填料,该填料外形为高1.2cm,直径为 2.5cm 的柱体,密度与水相近,圆形断面呈辐射状分布有大小近似的19孔,边缘呈现锯齿状凸起.这种载体填料的优势在于:作为支撑骨架,承托上部重力沉降至下部的污泥,促进菌群富集,多孔结构和凸起增大了其比表面积,进一步增加了细菌截留能力;形成排气通路,及时排出产物氮气,避免气压过大对生物膜产生不利影响;气泡排出的过程中对载体上生物膜有一定冲刷作用,能促进生物膜的动态更新与底物和产物的传质作用.反应器及管路的各个接口和连接处密封完好,保证系统的厌氧环境.主体装置用黑布包裹,避免光照对Anammox菌的不利影响.
实验接种污泥为天津某污水处理厂的好氧活性污泥,混合液悬浮固定浓度(MLSS)为2317mg/L,混合液挥发性悬浮固定浓度(MLVSS)为1853mg/L,MLVSS/MLSS为79.97%.
1.2 超声波批式实验
在进行 Anammox启动实验前,首先进行了批式实验,摸索超声波强化 Anammox菌活性最优的超声辐照条件.实验所用污泥为成功驯化的Anammox污泥.取 6个 100mL锥形瓶,初始Anammox污泥浓度为0.1gVSS/L.超声波频率为25kHz.超声辐射强度范围为 0~0.5W/cm,强度梯度为0.1W/cm.超声波作用时长为1,3,5min.
1.3 实验用水和运行方式
根据 Van de Graaf[9]和 Strous[10]提供的配方,Anammox培养基成分见表1.实验中每2d更新一次实验进水,避免进水瓶中杂菌的干扰.
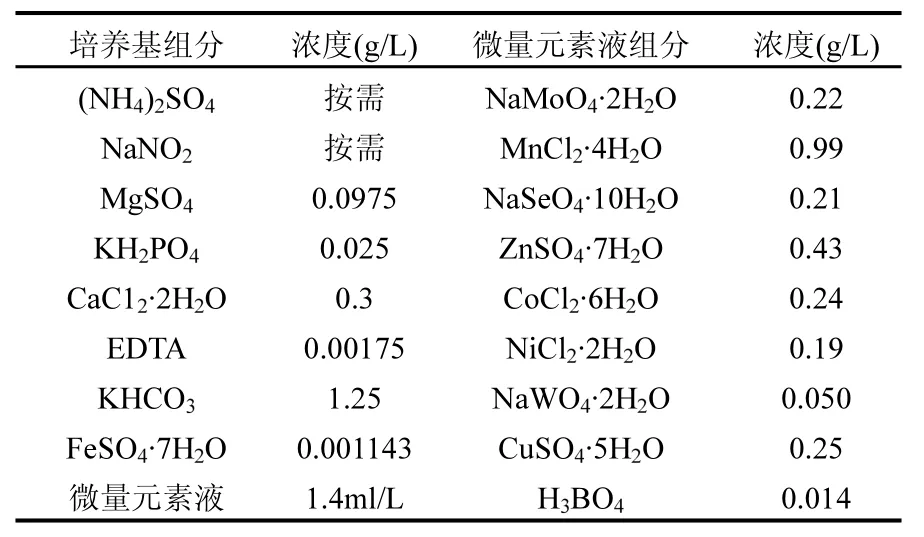
表1 厌氧氨氧化培养基Table 1 Anammox nutrient medium
模拟废水从反应器底部进入,经短暂混匀后自下而上流经反应器,在接近顶部的出水口处溢流出水.在启动过程中,进水 NH4+-N 和 NO2--N浓度维持在 70mg/L.水力停留时间(HRT)固定为2d,始终控制pH值在8.0左右,温度维持在最适温度 35℃.在负荷提高阶段,根据反应器的去氮性能,通过逐步将进水 NH4+-N和 NO2--N浓度由70mg/L提升至 380mg/L的方法加大进水负荷.整个运行期间,每周对驯化污泥进行 1次超声波辐照,辐照条件以超声波批式实验得出的最优条件为准.
1.4 分析项目及方法
NH4+-N:纳氏试剂分光光度计法(721E型可见分光光度计);NO2--N:N-(1-萘基)-乙二胺分光光度法(721E型可见分光光度计);NO3--N:酚二磺酸光度法(紫外可见分光光度计);pH值和温度:玻璃电极法(MIK-PH100型便携式pH计).
2 结果与讨论
2.1 超声波批式实验结果
通过 Design-Expert响应曲面法作出Anammox活性随超声作用时间和超声强度的变化关系图,如图 2所示.响应曲面拟合出Anammox活性公式,见公式1.模型的F值为4.56,说明该模型的显著性较好;p值为 1.46%,意味着仅有1.46%的变异不能由该模型解释.

式中:Ut为超声时间;Ui为超声强度.
实验中,超声频率为固定值 25kHz.当 Ut为1,3,5min时,随着 Ui由 0增大至 0.5W/cm,Anammox活性都呈现先升高再降低的趋势.过长的Ut和过大的Ui会降低Anammox活性,如在0.5W/cm的超声强度下超声5min,Anammox活性为29.73chongc,与对照组相比,Anammox活性降低了 7.26%.当 Ut为 3min,Ui为 0.2W/cm时,Anammox活性达到最大值,其值为 38.80mgN/(gVSS⋅d),与不加超声波的对照组相比,此时Anammox活性提高率为最大值20.95%.因此,通过批式实验筛选出的最优超声参数为:超声频率25kHz,Ut 3min,Ui 0.2W/cm.而通过响应曲面预测的最优值为 36.33mgN/(gVSS⋅d),Ut 2.86min,Ui 0.22W/cm,与本实验结果近似.后续Anammox启动实验是在实测的最优超声工作条件(超声频率为 25kHz、Ut为 3min、Ui为0.2W/cm)下进行.

图2 厌氧氨氧化活性随超声时间和超声强度的变化关系Fig.2 Variations relationship of Anammox activity along with time and intense of ultrasonic
2.2 Anammox启动进程
2.2.1 氮素浓度变化 进水NH4+-N和NO2--N浓度为70mg/L,HRT为2d,控制温度条件为35℃,pH8.0左右.经过53d的运行,成功启动Anammox工艺.整个启动过程可分为3个时期,分别为污泥转换期(1~23d)、停滞期(24~37d)和活性表现期(38~53d),如图 3 所示.
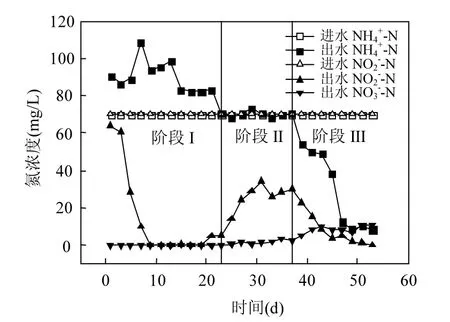
图3 启动阶段氮浓度随时间的变化Fig.3 Variations of nitrogen concentration with time during the start-up stage
污泥转换期,出水NH4+-N极不稳定,但始终高于进水 NH4+-N,最高出水 NH4+-N浓度为108.73mg/L,比进水 NH4+-N浓度高 38.73mg/L.出水NO2--N浓度在运行第3d时急剧降低,至第9d时,出水NO2--N已经基本上完全去除.出水基本不含NO3--N.在运行第一周,反应器COD浓度较高,其范围在 132~238mg/L.考虑到进水为无机配水,其中基本不含有机物,如此高的 COD 可能来源于不适应环境条件的好氧异养细菌细胞自溶产物.上述现象在其他文献中也有报道,且细胞自溶产生 COD这一过程也已得到证实[11].究其原因,主要归结于以下几个方面:(1)本实验接种污泥为好氧活性污泥,厌氧驯化条件严重抑制了好氧菌的生长,致使大多数好氧菌自溶,有机物质被分解代谢并以 NH4+-N的形式随出水流出,从而出现出水NH4+-N高于进水NH4+-N的情况;(2)厌氧条件为反硝化菌的生长提供了保障,它们利用好氧菌自溶产生的有机物作为电子供体,将NO2--N还原为 N2,实现 NO2--N的去除.在这一时期,反应器内以反硝化脱氮为主,并未观察到Anammox过程的迹象.
停滞期主要表现在进出水 NH4+-N浓度近似相等,出水NO2--N明显升高,运行第31d时出水NO2--N浓度达到最大值,最大值为34.23mg/L,一周之后NO2--N浓度稳定在30mg/L左右,出水中有少量的 NO3--N.随着时间的推移,进水不断向反应器内提供不含有机碳源的底物,可供反硝化菌利用的有机电子供体越来越少,部分反硝化菌进行内源代谢以维持自身活性,宏观上表现为NO2--N 去除性能变差.同时,反应器内有少量Anammox菌得以生长,因此出水中含NO3--N.这一时期,反硝化作用逐渐减弱,Anammox活性还很小.宋雨夏等[12]报道的 Anammox启动停滞期为83d,而本研究停滞期持续时间仅为14d.
反应器运行至第38d进入活性表现期.该时期内,NH4+-N和NO2--N同时去除,伴有NO3--N的产生,这是Anammox活性表现的典型标志.由图3可知,在活性表现期,进水NH4+-N和NO2--N浓度保持恒定,出水NH4+-N和NO2--N浓度迅速降低,最终分别趋于10mg/L和0mg/L,出水NO3--N稳定在11mg/L.Anammox菌已经成功得到富集,Anammox反应成为反应器内的主要脱氮途径.Anammox工艺启动耗时53d,而其他文献所报道的Anammox启动用时则在 60d以上[13-14],体现出本实验启动Anammox工艺的时间优势.Anammox菌具有一种特殊的膜结构细胞器-厌氧氨氧化体,它为Anammox菌所特有,主要功能是完成 NH4+-N 和NO2--N 的生物转化[15].在本实验中,每周对培养污泥进行一次超声辐照,超声波产生的局部空化作用能在一定程度上改善 Anammox菌细胞膜和厌氧氨氧化体膜的通透性能,增强 Anammox菌的内外传质作用,从而提高Anammox菌的活性[16],大大缩短Anammox启动周期.
2.2.2 氮素去除情况变化 图 4反映了各氮素去除情况随时间的变化关系.运行过程中,进水NH4+-N和NO2--N浓度负荷维持在 35mgN/(L⋅d),HRT 恒为 2d.图 4a 显示,在污泥转换期,NH4+-N去除速率极不稳定,最低去除速率为第7d 的-19.37mgN/(L⋅d),而 NO2--N去除速率则迅速提高,并稳定在 34.97mgN/(L⋅d),最大 NO2--N去除率为 100%,这与图 3的分析结果保持一致.在停滞期,NH4+-N去除速率基本为 0mgN/(L⋅d),但NO2--N去除速率呈下降趋势,说明反硝化菌群的脱氮能力在逐渐下降.活性表现期,NH4+-N去除速率明显提高,最终稳定在 30mgN/(L⋅d)左右,NO2--N去除速率也回升至35mgN/(L⋅d)左右.第53d时,NH4+-N去除率为88.03%,NO2--N去除率为99.91%,实现了NH4+-N和NO2--N的同步高效去除.图4b中进水总氮负荷维持在70mgN/(L⋅d),总氮去除速率和总氮去除率的变化趋势相似,都是先逐渐升高,在停滞期短暂下降,后又回升.启动期末(运行第53d)的总氮去除速率和总氮去除率达到了60.34mgN/(L⋅d)和86.20%.
2.2.3 化学计量比变化 化学计量比可用于指示 Anammox反应进程.活性表现期内参加反应的各氮素化学计量比变化关系如图 5所示.其中,R1表示参加反应的 NO2--N与NH4+-N之比,R2表示反应生成的 NO3--N与参加反应的NH4+-N之比.

图4 启动阶段氮素去除情况随时间的变化Fig.4 Variations of nitrogen removal rates with time in the Anammox start-up stage
在运行第39~43d,R1在2.8左右波动,之后在4d内迅速降低至1.3左右,后续几天的运行中,R1稳定在 1.14,接近于 van de Graff等[9]报道的理论值1.32.R2变化较为平缓,先逐渐升高至0.5左右后缓慢下降,最后逐渐趋于0.18,低于理论值0.26[9].R1和R2都比理论值小,可能是由反应器内存在硝化细菌所致.运行过程中,水封口倒吸或操作不规范使反应系统内进氧,缺氧环境下硝化菌得以生存,并与Anammox菌竞争底物NH4+-N,同时生成NO3--N产物,导致 NO3--N 的产量偏高.Lu等[14]也曾报道过典型化学计量比偏低的现象.本实验中,仅经过2周的运行化学计量比就基本稳定于 Anammox反应系数比,这得益于外施加的超声波作用.超声波温和的空化作用能改善Anammox菌细胞内各种膜的通透性能,促进代谢底物吸收和代谢产物释放,并且能加快电子传递速率,提高 Anammox菌活性,从而能使反应器在短期内启动Anammox工艺[16].
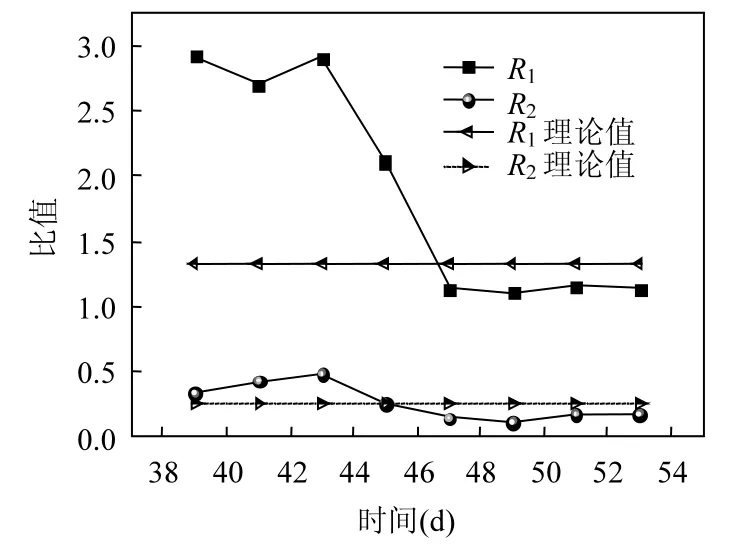
图5 活性提高期化学计量比随时间的变化Fig.5 Variations of the stoichiometric ratios with time during the activity improvement period
2.3 Anammox负荷提高过程
2.3.1 负荷提高期氮素浓度变化 Anammox工艺成功启动后,进行 Anammox负荷提高,以期获得稳定高效的脱氮功能.第 54~135d为Anammox负荷提升阶段,期间氮素浓度随时间的变化关系见图6.由图6可知,进水NH4+-N和NO2--N浓度经历了70,100,150,230,330mg/L及380mg/L.每次加大进水氮浓度负荷,出水NH4+-N和NO2--N浓度都会明显升高,但经过短暂时间(5d左右)恢复,出水NH4+-N和NO2--N浓度都能重新维持一个稳定的出水浓度,分别60mg/L和 0mg/L左右.氨盐和亚硝酸盐既是Anammox反应基质,亦是该反应的自抑制剂.有文献报道,Anammox反应对亚硝酸盐抑制更为敏感[10].NO2--N 抑制浓度为 100mg/L,高于此值将会出现严重的 Anammox自抑制现象,出水水质较差.因此,应留意负荷提高过程中出水NO2--N浓度变化.从图6可以发现,出水NO2--N浓度最大达 38.92mg/L,低于自抑制阈值,反应器仍能运行良好.根据 Anammox反应式,1mol NH4+-N产生0.26mol NO3--N,出水硝酸盐浓度能够反映反应器内 Anammox菌种生长状况.负荷提升阶段,出水 NO3--N浓度轻微波动,并有降低趋势,但仍在10mg/L以上.究其根源,可能是因为反应器内主要脱氮功能菌是 Anammox菌,存在一定数量的反硝化菌与之共存,反硝化菌以Anammox反应生成的NO3--N为电子受体,并依赖自身内源代谢物为有机电子供体维持生存.Anammox菌和反硝化菌组成了共生系统,Anammox菌为优势菌种,反硝化菌能够作为一种强化脱氮的存在,降低出水总氮浓度,弥补了单独Anammox脱氮过程产生硝酸氮而提高出水总氮这一不足.
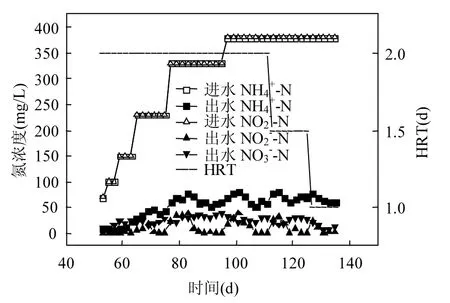
图6 负荷提高阶段氮素浓度变化Fig.6 Variations of nitrogen concentrations with time in the nitrogen loading enhancement stage
2.3.2 负荷提高期氮素去除情况 负荷提升阶段氮素去除速率和去除效率的变化趋势见图 7.由图7a可以得出,NH4+-N和NO2--N负荷率同步提升 7次,由 35mgN/(L⋅d)阶梯式提高至380mgN/(L⋅d),每次提升氮浓度负荷,氮素去除速率都会出现波动,后又趋于稳定,但 NH4+-N 和NO2--N去除速率整体仍然是提高的.而NH4+-N和NO2--N去除率变化不尽相同,NH4+-N去除率先由 88.03%增大至最大值 94.45%,然后急剧降低,但仍维持在76.90%以上;NO2--N去除率则是在每次提高NO2--N进水负荷时先短时间急剧降低,后又迅速回升至 95%以上.当 NH4+-N 和NO2--N负荷率分别维持在最高值380mgN/(L⋅d)时,NH4+-N和 NO2--N去除速率分别在 303.64~320.67mgN/(L⋅d)和 356.82 ~379.85mgN/(L⋅d)之间波动,NH4+-N和 NO2--N平均去除率分别为82.74%和 97.89%.图 7b中,总氮负荷率由70mgN/(L⋅d)阶梯式逐级提升至 760mgN/(L⋅d),总氮去除速率也随之梯式变化,由 65.78mgN/(L⋅d)增大至696.95mgN/(L⋅d).反应器达最大总氮负荷率 760mgN/(L⋅d)时,总氮平均去除率为 90.31%, 平均总氮去除速率为686.39mgN/(L⋅d).
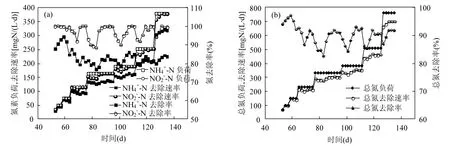
图7 负荷提升阶段氮素去除情况Fig.7 Variations of nitrogen removal rates with time in the nitrogen enhancement stage
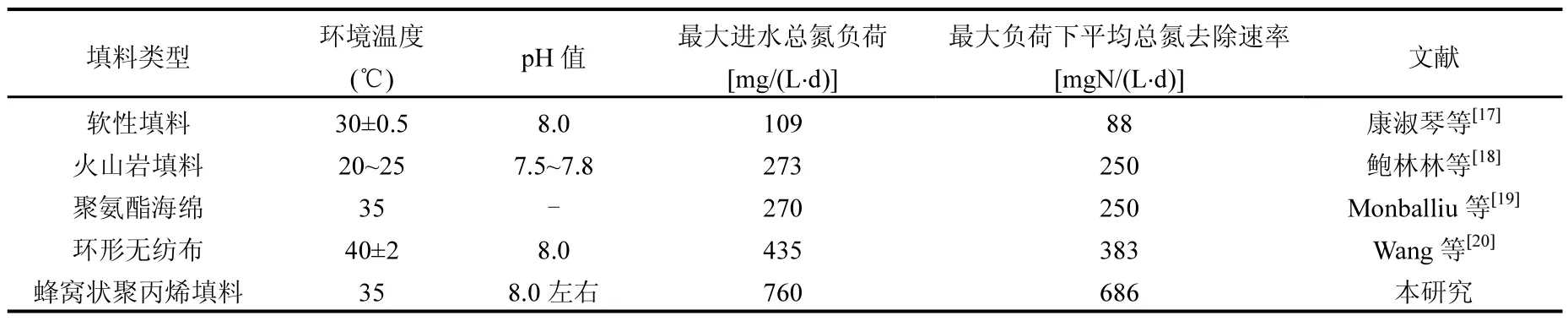
表2 厌氧氨氧化固定床反应器总氮去除性能汇总Table 2 The summary of total nitrogen removal performances of Anammox FBR reactors
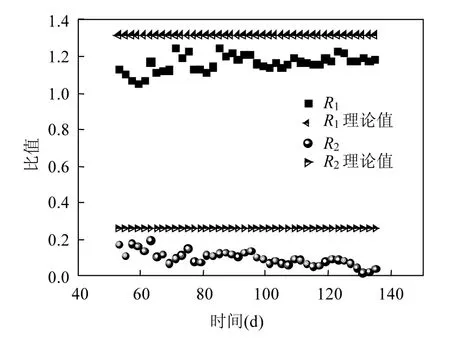
图8 负荷提升阶段化学计量比变化趋势Fig.8 Variations of stoichiometric ratio with time in the nitrogen enhancement period
表2对文献报道的不同Anammox固定床反应器总氮去除情况进行了汇总.本研究采用超声波强化的反应器表现出更高的最大进水总氮负荷和此最大负荷下平均总氮去除速率.超声波的生物强化作用能够进一步增强Anammox菌活性,提高其高氮负荷作用下的基质传递效率,进而加快菌体代谢过程,宏观上表现为反应器获得更高的除氮效能.低强低频超声波在一定程度上可缩短厌氧氨氧化启动周期且能强化其脱氮性能,这一发现为强化Anammox工艺启动和运行性能提供了新思路,有利于推进其工业化应用进程.
2.3.3 负荷提升阶段化学计量比变化 图 8给出了负荷提升阶段化学计量比的变化趋势.参加反应的NO2--N和NH4+-N之比先轻微波动,然后逐渐平稳.当进水总氮浓度稳定在最大浓度380mg/L时,R1平均值为1.18.而产物NO3--N与反应物 NH4+-N的比值则是随着进水浓度负荷的提升逐渐降低,最小值为 0.02.这与理论上的Anammox反应化学计量比R1与R2(1.32和0.26)偏差较大.R2过低,说明出水中 NO3--N非常少,NO3--N作为Anammox反应产物,其产量间接反映Anammox菌的生长代谢能力,而R1为1.18,说明反应器中仍以Anammox反应为主要脱氮途径,Anammox菌占主导.因此,出水 NO3--N含量少,是因为反应器中存在反硝化菌.R2的变化与图6的分析结果一致.
3 结论
3.1 通过批式实验得到超声波强化厌氧氨氧化菌活性的最优超声作用参数为:超声频率25kHz,超声作用时间 3min,超声强度 0.2W/cm2.在此参数下,Anammox最大活性为 38.8mgN/(gVSS⋅d),较对照组提高了20.95%.
3.2 填有蜂窝状聚丙烯填料的FBR在最优超声波工作参数条件下快速启动Anammox工艺,超声波作用频次为每周1次.此反应器运行至第38d时首次表现Anammox活性,且经53d运行成功实现Anammox工艺启动.启动阶段末, NH4+-N、NO2--N 和总氮的去除速率为 30.81mgN/(L⋅d)、34.97mgN/(L⋅d)和 60.34mgN/ (L⋅d),去除率分别达到了88.03%、99.91%和86.20%.典型化学计量比R1和R2分别为1.14和0.18.
3.3 在负荷提升阶段,反应器在运行至第 127d,进水NH4+-N和NO2--N负荷率分别达最大值380mgN/(L⋅d),在此高负荷条件下 NH4+-N 和NO2--N 最大去除速率为 320.67mgN/(L⋅d)和379.85mgN/(L⋅d),最大去除率为 84.39%和99.96%.化学计量比R1和R2分别稳定在1.18和0.03左右.此时,反应器中Anammox菌占优,而存在的少量反硝化菌有助于强化总氮去除.
参考文献:
[1]Rui D, Peng Y, Cao S, et al. Advanced nitrogen removal from wastewater by combining anammox with partial denitrification [J].Bioresource Technology, 2015,179(179C):497-504.
[2]Jetten M S, Strous M, Kt P S, et al. The anaerobic oxidation of ammonium [J]. Fems Microbiology Reviews, 1998,22(5):421-437.
[3]Jetten M S, Wagner M, Fuerst J, et al. Microbiology and application of the anaerobic ammonium oxidation ('anammox') process [J]. Current Opinion in Biotechnology, 2001,12(3):283-288.
[4]Guillén J A S, Yimman Y, Vazquez C M L, et al. Effects of Organic Carbon Source, COD/N Ratio and Temperature on Anammox Organisms [J]. Journal of the Japanese Society for Dental Materials & Devices, 2012,31(4):732-743.
[5]李亚峰,张文静,马晨曦.pH值和DO对厌氧氨氧化脱氮性能的影响[J]. 沈阳建筑大学学报(自然科学版), 2013,29(04):715-720.
[6]Yin X, Qiao S, Zhou J, et al. Fast start-up of the anammox process with addition of reduced graphene oxides [J]. Chemical Engineering Journal, 2016,283:160-166.
[7]Liu S, Yang F, Meng F, et al. Enhanced anammox consortium activity for nitrogen removal: impacts of static magnetic field [J].Journal of Biotechnology, 2008,138(3):96-102.
[8]汪 涛,张 贺,张 沙,等.超声波联用技术在污水处理中的研究进展 [J]. 现代化工, 2015,35(7):10-13.
[9]Van de Graaf A A, de Bruijn P, Robertson L A, et al, Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor [J]. Microbiology, 1996,142(8):2187-2196.
[10]Strous M, Kuenen JG., Jetten MSM. Key physiology of anaerobic ammonium oxidation [J]. Applied & Environmental Microbiology,1999,65:3248-3250.
[11]Tang C J, Zheng P, Chai L Y, et al. Characterization and quantification of anammox start-up in UASB reactors seeded with conventional activated sludge [J]. International Biodeterioration & Biodegradation, 2013,82(8):141-148.
[12]宋雨夏,熊 蕾,柴立元,等.Anammox反应器启动过程中颗粒污泥性状变化特性 [J]. 生物工程学报, 2014,30(12):1854-1864.
[13]Qin Y, Han B, Cao Y, et al. Impact of substrate concentration on anammox-UBF reactors start-up [J]. Bioresource Technology,2017,239:422-429.
[14]Lu Y F, Ma L J, Ma L, et al. Improvement of start-up and nitrogen removal of the anammox process in reactors inoculated with conventional activated sludge using biofilm carrier materials[J]. Environmental Technology, 2017,39(1):59-67.
[15]贾方旭,彭永臻,王衫允,等.厌氧氨氧化菌细胞的超微结构及功能 [J]. 应用与环境生物学报, 2014,20(5):944-954.
[16]段秀梅. Anammox菌超声强化及其与短程硝化污泥共包埋脱氮性能研究 [D]. 大连:大连理工大学, 2012.
[17]康淑琴,张少辉.厌氧氨氧化反应器的启动及其稳定性研究 [J].武汉理工大学学报, 2008,30(2):109-112.
[18]鲍林林,赵建国,李晓凯,等.常温低基质厌氧氨氧化反应器启动及其稳定性 [J]. 环境工程学报, 2013,7(3):981-986.
[19]Monballiu A, Desmidt E, Ghyselbrecht K, et al. Enrichment of anaerobic ammonium oxidizing (Anammox) bacteria from OLAND and conventional sludge: Features and limitations [J].Separation & Purification Technology, 2013,104(5):130-137.
[20]Wang Tao, Zhang Hanmin, Yang Fenglin. Performance of Anammox process and low-oxygen adaptability of Anammox biofilms in a FBR with small ring non-woven carriers [J].Ecological Engineering, 2016,86:126-134.

