低温等离子强化复合钙基吸附剂脱汞实验研究
白李一,段钰锋*,丁卫科,胡 鹏,韦红旗,张 君 (.东南大学能源热转换及其过程测控教育部重点实验室,江苏 南京 0096;.淮北师范大学化学与材料科学学院,安徽 淮北 35000)
汞作为仅次于氮氧化物、硫氧化物以及粉尘的第四大气污染物,在现今阶段仍以煤炭作为能源消费主体的我国[1],因其具有强挥发性、富集性以及环境稳定性,受到了广泛关注.电厂尾部烟气中,汞以氧化态(Hg2+)、颗粒态(HgP)、单质(Hg0) 3种形态存在.在实际生产和相关研究中发现,湿法脱硫装置和静电除尘装置分别对烟气中氧化态汞和颗粒态汞的脱除有着很高的效率.对于单质汞脱除目前商业化最为成熟的方法为活性炭喷射技术(ACI)[2-3],该技术是通过向烟道中喷射活性炭颗粒,从而将烟气中的单质汞吸附脱除.但由于活性炭成本高,耗量大,使得该技术的进一步推广应用受到阻碍,制备出高效廉价的吸附剂成为众多相关学者研究的目标[4-9].
低温等离子技术是一种对气体分子施加足以使其着火程度的击穿电压,使得气体在击穿后产生多种电子、离子以及基团的技术.考虑到低温等离子技术具有很强的氧化作用,此技术被广泛用于废气的氧化脱除.相比于传统技术,低温等离子体技术具有能源消耗少、副作用小、处理时间短、效率较高、环境温度低的优势.而作为一种干法表面处理技术,低温等离子技术相比于传统的化学法改性技术,对于吸附剂的表面结构的破坏较小[10],对于吸附剂内部结构的影响较低,优势明显.
有关利用低温等离子技术对废气中单质汞的脱除方法,在近年来就已经展开.介质阻挡放电(DBD)过程中可产生含高能氧自由基对促进氧化Hg0起到重要作用的活性物质[11].研究发现[12],HCl在进行DBD高压电离的过程中,产生的具有强氧化性的Cl自由基以及Cl2, 与Hg0反应生成HgCl2.Zhang等[13-14]利用DBD改性活性炭用于脱汞研究.在研究中发现经过氧等离子改性后的活性炭表面含氧官能团以及吸附活性位点数目有明显增加,强化了活性炭的化学吸附过程.
课题组前期研究发现[15]以活性炭和氧化钙为原料制备的复合钙基吸附剂,兼具活性炭优良的比表面积和孔隙率,及作为工业中主流脱硫剂的氧化钙具有的脱硫性能.同时吸附剂的脱硫脱汞性能在低温等离子改性后得到进一步提升.本文沿承前期对于复合钙基吸附剂的研究,进一步对具有协同脱除多种烟气中污染物前景的等离子改性复合钙基吸附剂的脱汞效果以等离子改性对吸附剂脱汞性能的影响进行实验探究.
1 材料与方法
1.1 复合钙基吸附剂的制备
将商业活性炭和分析纯氧化钙以2:1比例混合.取5g混合物放入500mL烧杯中,加入300mlL去离子水后,在70℃下搅拌2.5h.之后利用去离子水将浑浊液抽滤 5次后得到灰黑色固体物质.将所得固体物质放置在 90℃的干燥箱中干燥 3h.最后将干燥得到的固体物质研磨,用 100筛进行筛分,得到复合钙基吸附剂.
1.2 实验方法
低温等离子改性吸附剂装置系统如图 1所示.此系统由配气控制部分、介质阻挡高压放电反应器以及高压电源单元组成.将需要改性的吸附剂均匀放置在介质阻挡等离子发生反应器的两极板之间.两极板分别与高压电源的高压端、低压端子连接,且低压极板还需接地.通过高压电源提供可变的高能电压,反应器两极板间高压击穿气氛中的分子,产生高能等离子体,以达到对吸附剂表面改性的效果.
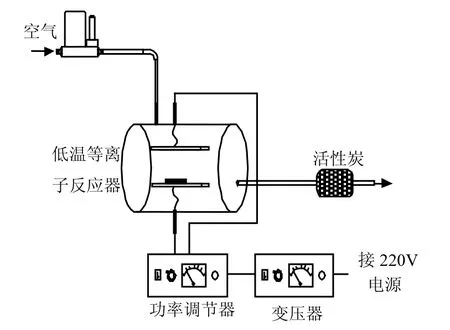
图1 低温等离子改性吸附剂装置系统Fig.1 Schematic diagram of modified device of non-thermal plasma treatment
吸附剂脱汞实验系统如图 2所示,主要由配气控制部分,VM-3000测汞仪、固定床吸附反应器以及尾气处理装置 4部分组成.通过利用SeitronC500烟气分析仪和VM-3000测汞仪对模拟烟气中Hg0、SO2和O2等各组分进行在线监测和标定,再根据实验要求调节质量流量计,以调节模拟烟气气氛,进行吸附模拟实验.模拟烟气总气量为 3L/min,确保载汞 N2流量为 200mL/min,控制初始汞浓度在(35±0.1)µg/m3.每组实验取 0.3g吸附剂进行吸附实验,通过控制三通阀实现主路和旁路之间的切换,利用 VM-3000测汞仪测量固定床反应器后的烟气中 Hg0浓度,多余气体经尾气处理装置处理后排出.
1.4 吸附剂吸附性能评价方式
依据反应前后汞蒸气浓度变化来评价吸附剂的脱汞性能.

图2 固定床吸附实验系统Fig.2 Schematic diagram of the fixed bed Hg adsorption system
Hg0的脱除效率η(%)为:
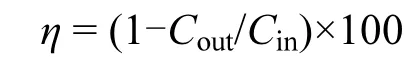
式中:Cin和Cout分别表示固定床实验装置进出口Hg0的质量浓度, µg/m3.
1.5 吸附剂的表征
表 1为复合钙基吸附剂改性前后的的孔结构特征.可以从表中看出,低温等离子改性对吸附剂比表面积和微孔容积的影响不明显.而低温等离子改性过程中,高能电子及自由基撞击吸附剂表面会产生一定量细小颗粒.而这些细小颗粒对大孔和中孔造成堵塞,使得吸附剂的总孔容积下降,而微孔容积比上升.这与 Zeng等[10]对吸附剂进行低温等离子改性的结果相近.
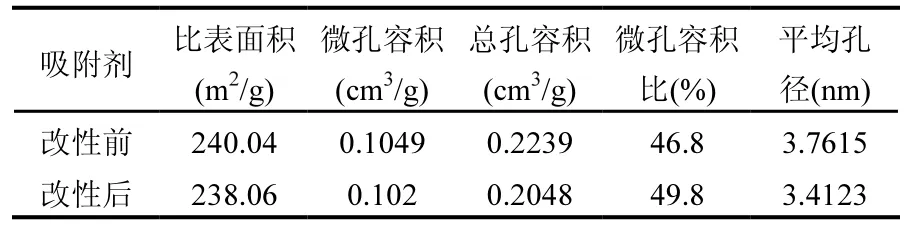
表1 吸附剂改性前后孔结构特性分析Table 1 Pore structure analysis of sorbents
图3为活性炭与氧化钙以质量比2:1制备的复合钙基吸附剂改性前后SEM图谱.从图3(a)可以看出改性前的复合钙基吸附剂表面有一层絮状白色固体,孔隙结构也较为复杂,而经功率40W的低温等离子体电离改性10min后,吸附剂表面有明显的蚀刻现象,白色絮状物被破碎,吸附剂表面颗粒粒径变小,如图 3(b)所示,吸附剂表面较为平整,但其影响仅在吸附剂表面几至几十个纳米厚度内,对吸附剂内部影响较小.

图3 改性前后复合钙基吸附剂SEM图谱Fig.3 The SEM images of sorbent before (a) and after (b)Non-Thermal Plasma Treated
图 4对比了改性处理前后的复合钙基吸附剂的FT-IR分析结果.可从图中看出,经过低温等离子改性后复合钙基吸附剂表面的吸附峰数量出现了一定幅度增加.C-N(875cm-1)、C-O-C(1160cm-1)、C=O(1440cm-1、1640cm-1)对应波数处的震动得到增强,表明吸附剂表面的羰基等官能团的相对含量在低温等离子理后有所增加.

图4 原始复合钙基吸附剂改性前后的FT-IRFig.4 The FT-IR spectra of sorbent before and afterNon-Thermal Plasma Treated
2 结果与讨论
通过低温等离子改性提高复合钙基吸附剂的脱汞效率,而低温等离子改性提高吸附剂表面的理化性能需要依托吸附剂表面原有的孔结构与理化性能,因此,复合钙基吸附剂的炭含量对吸附剂脱汞性能影响较大.将复合钙基吸附剂在40W输入功率空气气氛下等离子改性10min制备等离子改性复合钙基吸附剂.
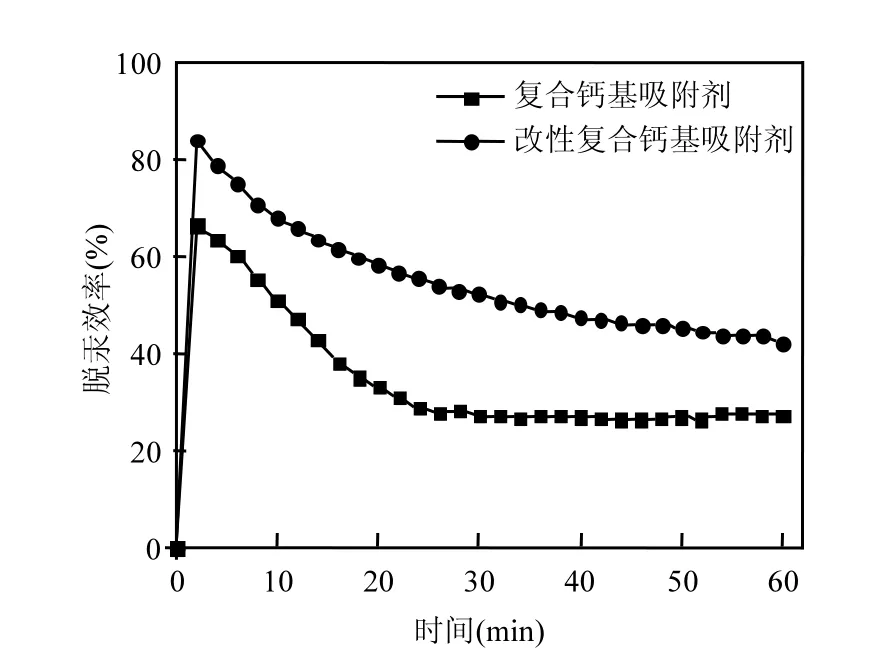
图5 等离子改性前后复合钙基吸附剂脱汞效率曲线Fig.5 Mercury removal efficiency of sorbents treated and untreated by non-thermal plasma
图 5为等离子改性前后复合钙基吸附剂脱汞实验曲线.复合钙基吸附剂在经过等离子改性后,其吸附脱汞性能有了明显的提高.复合钙基吸附剂在实验开始 1h后的脱汞效率由改性前的27.2%升至45.2%.低温等离子改性对于吸附剂脱汞性能的提升,主要通过强化活性炭表面的化学键断裂与表面理化性能[14].低温等离子改性增加了吸附剂表面的含氧官能团以及零价汞的吸附活性位点,从而提高吸附剂脱汞效率.
图 6为低温等离子改性复合钙基不同气氛脱汞效率曲线. Liu等[16]在研究SO2对碳质表面官能团的影响时,发现 SO2在吸附剂碳质表面上对 Hg0吸附存在两面性.在合理的浓度条件下,SO2在碳质表面吸附会提高临近位点的活性,促进了Hg0在碳表面的吸附.而在高浓度下,由于碳表面活性位点不足,SO2和 Hg0开始竞争吸附剂表面有限的结合位点,从而降低了脱汞效率.
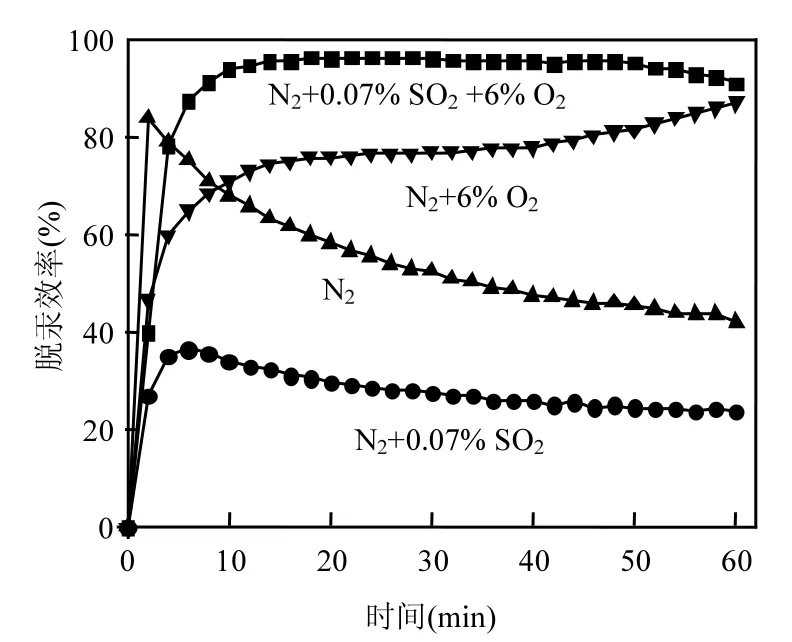
图6 改性复合钙基吸附剂不同气氛下脱汞效率Fig.6 Effect of the flue gas components on mercury removal efficiency of NTP Treated sorbent
0.07 % SO2的无氧条件下SO2的存在抑制了复合钙基吸附剂脱汞的过程,主要由于 SO2与汞竞争吸附剂表面的活性位,从而对吸附脱汞起到了抑制作用.在气氛中加入6% O2,吸附过程得到了促进,这可能是氧占据了吸附剂表面的不饱和键,增加了吸附剂表面的羟基和内酯基等含氧官能团,从而增加了元素汞的化学吸附位点,弱化了SO2和Hg0的竞争作用,此时SO2在碳表面的吸附对 Hg0的吸附的协同作用强于竞争作用.同时在0.07% SO2+6% O2的实验条件下,可以发现脱汞效率曲线不是简单的叠加,这一情况又与 Ma等[17]酸处理活性焦研究所得实验结果相似. Ma等[17]认为SO2的存在促使O2吸附在活性炭表面的碳原子不饱和键形成的表面活性位上,形成碳氧络合物促进 O2与汞反应生成 HgO,从而提高了脱汞效率.
在O2浓度对复合钙基吸附剂脱汞影响的实验(图7)中发现,改性复合钙基吸附剂对Hg0的吸附能力随着O2浓度上升而不断提高[18].在9% O2浓度气氛下吸附剂脱汞效率可达 92%.通常将这一情况归结于吸附剂表面的含氧官能团在O2的作用下增多,从而强化了吸附剂对 Hg0的吸附能力[19].
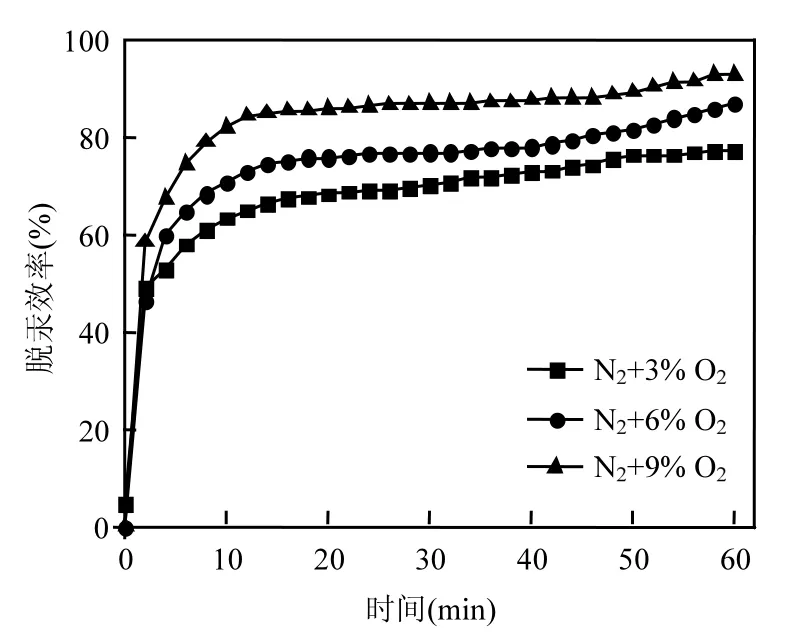
图7 改性吸附剂在不同O2浓度下脱汞效率Fig.7 Effect of O2 concentration on mercury removal efficiency of NTP treated sorbent
对未改性和改性复合钙基吸附剂进行吸附和脱附实验,探究低温等离子改性在 6% O2和0.07% SO2反应气氛下复合钙基吸附剂脱汞能力的影响并分析了吸附后样品表面汞的吸附形态结果如图8所示.
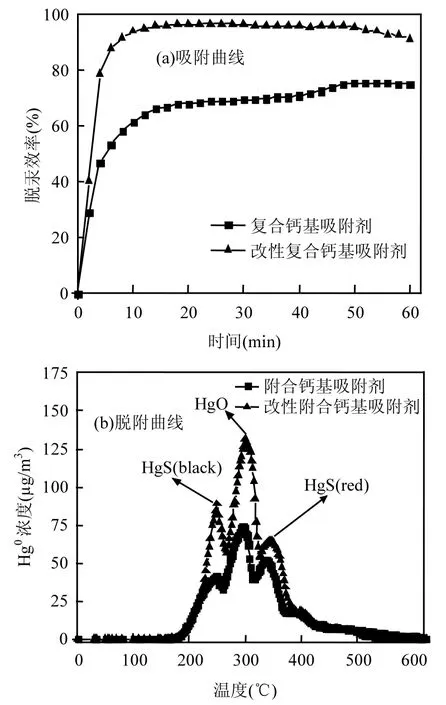
图8 低温等离子改性对复合钙基吸附剂在O2和SO2气氛下脱汞性能的影响Fig.8 Effect of NTP treated on mercury removal in the presence of 0.07% SO2 and 6% O2
反应后吸附剂的脱附曲线如图 8(b)所示.当温度升高至 150℃,开始有少量的汞从吸附剂表面析出,表明吸附剂对 Hg0有较弱的物理吸附能力.随着温度的进一步升高,脱附曲线在 250℃、300℃和350℃附近出现析出峰.Li等[20]在研究酸性气体对活性炭吸附汞的影响时,对在 6%O2气氛下实验后活性炭进行TPD分析,只在300℃附近得到一个脱附峰.而对同时存在O2和SO2气氛下实验后活性炭进行TPD分析时,分别在240℃,290℃和340℃附近得到脱附峰.而本文制备复合钙基吸附剂所用的活性炭,与Li等[20]研究时所用活性炭为同一种.再结合相关学者的研究[21-24]分析这一结果,可断定这 3个析出峰分别是由黑色氧化汞,硫化汞以及红色氧化汞分解所形成.对比图 8(a)中两条脱汞曲线,可清楚的发现经过低温等离子处理后的复合钙基吸附剂的吸附效率也从 74.9%提高至 91.2%,吸附产物均有明显增加.表明低温等离子改性对吸附剂氧化 Hg0生成多种二价汞化合物起到促进作用.
对在N2+ 6% O2+ 0.07% SO2气氛下反应前后改性复合钙基吸附剂的表面含氧官能团采用XPS方法进行定性分析,并对其 C1s谱图进行分峰拟合,结果如图 9所示.从图中可较清楚看到,改性复合钙基吸附剂表面含氧官能团以羟基C-O(285.4eV)、羰基 C=O(286.5eV)和内酯基C(O)-O-C(288.7ev) 3种为主[25].这3种含氧官能团在改性复合钙基吸附剂上的绝对含量如表 2所示.相比于图 9(b)中反应前的含氧官能团绝对含量占比,图 9(a)所示的反应后吸附剂担载在表面的羟基、酯基的含量均有所下降,而羰基的占比有所上升.这一方面表明在试验过程中含氧官能团被消耗,也证明含氧官能团作为活性位点提高了吸附剂的脱汞效率;Sun等[26]在对活性炭表面含氧官能团的研究中发现,酯基优先于羰基对Hg0的捕获.再结合本文XPS分析结果,可推测吸附产物中的HgO主要通过羟基、酯基为代表的碳氧单键断裂吸附Hg0生成.
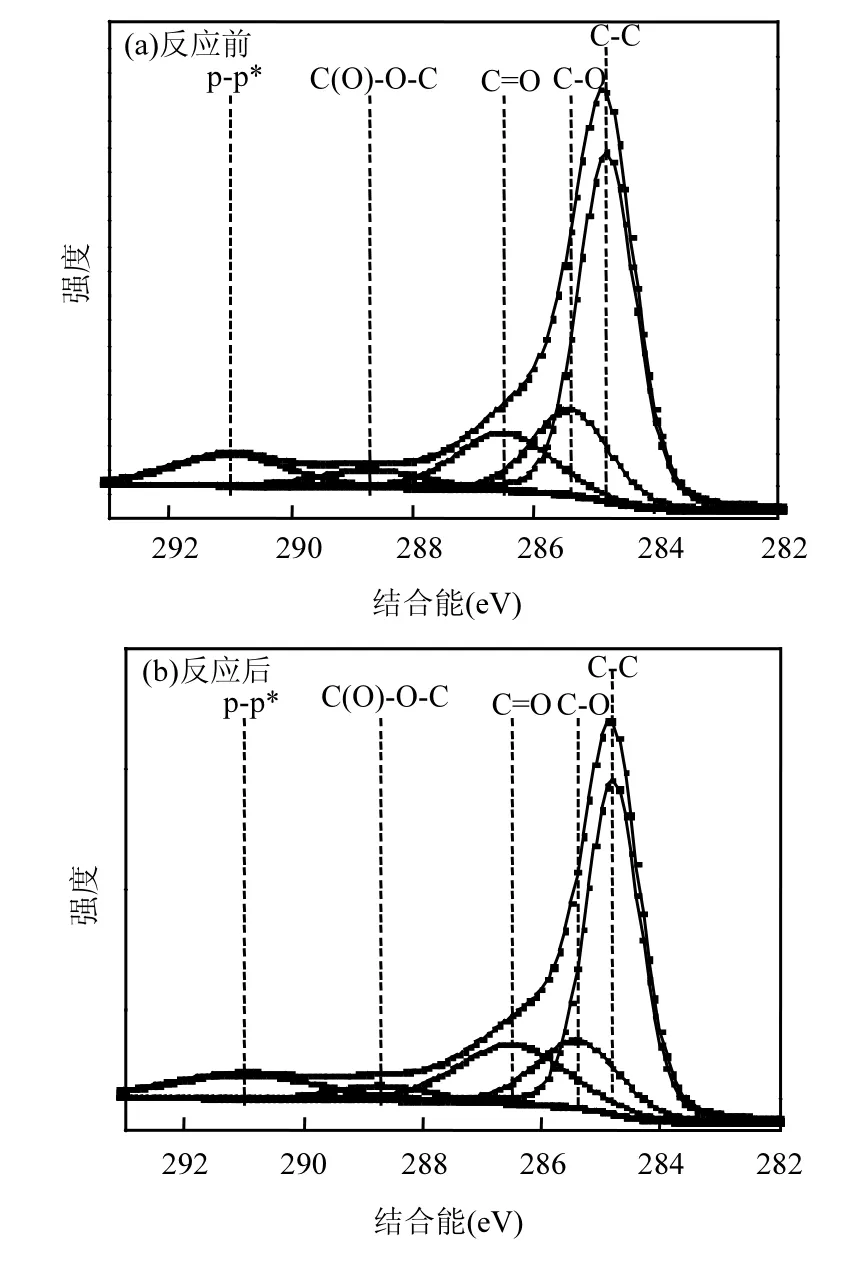
图9 在6% O2 + 0.07% SO2气氛下改性吸附剂反应前后的XPS图谱Fig.9 XPS spectra of NTP treated sorbent before (a) and after (b) reaction in the presence of 0.07% SO2 and 6% O2
通过进一步对同时存在 SO2和 O2气氛中SO2浓度对吸附脱汞过程影响的研究,得到脱汞效率曲线如图 10所示.从图中可以观察到在0.07~0.1%的 SO2条件下,脱汞效率在 90%以上,得到极大的促进.而相比与纯N2气氛, 0.03% SO2浓度条件下的脱汞效率仅有较小的提升.这很可能是由于O2对SO2氧化生成SO3[27-28].生成的少量 SO3迅速与复合钙基中的钙化物部分发生反应生成硫酸钙,也在另一个角度降低了O2和SO2的浓度.这既减少了该气氛下O2在吸附剂表面创造的活性位点数量,也降低了吸附剂对 SO2的吸附量,从而导致脱汞效率的提高不明显.而在0.15% SO2条件下,脱汞过程受到了抑制.在实验开始1h后,该气氛下吸附剂脱汞效率只有23.3%.这是因为尽管气氛中的O2创造了更多的吸附活性位点,但由于SO2浓度的继续上升,碳表面活性位点数量再次表现为不足,SO2和 Hg0又开始竞争吸附剂表面有限的结合位点,竞争机制是主要的影响因素[16],使得脱汞效率降低.
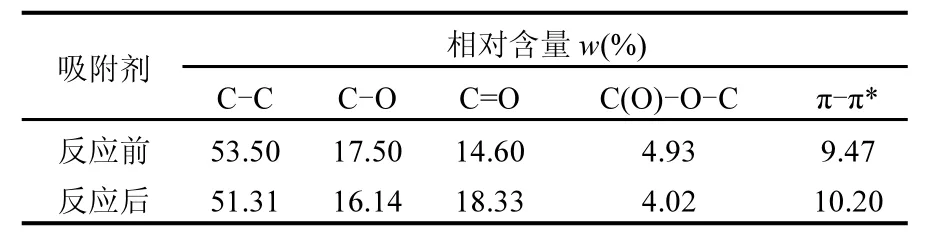
表2 XPS图谱所示官能团统计Table 2 Functional groups determined from XPS spectra
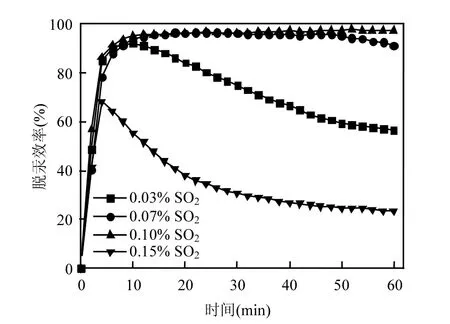
图10 在含氧(6%O2)气氛下不同浓度SO2对改性吸附剂脱汞效率的影响Fig.10 Effect of SO2 concentration on mercury removal efficiency of NTP treated sorbent
3 结论
3.1 复合钙基吸附剂在经过低温等离子处理后,表面的羟基、酯基等含氧官能团的含量上升,增加了吸附剂表面活性位点,对复合钙基吸附剂吸附脱除Hg0有明显的提高,实验开始1h后的脱汞效率从27.2%升至45.2%.
3.2 低温等离子改性对吸附剂氧化 Hg0生成多种二价汞化合物起到促进作用,且在含 O2、SO2反应气氛下改性复合钙基吸附剂表面的羟基、酯基官能团作为主要反应活性位点,而羰基官能团的作用不明显.
3.3 在0~0.1% SO2气氛中加入适量O2,反应气氛对改性复合钙基吸附剂对Hg0的吸附作用,从抑制转变为促进,脱汞效率高达90%.而当气氛中SO2升至 0.15%,由于活性位点再次不足,改性吸附剂对Hg0的吸附再次受到抑制,脱汞效率降至23.3%.
参考文献:
[1]佚名.《能源发展“十三五”规划》介绍(二) [J]. 能源与节能,2017,(7):1-1.
[2]姚 婷,洪亚光,段钰锋,等.KI改性凹凸棒管道喷射脱汞实验研究 [J]. 中国电机工程学报, 2015,35(22):5787-5793.
[3]Evan J. Granite, Henry W. Pennline, Richard A. Hargis. Novel Sorbents for mercury removal from flue gas [J]. Industrial &Engineering Chemical Research, 2000,39(4):1020-1029.
[4]张安超,张洪良,宋 军,等.Mn-Co/MCM-41吸附剂表征及脱除烟气中单质汞研究 [J]. 中国环境科学, 2015,35(5):1319-1327.
[5]Sjostrom S, Ebner T, Ley T, et al. Assessing sorbents for mercury control in coal-combustion fluegas [J]. Air Waste Management Association, 2002,52:902–911.
[6]赵鹏飞,郭 欣,郑楚光.活性炭及氯改性活性炭吸附单质汞的机制研究 [J]. 中国电机工程学报, 2010,30(23):40-44.
[7]高 鹏,向 军,张安超.壳聚糖吸附剂脱除燃煤模拟烟气中汞的试验研究 [J]. 中国环境科学, 2010,30(6):733-737.
[8]洪亚光,段钰锋,朱 纯,等.载溴高硫石油焦活性炭脱汞实验研究 [J]. 中国电机工程学报, 2014,34(11):1762-1768.
[9]张 星,李彩亭,樊小鹏,等 CeCl3/活性炭纤维去除模拟烟气中单质汞的实验研究 [J]. 中国环境科学, 2012,32(5):816-821.
[10]Zeng X, Xu Y, Zhang B, et al. Elemental mercury adsorption and regeneration performance of sorbents FeMnOx enhanced via nonthermal plasma [J]. Chemical Engineering Journal, 2017,309:503-512.
[11]Xu F, Luo Z, Cao W, et al. Simultaneous oxidation of NO, SO2and Hg0from flue gas by pulsed corona discharge [J]. Journal of Environmental Sciences, 2009,21(3):328-332.
[12]Ko K B, Byun Y, Cho M, et al. Influence of HCl on oxidation of gaseous elemental mercury by dielectric barrier discharge process[J]. Chemosphere, 2008,71(9):1674-1682.
[13]Zhang J, Duan Y, Zhou Q, et al. Adsorptive removal of gas-phase mercury by oxygen non-thermal plasma modified activated carbon [J]. Chemical Engineering Journal, 2016,294:281-289.
[14]Zhang B, Xu P, Qiu Y, et al. Increasing oxygen functional groups of activated carbon with non-thermal plasma to enhance mercury removal efficiency for flue gases [J]. Chemical Engineering Journal, 2015,263:1-8.
[15]丁卫科,段钰锋,张 君,等.低温等离子改性复合钙基吸附剂烟气脱汞脱硫实验研究 [J]. 中国电机工程学报, 2017,36(3):3802-3808.
[16]Liu J, Qu W, Joo S W, et al. Effect of SO2on mercury binding on carbonaceous surfaces [J]. Chemical Engineering Journal, 2012,184:163-167.
[17]Ma J, Li C, Zhao L, et al. Study on removal of elemental mercury from simulated flue gas over activated coke treated by acid [J].Applied Surface Science, 2015,329:292-300.
[18]朱 纯,段钰锋,冒咏秋,等.烟气组分对氯化铵改性活性炭汞吸附特性的影响 [J]. 工程热物理学报, 2013,34(10):1982-1985.
[19]郑楚光.煤燃烧汞的排放及控制 [M]. 北京:科学出版社,2010:93-94.
[20]Li Y, Duan Y, Wang H, et al. Effects of Acidic Gases on Mercury Adsorption by Activated Carbon in Simulated Oxy-Fuel Combustion Flue Gas [J]. Energy & Fuels, 2017,31(9):9745-9751.
[21]陈明明,段钰锋,周 强,等.烟气组分对汞吸附影响的程序升温脱附 [J]. 化工进展, 2016,35(12):4065-4071.
[22]Lopez-Anton M A, Yuan Y, Perry R, et al. Analysis of mercury species present during coal combustion by thermal desorption [J].Fuel, 2010,89(3):629-634.
[23]Rumayor M, Fernandez-Miranda N, Lopez-Anton M A, et al.Application of mercury temperature programmed desorption(Hg-TPD) to ascertain mercury/char interactions [J]. Fuel Processing Technology, 2015,132:9-14.
[24]Rumayor M, Diazsomoano M, Lopezanton M A, et al. Mercury compounds characterization by thermal desorption. [J]. Talanta,2013,114(3):318-322.
[25]Puziy A M, Poddubnaya O I, Socha R P, et al. XPS and NMR studies of phosphoric acid activated carbons [J]. Carbon,2008,46(15):2113-2123.
[26]Sun P, Zhang B, Zeng X, et al. Deep study on effects of activated carbon’s oxygen functional groups for elemental mercury adsorption using temperature programmed desorption method [J].Fuel, 2017,200:100-106.
[27]李海龙,王晓刚,李立清,等.SO2对 CeO2-TiO2催化剂上汞氧化的双面影响研究 [J]. 工程热物理学报, 2013,34(9):1775-1778.
[28]Chang J C S, Ghorishi S B. Simulation and evaluation of elemental mercury concentration increase in flue gas across a wet scrubber [J].Environmental science & technology, 2003,37(24):5763-5766.

