愈癫汤对MK-801致精神分裂症模型大鼠Glu-DA神经递质系统的影响❋
赵玉萍,柴剑波,高 潇,于 明,赵永厚△
(1. 黑龙江神志医院,哈尔滨 150036; 2. 黑龙江神志医院博士后科研工作站,哈尔滨 150036;复旦大学博士后中西医结合流动站,上海 200433)
谷氨酸-多巴胺(Glu-DA)神经递质系统紊乱是精神分裂症发病的重要机制[1]。中医神志病学认为,精神分裂症病位在脑,核心病机为痰瘀互结、脑神失调,据此化裁愈癫汤乃黑龙江神志医院院内制剂经验方,临证取得确切疗效。本研究以谷氨酸(Glu)-多巴胺(DA)神经递质系统为切入点,观察“消痰化瘀”之愈癫汤对精神分裂症模型大鼠脑组织NO活性、MDA含量及nNOSmRNA、DA、Glu表达情况的影响,为阐明其干预精神分裂症的作用机制奠定研究基础。
1 材料
1.1 动物
48只雄性成年SD大鼠(300±20 g),购自黑龙江中医药大学药物安全性评价中心(合格证号SCXK(黑)2013-004)。
1.2 药物
愈癫汤组成:制半夏15 g,制天南星15 g,牵牛子10 g,三棱15 g,莪术15 g,槟榔15 g,大黄10 g,茵陈蒿15 g。将1剂上述饮片放入煎药器皿中加12倍量清水浸泡2 h,武火煎煮10 min,文火再煎煮30 min后过滤煎液,之后再加8倍量水武火煎煮10 min,文火再煎煮30 min过滤煎液,滤除药渣后将2次煎煮药液合并加热浓缩至111 ml后,药液浓度为0.92 g/ml。
利培酮片:江苏恩华药业股份有限公司(生产批号20120501),购自黑龙江神志医院药局。将4 mg利培酮片研成粉末,加111 ml蒸馏水后恒温水浴震荡20 min,配制成0.036 mg/ml的利培酮悬浊液。地卓西平(MK-801)注射液:取MK-801(美国SIGMA公司生产)1 mg溶于1 ml氯化钠溶液中,配制成浓度为1 mg/ml储备药液,造模时将储备药液稀释为0.1 mg/ml注射液。
1.3 主要试剂及仪器
主要试剂:神经型一氧化氮试剂盒(南京建成A012);MDA测定试剂盒(南京建成A003-1);高纯总RNA快速提取试剂盒(中国BioTeke RP1201)。主要仪器:ELX-800型酶标仪(美国BIOTEK公司);UV752型紫外可见光分光光度计(湖南湘仪);Life Express-PCR仪(杭州BIOER);凝胶成像分析仪(北京六一WD-9413B)及LC-6 A高效液相色谱仪(日本岛津)。
2 方法
2.1 分组
实验大鼠自由摄食水,适应性饲养1周,应用计算机软件为每只动物自然序号赋予1个3位随机数,按随机数大小分入空白组、模型组、利培酮组及愈癫汤组,每组各12只。
2.2 造模方法
除空白组外,各组大鼠按照0.1 mg/kg体质量剂量腹腔注射0.1 mg/mLMK-801注射液,注射位置选择大鼠左或右(每日交替)下侧腹腔略靠近外侧1/3处;空白组大鼠应用0.9%氯化钠溶液行相同方法腹腔注射,连续14 d[1-3]。
2.3 给药方法
于实验开始第15天进行干预性给药,空白组、模型组给予蒸馏水灌胃(1 ml/100 g),对照组及治疗组大鼠于模型制备成功后分别给予利培酮悬浊液灌胃(0.5 ml/100 g),愈癫汤水煎剂灌胃(1 ml/100 g),持续灌胃14 d。
2.4 观察指标及检测方法
2.4.1 应用分光光度计测定额前脑组织NO活性、MDA含量 加入9倍体积PBS,将额前脑组织打碎后用液氮反复冻融3次,应用12000 r/min离心10 min,取上清液低温冷冻待用。通过蛋白质定量测定制备标准曲线,参照试剂盒说明书操作并计算NO活性和MDA含量。
2.4.2 应用PCR法测定额前脑组织nNOSmRNA的表达 应用RNA试剂盒提取样本总RNA,将得到的RNA样本进行反转录,对上步实验所得的RNA样本进行反转录以得到对应的cDNA,建立PCR反应体系,将引物按照设计的PCR反应程序操作,之后经电泳过后利用凝胶成像系统对得到的凝胶进行拍照,并应用凝胶图像处理系统分析光密度值得出结果。
2.4.3 HPLC-ECD法测定额前脑组织Glu、DA表达情况 选用HPLC-ECD将冷冻的额前脑组织加1 mL预冷的95%乙醇,12000 r/min离心3 min,然后取5 μL样品于离心管中,加入50 μL衍生工作液涡旋震荡1 min,取样20 μL注入色谱仪,记录色谱图计算峰面积,得出Glu、DA表达情况。
2.5.统计学方法
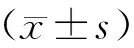
3 结果
3.1 各组大鼠额前叶组织NO活性、MDA含量、nNOSmRNA表达比较
表1显示,与空白组比较,模型组NO活性、MDA含量及nNOSmRNA表达皆明显升高(P<0.01,P<0.05);而治疗组能显著降低NO活性、MDA含量及nNOSmRNA表达(P<0.05),且在降低MDA方面明显优于对照组(P<0.05)。
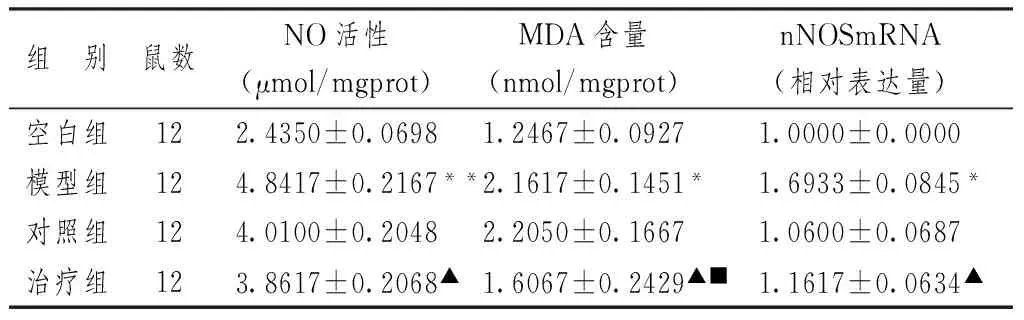
表1 各组大鼠额前脑组织NO活性、MDA含量、nNOSmRNA表达比较
注:与空白组比较:*P<0.05,**P<0.01;与模型组比较:▲P<0.05;与对照组比较:■P<0.05
3.2.各组大鼠额前叶组织Glu、DA表达比较
表2显示,与空白组比较模型组Glu表达程度明显降低,DA表达明显升高(P<0.05);而治疗组能显著升高Glu的表达,降低DA的表达,且明显优于对照组(P<0.05)。

表2 各组大鼠额前脑组织Glu、DA表达情况比较
注:与空白组比较:*P<0.05;与模型组比较:▲P<0.05;与对照组比较:■P<0.05
4 讨论
现代医学认为,精神分裂症的发病与Glu神经元功能障碍及DA功能亢进密切相关,且精神分裂症发病极易体现出二者同时出现所相关联的Glu-DA神经递质系统紊乱。一般认为,脑组织中Glu和DA是一对具有相互调节作用的神经递质,精神分裂症患者脑组织内特别是额前组织中存在Glu能神经元功能不足,并由此导致基底神经节过度释放DA,经由纹状体-丘脑-皮质通路刺激皮质Glu能神经元,结果形成正反馈而最终导致Glu的过度释放形成神经毒性。Glu神经毒性可导致NO信号通路及氧化应激反应的激活,基于NO信号通路角度,Glu神经毒性可以使NMDA受体激活增多,致细胞内游离Ca+浓度增加,使nNOS从质膜转移到细胞质进而生成NO,NO进而反作用于Glu进一步导致Glu的过度释放加重神经毒性。鉴于Glu与DA的互相调节作用,其可以使DA病理性的加速释放[4-9]。而基于氧化应激反应角度,Glu神经毒性可以导致MDA含量升高,致DA神经元出现神经毒性反应甚则凋亡[10]。故精神分裂症可见Glu神经元功能障碍及DA功能亢进同时出现,具体表现为Glu-DA神经递质系统紊乱。
中医神志病学认为,精神分裂症属于中医“癫狂病”范畴,其所具有的潜伏期长、症状隐匿等特殊的发病特点,使得临证中痰瘀互结型患者尤为多见,在病理特点上体现出典型的痰凝血瘀证候特征。因此,本病的治疗亦应从痰瘀入手,以消痰化瘀、破结行气为纲。据此,拟愈癫汤方以3组药物分领涤痰、祛瘀、行气三岐。半夏、南星燥湿化痰,消痞散结;牵牛子性寒味苦,消饮涤痰,三者相伍则祛痰之功卓著。三棱、莪术破血逐瘀而行气,槟榔行气消积,三者相伍使瘀行气畅。同时牵牛子得槟榔之助,则气顺而痰自消,行气之功增强;槟榔得牵牛子之辅,破气之功更著。瘀久必化热,茵陈蒿利湿清热,亦可得大黄利湿之助。且方中大黄既可攻积泻下,给痰瘀之邪以出路,又兼化瘀之力。综观全方,痰瘀同治、气血兼调则必使痰浊渐去而瘀血渐消,脑窍再现清灵通利之功。
研究发现,消痰活血之愈癫汤可显著抑制精神分裂症模型大鼠额前脑组织内MDA含量、NO活性及nNOSmRNA的表达,表现出对MK-801所致精神分裂症模型大鼠额前脑组织内Glu及DA表达的正性调节作用,发挥了显著稳定Glu-DA神经递质系统的作用,提示愈癫汤可能通过阻断NO信号通路及氧化应激反应消除Glu神经毒性,维持Glu-DA神经递质系统的稳定。
参考文献:
[1] 朱德晓. MK-801致幼鼠额叶皮层神经元兴奋性降低和成年后社会交往缺陷的机制研究及帕潘立酮的干预作用[D].济南:山东大学,2016.
[2] 韩岱. MK-801处理青春期大鼠制作精神分裂症认知损伤模型和非经典抗精神病药物治疗机制研究[D].上海:复旦大学,2013.
[3] 刘卫青. 不同给药方式下MK-801诱导的精神分裂症核心症状大鼠模型研究[D].长沙:中南大学,2012.
[4] 刘勇,唐亚梅,蒲惟丹,等. MK-801诱导的精神分裂症发育模型大鼠脑组织DA,DOPAC,Glu和GABA浓度的变化[J]. 中南大学学报:医学版,2011,36(8):712-719.
[5] 武春艳,王祖承,江三多. 神经营养素-3基因甘氨酸/谷氨酸多态性与精神分裂症的相互关系[J]. 中华精神科杂志,2000,33(4):207-209.
[6] 刘勇. MK-801重复处理围产期或成年期大鼠建立的精神分裂症模型效度研究及致认知损害的KCC2机制初探[D].长沙:中南大学,2009.
[7] 杜爱林,徐春阳,李爽,等. 急性酒精中毒对老龄大鼠纹状体NO和nNOS及学习记忆的影响[J]. 医学信息:手术学分册,2007,20(8):708 -710.
[8] 史榕荇. 电针对慢性应激模型大鼠HPA轴-Glu-NMDA受体-NO路径调节作用机理的研究[D].北京:北京中医药大学,2007.
[9] 卢敏. 褪黑素对谷氨酸钠致痫大鼠海马内5-羟色胺及一氧化氮含量的影响[D].武汉:华中科技大学,2006.
[10] 赵瑾. 首发精神分裂症患者外周血氧化应激及认知功能的研究[D].新乡:新乡医学院,2016.

