加味黄芪赤风汤对阿霉素诱导肾小球足细胞凋亡的影响❋
李 双,李 澎,张 昱△,杨 斌,李刘生,许勇钢,郝 伟,赵晋宁
(1. 中国中医科学院西苑医院肾病科,北京 100091; 2. 中国中医科学院西苑医院实验研究中心,北京 100091)
慢性肾脏病(chronic kidney disease,CKD)是各种慢性肾脏疾病的总称,随着CKD病情进展,患者的肾功能将进一步下降进而发展为慢性肾衰竭,最终进入终末期肾脏病,给家庭和社会带来沉重的负担。张路霞等[1]对47204名中国成年人(18~95岁)进行横断面研究,其中CKD患者约占10.8%,相当于全国有1.2亿左右成年人患有不同程度的CKD。蛋白尿尤其是长期持续的大量蛋白尿是加速CKD进展的独立危险因素,在CKD早期积极干预治疗,对延缓CKD的进展至关重要。足细胞是构成肾小球滤过膜的最后屏障,其损伤是导致蛋白尿的重要原因,在CKD的发生发展中发挥重要作用。近年来,足细胞病变在肾小球疾病进展中的作用日益成为人们关注的焦点。加味黄芪赤风汤是张昱教授经过多年临床实践,衷中参西,不断增减变化而形成的治疗CKD蛋白尿行之有效的方剂。我们前期研究证实,加味黄芪赤风汤能够显著减少阿霉素大鼠尿蛋白,改善肾脏纤维化[2-4],并能够缓解脂多糖诱导的肾小球系膜细胞恶性表型[5-6]。本研究立足于加味黄芪赤风汤对阿霉素(adriamycin,ADR)诱导肾小球足细胞凋亡(apoptosis)的影响,以探讨该方对足细胞损伤的保护机制。
1 材料
1.1 实验动物
健康VAF/SPF 级SD雄性大鼠63只,体质量(250±10)g,购于北京维通利华实验动物技术有限公司(合格证编号SCXK(京)2012-0001)。实验期间饲养于中国中医科学院西苑医院SPF级动物房,温度在 24 ℃~28 ℃,湿度75%左右,以标准饲料饲养,自由饮水及摄食,适应性喂养4 d。
1.2 实验细胞
小鼠肾小球足细胞(mouse podocyte,资源编号3111C0001CCC000230)由国家实验细胞资源共享平台提供。
1.3 实验药品
加味黄芪赤风汤组成:生黄芪30 g,赤芍20 g,防风10 g,芡实10 g,金樱子10 g,穿山龙20 g,白花蛇舌草10 g,饮片来自于中国中医科学院西苑医院草药房,分别煎煮浓缩至1.140、0.570和0.285 g(生药)/ml。 替米沙坦片(80 mg/片,勃林格殷格翰(德国)生产,批号D1420006572)160 mg研制成粉溶于384 mL纯净水,按0.417 mg/mL配制成混悬液,4 ℃冰箱密封保存。
1.4 主要试剂及仪器
DMEM培养基、优级胎牛血清、胰酶(GIBCO公司);阿霉素、链霉素、青霉素、重组小鼠γ-干扰素(Sigma公司);RIPA裂解液、PMSF(北京艾德生物科技有限公司提供);AnnexinV/FITC试剂盒(BD公司);透射电子显微镜(FEI TECNAI G2 SPIRIT);紫外分光光度计(德国Biophotometer公司);转移脱色摇床(海门其林贝尔仪器制造公司)等。
2 方法
2.1 含药血清制备
63只大鼠按随机数字表法分为5组,其中空白组15只大鼠每次灌服等量纯净水,替米沙坦组12只大鼠每次按0.417 mg/ml灌服,加味黄芪赤风汤分别按高、中、低剂量组每组12只每次按1.140、0.570、0.285 g(生药)/ml灌服,每日灌胃1次,持续给药1周。于末次灌胃2 h后以4%水合氯醛腹腔麻醉大鼠,通过腹主动脉取血,血液于37 ℃环境静置2 h,待血液充分凝固后3000 r/min,10 min离心,将同组大鼠血清上清液收集到一起置于新的离心管,经56 ℃水浴30 min灭活,一次性无菌过滤器将血清过滤除菌,并分装于1.5 mL的冻存管中,-20 ℃冰箱保存备用。
2.2 细胞培养
足细胞增殖阶段培养:DMEM培养液中+10%胎牛血清+链霉素100μg/mL+青霉素100 U/mL+20U/ml(重组小鼠γ-干扰素),置于33 ℃5%CO2培养箱,每2~3 d换液1次,待细胞呈鹅卵石样、密度至85%左右用0.25%胰酶消化,后换成分化阶段培养液,足细胞进入分化阶段。
足细胞分化阶段培养:DMEM培养液中+10%胎牛血清+链霉素100μg/mL+青霉素100 U/mL,置于37 ℃、5%CO2培养箱,每2~3 d换液1次,10~14 d后分化成熟可用于实验。
2.3 细胞分组
空白组:10%空白对照血清+DMEM培养基+链霉素100μg/mL+青霉素100 U/mL;替米沙坦组:10%替米沙坦血清+DMEM培养基+链霉素100 μg/mL+青霉素100 U/mL;加味黄芪赤风汤高、中、低剂量组(以下均简称中药高、中、低剂量组):分别以10%高、中、低剂量中药血清+DMEM培养基+链霉素100 μg/mL+青霉素100 U/mL。取本次实验前期所测ADR 2 μg/mL作为最佳损伤浓度用于实验。阿霉素与治疗药物同时加入,作用24 h后检测相关指标。
2.4 CCK-8法检测各处理组足细胞存活率
取96孔板培养的分化成熟的足细胞,按上述细胞分组方法,每组6个复孔,每孔加入100 μl孵育液,孵育24 h(参考相关文献,检测时间点选择24 h[7])用CCK-8法检测各组足细胞存活率,经酶标仪记录各组450 nm吸光度值。
2.5 流式细胞仪检测各处理组足细胞凋亡率
取6孔板培养的分化成熟足细胞,分组后用0.25%胰酶消化细胞收集细胞到EP管;将收集到的细胞重悬于1×Annexin Binding Buffer,使细胞密度不少于每100 μl有1×105个;加入5 μL AnnexinV-FITC及5 μL Propidium Iodide(PI)混匀、避光,25 ℃放置15 min;加入400 μl的1×Annexin Binding Buffer混匀,1 h内用流式细胞仪进行检测,FL1通道检测AnnexinV,FL3通道检测PI,以PI阴性、AnnexinV阳性为细胞凋亡判定标准。在双变量流式细胞仪的散点图上,左下象限代表正常细胞,右下象限代表早期凋亡细胞,右上象限代表晚期凋亡及坏死的细胞,本次实验统计的是右下象限早期凋亡细胞。
2.6 透射电镜下观察各处理组足细胞凋亡超微结构
具体操作方法:细胞固定:5%戊二醛固定1~2 h后,0.1 mol/L PBS洗2次,每次15 min;1%饿酸固定1~2 h后用0.1 mol/L PBS洗2次,每次15 min,4℃;细胞脱水:用50%、70%、90%乙醇各脱水1次,每次20 min 4℃;100%乙醇与100%环氧丙烷(1∶1)脱水20 min 4℃;100%环氧丙烷脱水20 min 4℃;100%环氧丙烷脱水2次,每次20 min,室温;细胞包埋:100%环氧丙烷与包埋液(2∶1)室温处理4 h,100%乙醇与100%环氧丙烷(1∶1)室温处理过夜,纯包埋液37 ℃处理3 h;细胞固化:40 ℃ 2 h,60 ℃ 4 h,80 ℃ 10 h;超薄切片:铀、铅染色,分别15 min、10 min,镜下观察。
2.7 统计学方法
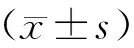
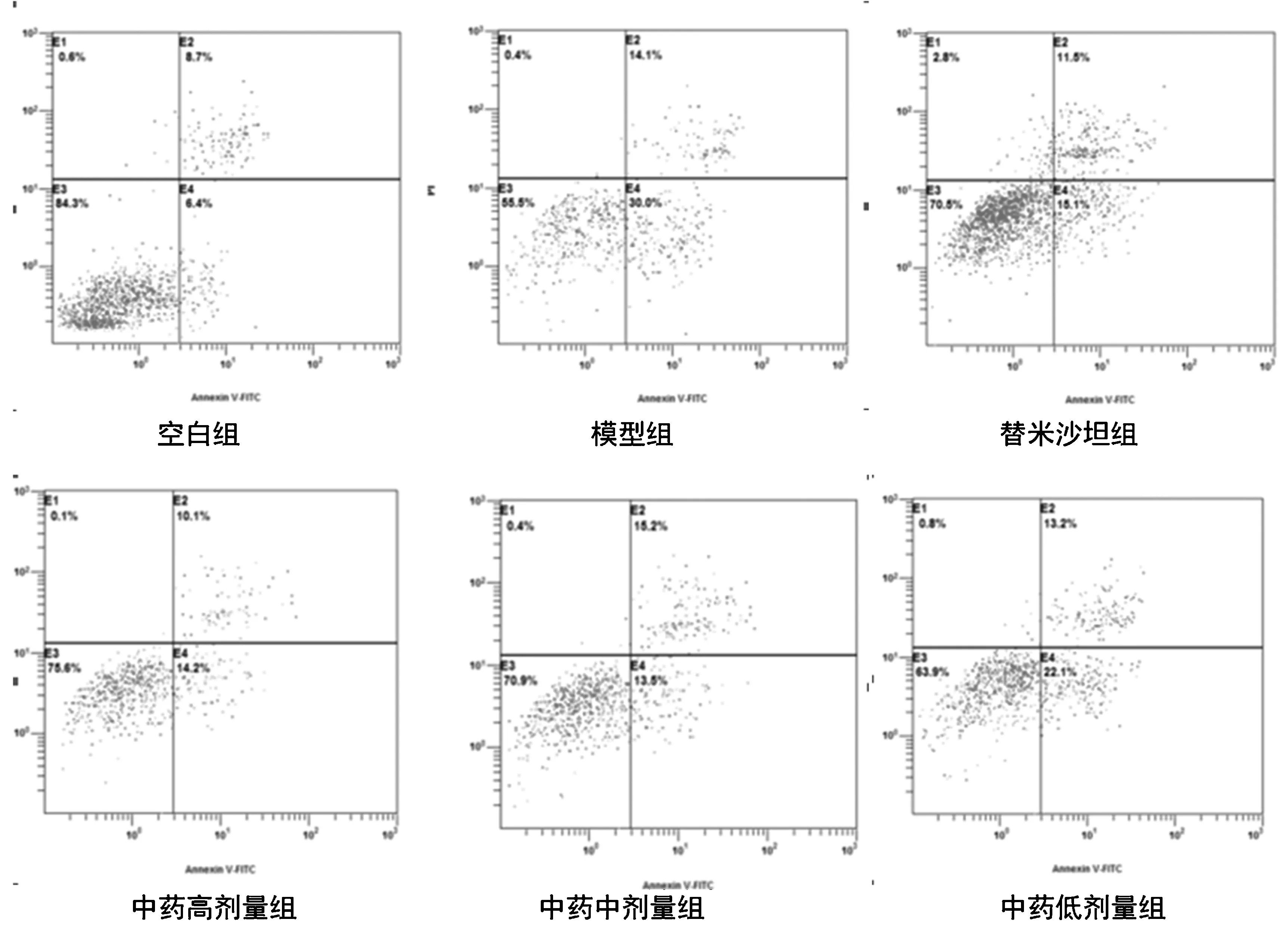
图2 流式细胞仪检测各组足细胞早期凋亡率变化
3 结果
3.1 各处理组对ADR诱导足细胞存活率的影响
表1图1显示,模型组与空白组比较,足细胞存活率明显下降(P<0.01),表明ADR能够造成足细胞的严重损伤;中药高、中剂量组及替米沙坦组与模型组比较,足细胞存活率均明显上升(P<0.01),3组之间比较差异无统计学意义(P>0.05),表明加味黄芪赤风汤高、中剂量及替米沙坦均能够拮抗ADR诱导的足细胞损伤;中药低剂量组与模型组比较,足细胞存活率升高但差异无统计学意义(P>0.05),与中药高、中剂量组比较,低剂量组足细胞存活率明显下降(P<0.01),表明加味黄芪赤风汤在拮抗ADR诱导的足细胞损伤中,可能具有一定的量效关系。
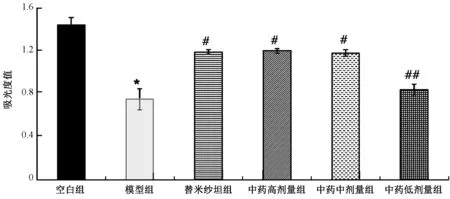
图1 各处理组对ADR诱导的足细胞存活率比较注:与空白组比较:*P<0.01;与模型组比较:#P<0.01,##P>0.05

组别例数吸光度值空白组61.44±0.07模型组60.75±0.10*替米沙坦组61.19±0.02#中药高剂量组61.20±0.02#中药中剂量组61.18±0.03#中药低剂量组60.84±0.05##
注:与空白组比较:*P<0.01;与模型组比较:#P<0.01,##P>0.05
3.2 各处理组足细胞凋亡情况比较
表2图2显示,EXPO32 v1.2软件分析数据显示,模型组与空白组比较足细胞早期凋亡率明显上升(P<0.01);中药各组及替米沙坦组与模型组比较,足细胞早期凋亡率均明显下降(P<0.01);与替米沙坦组比较,中药高、中剂量组差异无统计学意义(P>0.05);与中药高、中剂量组比较,低剂量组足细胞早期凋亡率明显升高(P<0.01)。

表2 各处理组对ADR诱导足细胞早期凋亡的影响
注:与空白组比较:*P<0.01;与模型组比较:#P<0.01;与替米沙坦组比较:**P>0.05;与中药高、中剂量比较:▲P<0.01
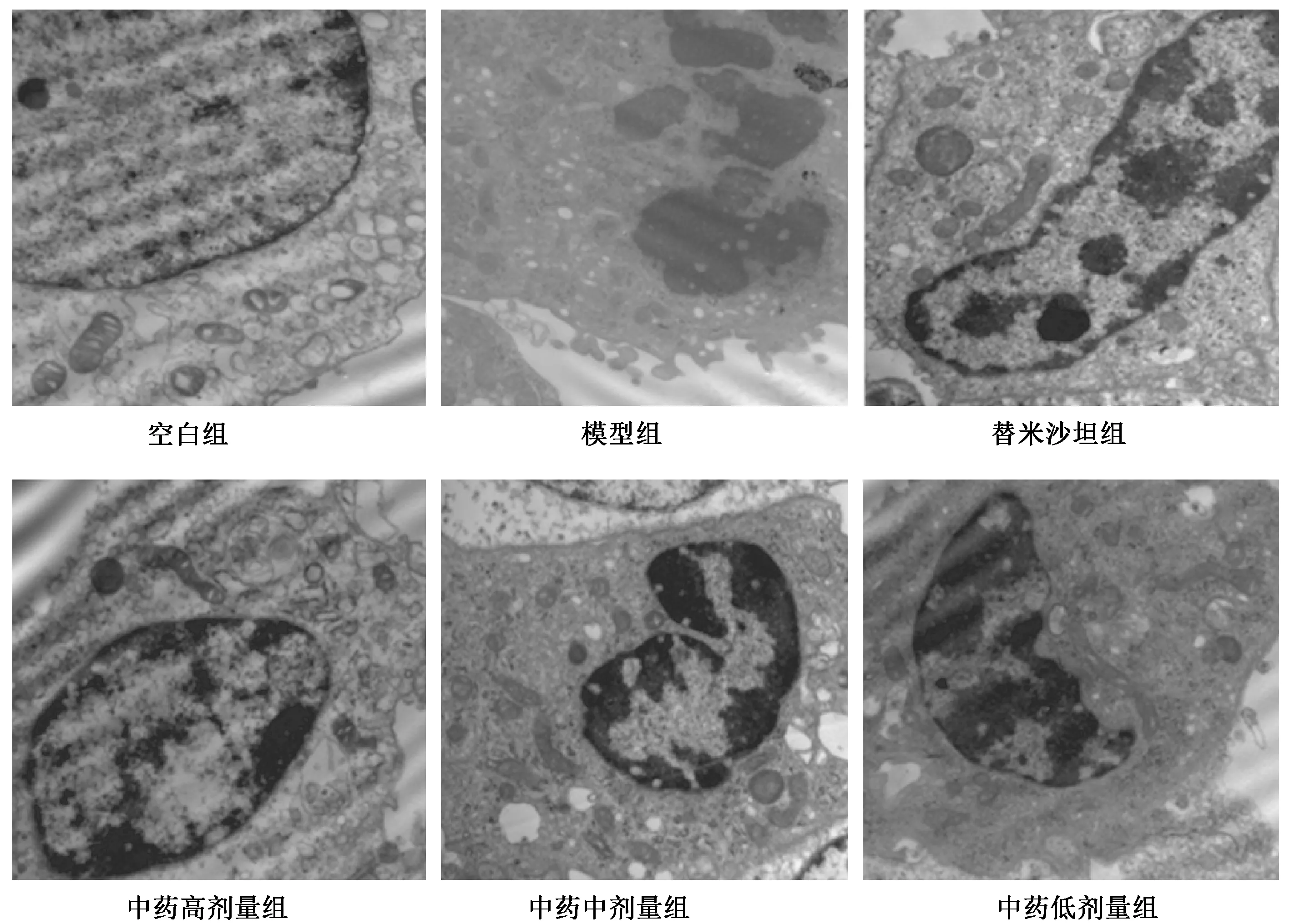
图3 透射电镜下各组足细胞凋亡超微结构(20000×)
3.3 透射电镜下各组足细胞凋亡超微结构变化
图3显示,透射电镜显示,空白组足细胞胞体如常,细胞器较多,核仁清晰,核膜边缘光滑、完整,核染色质细腻、均匀地分布在核内,未见凋亡小体、染色体边集等凋亡结构。模型组足细胞明显皱缩,胞浆内细胞器减少,染色质边集、凝聚成块、核碎裂,形成凋亡小体。经药物干预后,各组足细胞凋亡改变可见不同程度的缓解。如替米沙坦组细胞皱缩,胞浆内细胞器略减少,核仁清晰可见,核膜较厚、染色质边集;中药高剂量组细胞略皱缩呈圆形,包浆内细胞器略减少,核膜厚,染色质固缩略有边集;中药中剂量组细胞皱缩呈圆形,胞浆内细胞器减少,核膜厚,染色质固缩边集可见;中药低剂量组细胞明显皱缩呈圆形,核碎裂,染色质凝聚成块。
4 讨论
张昱临证诊治CKD非常重视“气虚证”“血瘀证”“风(邪)证”的辨识,认为气虚、血瘀、风扰三者是CKD的基本病机,并确立了“益气活血祛风”治法。据此法立方遣药,研制出代表方加味黄芪赤风汤。黄芪赤风汤出自清代医家王清任《医林改错》,其组方之旨与CKD的基本病机相合,故张昱将该方引入CKD的治疗,在多年临床研究基础上,对其反复尝试改进,形成目前行之有效的加味黄芪赤风汤。该方由生黄芪、防风、赤芍、穿山龙、芡实、金樱子、白花蛇舌草组成。方中生黄芪、芡实、金樱子益肾补脾、固摄精微,赤芍活血化瘀,穿山龙防风祛风、化湿、通络兼有活血祛瘀之功,白花蛇舌草清热解毒,全方共奏益气活血、祛风解毒之功效。
足细胞损伤在蛋白尿的形成以及CKD进展中起重要作用。足细胞是构成肾小球滤过膜的重要组成成分,具有生物合成、维持肾小球毛细血管结构以及参与肾小球选择性滤过等多种功能,其损伤是导致蛋白尿的重要原因。近年来,足细胞病变在肾小球疾病进展中的作用日益成为关注的焦点。近期研究发现,肾小球足细胞的损伤程度与CKD病情进展有密切关系,足细胞减少的程度与肾小球硬化及肾小球滤过率的下降密切相关,足细胞减少是CKD活动性的重要标志[8-9]。本研究表明,加味黄芪赤风汤可以拮抗ADR诱导足细胞存活率的下降,从而保护足细胞,减轻足细胞损伤。
凋亡是指细胞受到某些信号或刺激后,由特定基因调控而发生的一种主动性消亡过程。在正常情况下可以维持内环境的稳定,当有害物质存在时则作为一种防御机制发挥作用。但是过度的凋亡则会引起细胞的Ⅰ型程序性死亡,从而破坏细胞内环境的稳定。研究表明,凋亡在肾脏疾病的发生发展过程中发挥了重要作用,对于肾脏疾病而言是一把“双刃剑”。一方面,细胞凋亡可以清除浸润的炎症细胞和异常增殖的肾脏细胞,从而促进肾脏组织结构和功能的修复[10-11]。另一方面,细胞凋亡可导致肾脏细胞的减少,加速肾小管萎缩和肾小球进行性硬化,从而加剧了肾脏病进程。本研究结果表明,在ADR诱导的肾小球足细胞损伤中,细胞凋亡呈现出高水平表达,表现为过度凋亡的状态,从而加剧肾小球足细胞损伤[12]。而采用加味黄芪赤风汤干预后,足细胞凋亡水平下降,电镜下足细胞损伤超微结构也随之改善。该研究提示,抑制足细胞过度凋亡可能是加味黄芪赤风汤发挥足细胞保护作用的一种内在机制。
本研究仅检测了加味黄芪赤风汤含药血清对阿霉素诱导足细胞凋亡中早期凋亡的影响,而对其晚期凋亡及总凋亡的影响还有待于进一步的研究。
参考文献:
[1] ZHANG L, WANG F, WANG L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet,2012,379(9818):815-822.
[2] 王允亮,张昱,王洪霞,等.加味黄芪赤风汤对阿霉素肾病大鼠蛋白尿及肾脏皮质SOD和MDA的影响[J].中国中医基础医学杂志,2011,17(5):505-506.
[3] 王允亮,张昱,王洪霞,等.加味黄芪赤风汤对阿霉素肾病大鼠蛋白尿及血清NO、ET-1和TGF-β1的影响[J].世界中西医结合杂志,2010,5(10):852-854.
[4] 高艳红,张昱,李澎,等.基于TGF-β1/Smad信号通路的加味黄芪赤风汤抗肾脏纤维化机制研究[J].中国中西医结合杂志,2016,36(12):1503-1506.
[5] 焦志娜,张昱,李澎,等.加味黄芪赤风汤对小鼠系膜细胞增殖及分泌细胞外基质的影响[J].世界中西医结合杂志,2016,11(7):941-944.
[6] 刘红霞,张昱,李澎,等.加味黄芪赤风汤含药血清对LPS诱导的小鼠肾小球系膜细胞ColⅣ、MMP-2及TIMP-2表达的影响[J].中国中西医结合杂志,2016,36(5):592-596.
[7] 李卫国. Desmin和TGF-β1在阿霉素损伤足细胞的表达及活性维生素D的干预作用[D].兰州:兰州大学,2012.
[8] ANNA GREKA,PETER MUNDEL. Cell Biology and Pathology of Podocytes[J]. Annu Rev Physiol,2012,74(3): 299-323.
[9] WIGGINS RC. The spectrum of podocytopathies: a unifying view of glomerular diseases[J]. Kidney International, 2007, 71(12): 1205-1214.
[10] BAKER A J, MOONEY A, HUGHES J, et al. Mesangial cell apoptosis: the major mechanism for resolution of glomerular hypercellularity in experimental mesangial proliferative nephritis[J]. Journal of Clinical Investigation, 1994, 94(5): 2105-2116.
[11] SHIMIZU A, KITAMURA H, MASUDA Y, et al. Apoptosis in the repair process of experimental proliferative glomerulonephritis[J]. Kidney International,1995,47(1): 114-121.
[12] SUGIYAMA H, KASHIHARA N, MAKINO H, et al. Apoptosis in glomerular sclerosis[J]. Kidney International, 1996, 49(1): 103-111.

