大鼠电针后血清对肿瘤坏死因子α诱导凋亡软骨细胞Erk1/2、C-Myc、C-Fos和 C-Jun 基因表达的影响
林 洁 ,吴广文 ,付长龙 ,洪秀娥 ,李 俐 ,林秋祥 ,吴明霞
(1.福建中医药大学中西医结合研究院,福建 福州 350122;2.福建中医药大学附属第二人民医院,福建 福州 350003;3.福建中医药大学康复医学院,福建 福州 350122)
骨关节炎(osteoarthritis,OA)是一种常见老年性多发疾病,发病部位常见于膝关节,表现为疼痛、肿胀、活动受限等,严重影响患者生活质量[1]。OA在中医学上属“痹证”范畴,以肝肾亏虚为病变根本,风寒湿邪是其致痹外因,病机总属本虚标实、本痿标痹[2-3]。电针作为传统针灸疗法与现代电疗结合产物,具有舒经活络、行气活血、消炎镇痛之效,对防治OA具有良好疗效[4-5]。前期研究表明:电针具有抑制软骨细胞凋亡、延缓OA关节软骨退变、促进关节软骨修复的作用[6-8]。本实验拟观察电针刺激大鼠内外膝眼一定时间后获得的血清(电针后血清)对TNFα诱导的大鼠体外软骨细胞凋亡模型的影响,并检测其 Erk1/2、C-Myc、C-Fos、C-Jun 基因表达情况,从而进一步阐明电针防治OA的作用机制。
1 材料
1.1 实验动物 2月龄SD雄性大鼠30只、4周龄SD雄性大鼠12只购自上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2012-0002。实验动物饲养于福建中医药大学实验动物中心,使用许可证号:SYXK(闽)2014-0005,分笼饲养,自由饮水,标准饲料喂养。
1.2 实验试剂 磷酸盐缓冲液(PBS)、低糖型DMEM培养基、胎牛血清、二型胶原酶、0.25%胰蛋白酶(美国 Hyclone公司);肿瘤坏死因子 α(TNFα,美国Sigma 公司);Annexin V-FITC/PI凋亡试剂盒(江苏凯基生物技术股份有限公司);逆转录试剂盒(日本TAKARA公司);PCR引物 (上海铂尚生物技术有限公司);诺唯赞qPCR SYBR Green Master Mix(南京诺唯赞生物科技有限公司)。
1.3 实验仪器 华佗牌SD-Ⅱ型电子针疗仪、华佗牌一次性不锈毫针,规格:13 mm×0.25 mm(苏州医疗用品厂有限公司);超净工作台(苏州安泰空气技术公司);CO2培养箱(香港力康生物医疗科技控股有限公司);相差倒置显微镜、荧光显微镜(日本OLYMPUS公司);流式细胞仪(美国BD公司);PCR仪 (美国 Applied Biosystems公司);7500 Fast型荧光定量PCR仪(美国Applied Biosystems公司)。
2 实验方法
2.1 血清制备 2月龄SD雄性大鼠30只,应用随机数字表法分为正常组(n=10)、电针15 min组(n=10)和电针 30 min 组(n=10)。 正常组常规饲养,电针15 min组和电针30 min组分别予电针刺激大鼠双侧膝关节内、外膝眼,刺激时间分别为每次15 min、30 min,每天 1次,连续干预 1周。1周后,大鼠在麻醉状态下行腹主动脉采血,经离心获取正常组、电针15 min组和电针30 min组血清,于56℃水浴灭活30 min及过滤除菌后,-20℃保存,细胞实验时用DMEM配制为10%浓度进行干预。
2.2 软骨细胞提取与培养 采用2%戊巴比妥钠麻醉4周龄SD大鼠,每次4只,分3批次提取软骨细胞。用剪刀离断并取出双膝关节,在洁净台上,分离、切取双膝软骨,剪成约1 mm×1 mm×1 mm大小后,用4 mL 2%Ⅱ型胶原酶于37℃培养箱消化2 h;消化后,收集上清液于15 mL离心管中,以1 000 rpm的速度离心5 min获得软骨细胞;用4 mL含10%胎牛血清的DMEM培养液重悬软骨细胞沉淀,并接种25 cm3培养瓶,置于37℃、5%CO2培养箱中培养。上述步骤重复4次。于倒置显微镜下观察细胞每日生长情况,待细胞长满至85%~90%后传代培养,每隔48 h后更换培养液。以2代软骨细胞为实验对象,调整细胞密度为 1×105个/mL,取 2 mL接种于六孔板中,培养72 h后进行实验。
2.3 软骨细胞干预方法 参考文献[9],采用10 ng/mL TNFα诱导软骨细胞凋亡。将第2代软骨细胞随机分为正常组、模型组、电针15 min组和电针30 min组。正常组予正常组血清2 mL干预,模型组予含10 ng/mL TNFα正常组血清2 mL干预,电针15 min组予含10 ng/mL TNFα电针15 min组血清2 mL干预,电针 30 min组予含10 ng/mL TNFα电针30 min组血清2 mL干预。各组同时进行干预,干预48 h后检测相应指标。
2.4 检测指标
2.4.1 软骨细胞凋亡率 干预软骨细胞后,用移液枪吸弃培养液,PBS清洗1次,吸弃PBS,用不含EDTA的胰酶消化软骨细胞,收集于流式管中,2 000 rpm离心5 min,调整细胞密度为1~5×105个/mL。流式管每管加入500 μL Binding Buffer重悬软骨细胞,再加入FITC和PI各5 μL,混匀并于室温避光孵育15 min,用流式细胞仪检测各组软骨细胞凋亡率。
2.4.2 软骨细胞 Erk1/2、C-Myc、C-Fos、C-Jun 基因表达 如2.3干预软骨细胞后,用Trizol法提取各组软骨细胞总RNA,取1 μg RNA按照TAKARA逆转录试剂盒使用说明书逆转录成cDNA。按照诺唯赞qPCR SYBR Green Master Mix试剂盒说明书进行操作,以各组cDNA为模板行实时荧光定量PCR检测,β-actin为内参,具体引物序列如下:

表1 引物序列表
实验反应分为三个阶段:预热阶段为95℃3 min; 循环阶段为 95℃ 10 s、60℃ 30 s, 循环 40次;溶解曲线阶段为 95℃ 15 s、60℃ 30 s、95℃ 15 s。实验结束后,采用2-ΔΔCt法计算基因相对表达量。
2.5 统计学处理 采用SPSS 22.0软件统计分析。计量资料属正态分布的以(x±s)表示,采用t检验;不符合正态分布采用非参数检验。
3 实验结果
3.1 软骨细胞形态观察 刚提取的软骨细胞 (即原代软骨细胞)悬浮于培养液中(图1A),原代软骨细胞培养24 h后开始贴壁,培养48 h可见软骨细胞成簇现象(图1B),以梭形或椭圆形生长。细胞数量较多时,可呈典型的“铺路石”状。第1代及第2代软骨细胞状态良好,细胞的增殖速度较快,增殖及分泌基质的能力较强,其中第2代软骨细胞较为纯化,更适合作为实验对象(图1C、图1D)。
3.2 各组软骨细胞凋亡率 电针后血清对TNFα诱导软骨细胞凋亡的影响如图2所示,正常组凋亡率为(6.22±0.13)%,模型组凋亡率为(26.49±0.79)%,2组比较有显著性差异 (P<0.05)。 电针15 min组凋亡率为(16.81±1.71)%,电针 30 min组凋亡率为(13.88±0.83)%,2组与模型组比较均有显著性差异(P均<0.05)。
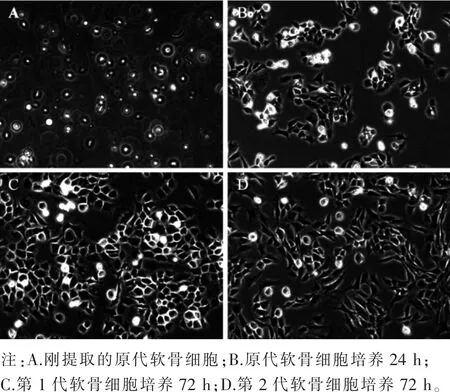
图1 软骨细胞形态观察(×100)
3.3 软骨细胞 Erk1/2、C-Myc、C-Fos、C-Jun 基因表达与正常组比较,模型组在 Erk1 /2、C-Myc、CFos、C-Jun 表达均显著升高(P<0.05);与模型组比较,电针 15 min组与电针 30 min组的 Erk1/2、CMyc、C-Fos、C-Jun基因表达均显著降低(P均<0.05)。 见表 2、图 3。
4 讨 论
丝裂原活化蛋白激酶(mitogen-activated proyein kinases,MAPKs)信号转导通路存在于大多细胞内,
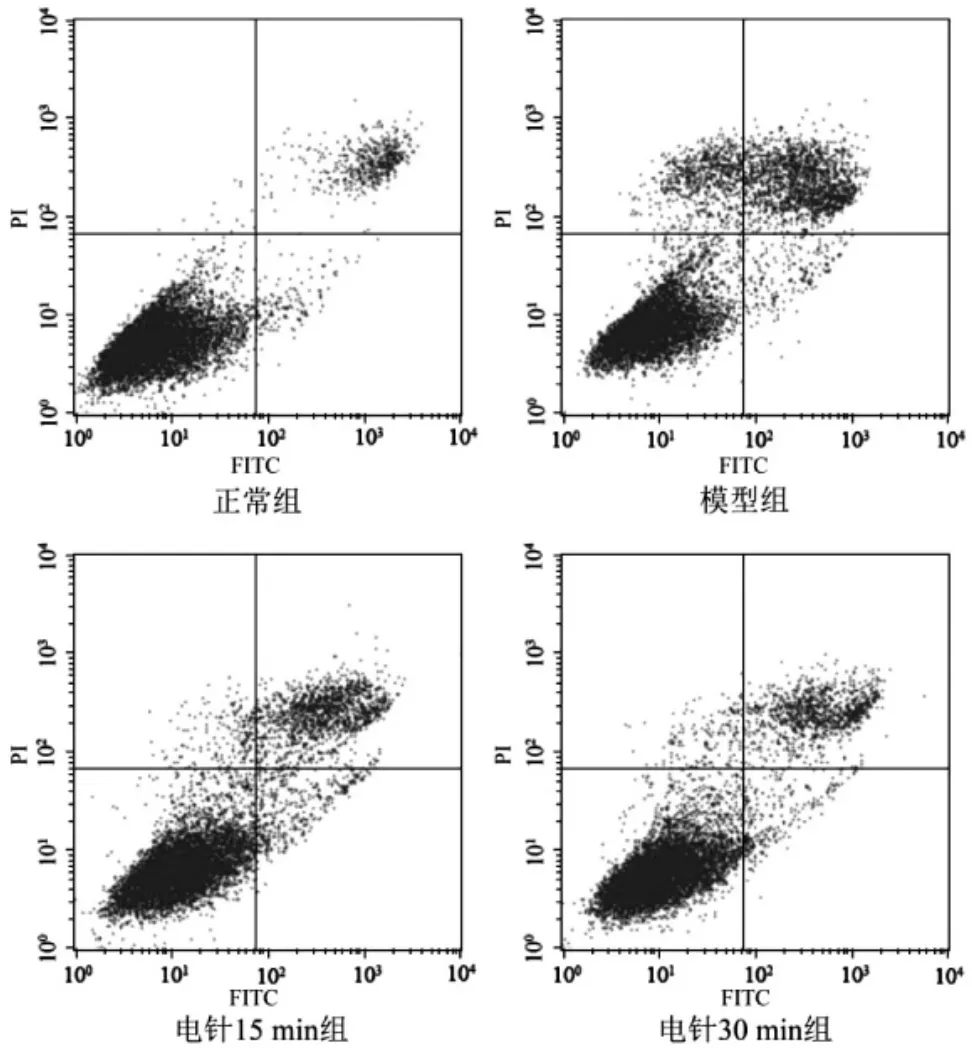
图2 各组软骨细胞凋亡情况
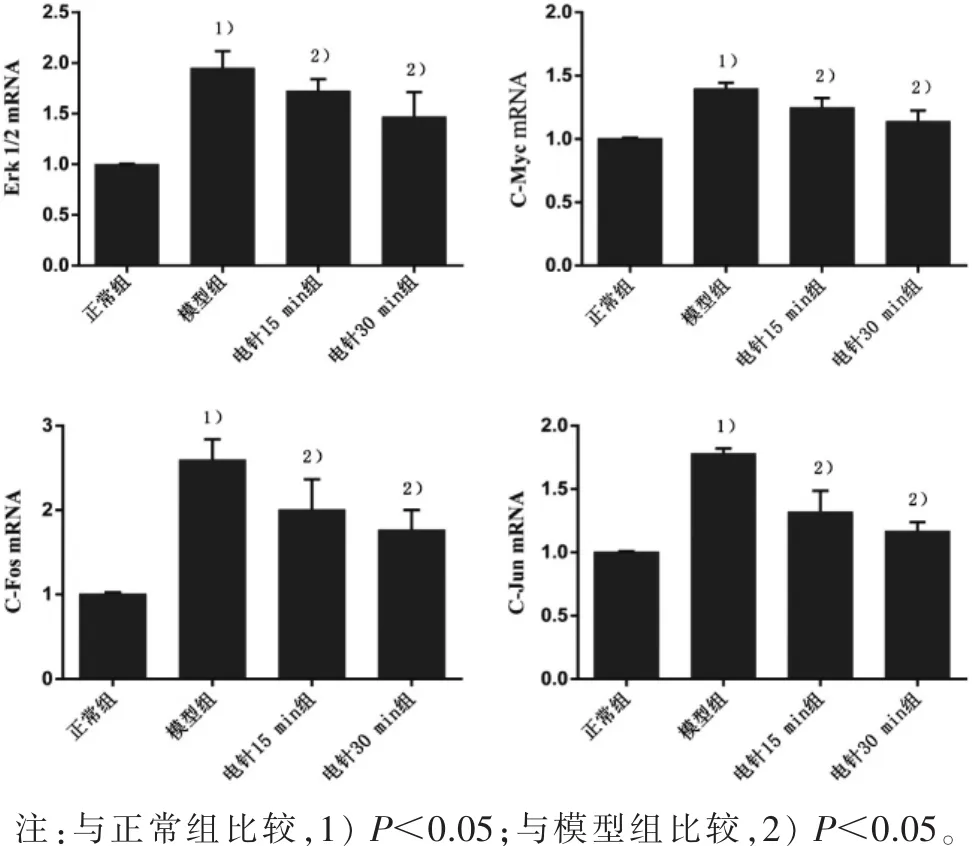
图3 各组软骨细胞 Erk1/2、C-Myc、C-Fos、C-Jun基因表达情况
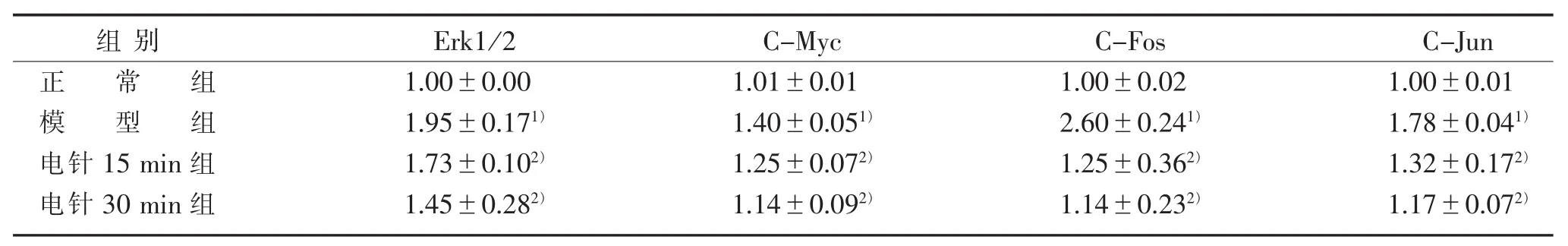
表 2 各组软骨细胞 Erk1/2、C-Myc、C-Fos、C-Jun 基因表达结果(x±s)
其将细胞外刺激转导至细胞及其核内,引起细胞增殖、分化、凋亡等生物学反应。目前,在哺乳类细胞已发现存在着 ERK通路、JNK/SAPK通路、P38 MAPK通路三条并行的MAPKs信号通路。近年来,ERK通路(即Ras-Raf-MEK-ERK信号连级通路)的细胞生物学作用越来越受到重视,有学者认为ERK通路表达上调一方面能促进软骨细胞增殖,形成明显骨赘,另一方面可能会加快软骨细胞凋亡,引起细胞结构破坏、细胞外基质降解[10-11]。该信号通路可被多种细胞外刺激信号激活,激活的Erk1/2进一步促使C-Myc、C-Fos、C-Jun转录因子磷酸化来调节基因表达,进而参与调节细胞增殖、分化和凋亡[12-13]。 相关研究表明:C-Myc、C-Fos、C-Jun 参与多种细胞凋亡活动[14-17]。此外有研究显示:TNFα能激活Ras-Raf-MEK-ERK信号通路,促进IL-1β表达,提高MMPs活性,并与激活产物进一步发生协同作用,促使细胞外基质降解、软骨细胞凋亡[18-20]。
本实验结果显示:TNFα诱导的大鼠凋亡软骨细胞经其电针后血清干预后,细胞凋亡率明显下降,各组软骨细胞 Erk1/2、C-Myc、C-Fos、C-Jun 的基因表达显著降低,表明大鼠电针后血清能有效抑制TNFα诱导的软骨细胞凋亡,其机制可能与下调Erk1/2、C-Myc、C-Fos、C-Jun 基因的表达有关。
参考文献:
[1] CHEN W H,LIU X X,TONG P J,et al.Diagnosis and management of knee osteoarthritis Chinese medicine expert consensus(2015) [J].Chin J Integr Med,2016,22(2):150-153.
[2]李西海,刘献祥.骨关节炎的核心病机——本痿标痹[J].中医杂志,2014,55(14):1248-1249,1252.
[3] 郑春松,严培晶,付长龙,等.从网络药理学角度探讨骨关节炎方证对应研究的思路与方法[J].福建中医药,2016,47(6):49-51.
[4] 林洁,付长龙,李俐,等.电针治疗膝骨性关节炎疗效的系统评价[J].康复学报,2016,26(4):52-58.
[5] 谢汶桦,庄松华,周晓霞.电针加正清痛宁离子导入治疗急性期腰椎间盘突出症 49 例[J]. 福建中医药,2017,48(2):16-17.
[4] WU M X,LI X H,LIN M N,et al.Clinical study on the treatment of knee osteoarthritis of Shen-Sui insufficiency syndrome type by electroacupuncture [J].Chin J Integr Med,2010,16(4):291-297.
[5] 吴明霞,李西海,李俐,等.电针对骨性关节炎软骨细胞JAKSTAT信号通路表达的影响[J].福建中医药大学学报,2011,21(6):21-23.
[6] 吴明霞,李西海,李俐,等.电针后血清对TNF-α诱导凋亡软骨细胞 MAPK 信号通路的影响[J].福建中医药,2011,42(6):43-45.
[7] 陈后煌,邵翔,李俐,等.肿瘤坏死因子α诱导大鼠软骨细胞凋亡模型的建立及鉴定[J].中国组织工程研究,2017,21(4):527-531.
[8] 陈泽华,李楠.ERK1/2信号通路与骨关节炎软骨细胞活性及其治疗的相关性研究[J]. 风湿病与关节炎,2015,4(1):63-65,71.
[9] 陈泽华,林海英,李楠.综述细胞外信号调节激酶1/2信号通路与肝肾亏虚型膝骨关节炎的相关性[J].中华中医药杂志,2015,30(9):3207-3210.
[10] ROSKOSKI R J.ERK1/2MAP kinases:structure function,and regulation [J].Pharmacol Res,2012,66(2):105-143.
[11]潘伟东,王东军.ERK1/2研究进展及其与神经胶质瘤相关性[J].海南医学,2011,22(22):121-124.
[12]王宁,龙迪,孟晓娜.IL-1β对小鼠软骨细胞中c-myc蛋白表达的影响[J].中华临床医师杂志(电子版) ,2013,7(24):11486-11490.
[13]黄宏艳,肖晓山,周代伟.硝普钠控制性降压对兔脑神经元cfos及细胞凋亡的影响[J]. 临床麻醉学杂志,2011,27(8):809-811.
[14]叶冬青,高维娟.c-jun氨基末端激酶信号通路与细胞凋亡[J].中国老年学杂志,2009,29(7):894-896.
[15] YU R A,YANG C F,CHEN X M.DNA damage,apoptosis and C-myc,C-fos,and C-jun overexpression induced by selenium in rat hepatocytes [J].Biomed Environ Sci,2006,19(3):197-204.
[16] GOMEZ R,CONDE J,SCOTECE M,et al.Endogenous cannabinoid anandamide impairs cell growth and induces apoptosis in chondrocytes[J].J Orthop Res,2014,32(9):1137-1146.
[17]罗玉明,郑维篷,魏合伟.骨关节炎与细胞因子TNF-α、IL-6关系的研究进展[J].现代诊断与治疗,2013,24(2):326-327.
[18]龚元勋,马骏,王述菊,等.细胞外调节蛋白激酶与肿瘤坏死因子-α 的研究进展[J].内蒙古中医药,2014,53(9):138.

