甘肃鼢鼠甘油三酯脂酶基因(ATGL)CDS克隆及组织表达分析
范佳敏,郑雪莉,韩崇选,李 琦,卜书海*
(1.西北农林科技大学 生命科学学院,陕西 杨陵 712100;2.西北农林科技大学 林学院,陕西 杨陵 712100)
甘肃鼢鼠(Myospalaxcansus,以下简称“鼢鼠”)隶属于啮齿目(Rodentia)仓鼠科(Cricetidae),主要分布于黄土高原,终年栖居地下,通过挖掘洞道系统啃食植物的地下根、茎,其危害的寄主植物多达95种,在林区主要危害油松(Pinustabulaeformis)、落叶松(Larixgmelinii)、侧柏(Platycladusorientalis)、刺槐(Robiniapseudoacacia)等造林树种,严重影响苗木的成活率及保存率,制约西北、华北地区林业生态建设的发展[1-3]。挖掘习性及洞道内低氧高二氧化碳且较为封闭的特殊环境使鼢鼠形成了一系列适应地下生活且有别于地面鼠的特征,包括能量代谢方面的差异[4-5]。长期挖掘、建造洞道是一项高耗能的过程,且能够使呼吸速率升高产生较多的热量[6-7]。也有研究指出,洞道的封闭性导致地下鼠基础代谢率低于地面鼠[8]。目前对鼢鼠的研究主要集中于生态、行为、防治、组织结构和低氧适应机制等方面,未见关于其能量代谢方面的报道,其高耗能挖掘过程中的能量供应方式也不可知。阐明其适应地下生活的能量代谢方式有助于加深对鼢鼠生活习性的了解,有利于从多方面对其进行防治。
脂肪组织是脊椎动物最重要的能量库,主要以甘油三酯(triglyceride,TG)的形式储存能量,其水解过程是机体主要的能量来源。甘油三酯脂酶(adipose triglyceride lipase,ATGL)属于非钙依赖磷酸酯酶蛋白家族,具有转酰基活性,可特异性地催化供能物质TG的第一酯键发生水解[9],因此被认为是脂解作用的限速酶,其活性直接关系到机体能量代谢的正常进行[10]。在体内超表达ATGL基因,脂肪细胞水解能力增加;而抑制ATGL基因表达,脂肪细胞酰基水解酶活性急剧下降[11]。ATGL基因对非脂肪细胞的脂质代谢也具有调节作用,其表达水平与脂滴体积大小显著相关[12]。也有研究表明,小鼠ATGL遗传失活会导致TG在多个组织中大量积累;小鼠应对冷刺激的能力下降[10]。另外,大鼠禁食后不同部位白色脂肪组织中ATGL基因mRNA表达水平上升,其对长时间禁食后维持低水平FFA动员起着关键作用[13-14]。上述研究均表明,ATGL在机体脂质分解、能量代谢中发挥重要作用。关于ATGL的研究主要集中于畜禽类或小鼠、大鼠等模式动物,在地下鼠中研究相当少见,目前鼢鼠ATGL基因序列还未知,且该基因在鼢鼠各组织中的表达规律也未见报道。
基于此,本研究将鼢鼠作为研究对象,旨在克隆其ATGL基因CDS,并分析其mRNA在不同组织中的表达情况,为进一步阐明鼢鼠能够适应地下生活的能量代谢方式提供理论依据。
1 材料与方法
1.1 试验用动物与组织采集
试验用甘肃鼢鼠均采用陷阱法捕自宁夏省固原市,4只均为雄性成年个体。折颈法处死后采集其棕色脂肪、皮下脂肪、内脏脂肪、肝、心脏、肌肉、脾和肾等8个组织样品,于液氮中速冻,-80℃储存备用。
1.2 主要试剂与仪器
RNA提取试剂、反转录试剂盒、PCR试剂、T载体克隆试剂盒、RT-PCR试剂盒均购自宝生物工程有限公司(TaKaRa,中国大连);凝胶回收试剂盒与质粒小提试剂盒均由OMEGA公司提供(OMEGA,美国);大肠杆菌(E.coli)DH5α菌株为实验室保存;低温高速离心机由Eppendorf公司生产(Eppendorf,德国);Nannodrop定量仪由Gene公司生产(Gene,美国);基因扩增仪、凝胶成像系统与实时定量PCR仪均由Bio-Rad公司生产(Bio-Rad,美国)。
1.3 试验方法
1.3.1 鼢鼠各组织RNA提取和cDNA合成 采用Trizol法提取RNA,具体步骤按照试剂盒(TaKaRa,大连)说明书进行。用DEPC水溶解RNA沉淀,分别采用核酸定量检测仪及1%琼脂糖凝胶电泳检测其纯度、浓度及完整性。-80℃储存备用。
依据TakaRa公司反转录试剂盒说明书进行操作,合成cDNA第1链,-20℃储存备用。
1.3.2 鼢鼠ATGL基因CDS克隆与测序 参照小鼠与小鼹形鼠ATGL基因序列(小鼠GenBank登录号:NM_001163689.1;小鼹形鼠GenBank登录号:XM_008854416.2),采用Primer Premier 5.0软件及NCBI中Primer-BLAST程序设计3对引物扩增鼢鼠ATGL基因的不同区域(表1),3对引物扩增所得产物之间均有重叠区域(图1),引物均由Invitrogen公司合成。
以内脏脂肪组织cDNA为模板进行PCR反应,引物为表1中的AT1、AT2、AT3,反应体系为10 μL:2×Premix Taq 5 μL,cDNA 1~2 μL,10 μmol/L上、下游引物各0.5 μL,加去离子水至10 μL。扩增条件为:95℃预变性3 min;95℃变性45 s,60℃退火45 s,72℃延伸45 s,共35个循环;72℃后延伸10 min;4℃结束反应。
所得产物用1%琼脂糖凝胶电泳检测,并用凝胶回收试剂盒回收纯化目的片段,回收产物与pMD18-T载体连接后转化E.coliDH5α,于氨苄培养基中培养筛选,挑选阳性克隆扩繁,送Invitrogen公司测序检测目的序列。

表1 鼢鼠ATGL基因克隆与实时荧光定量PCR引物信息
注:GAPDH:甘油醛-3-磷酸脱氢酶。
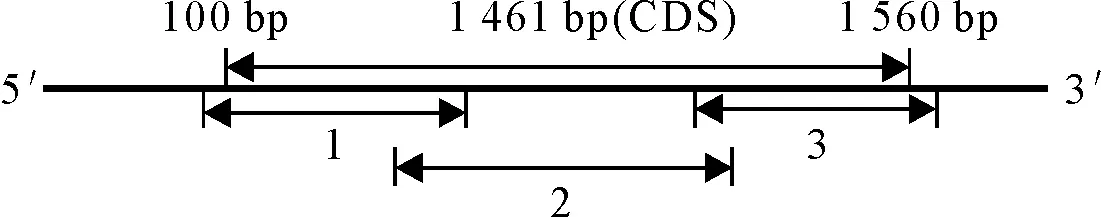
注:CDS序列全长1 461 bp,1、2、3分别表示使用引物AT1、AT2和AT3扩增的产物。
图1鼢鼠ATGL基因CDS序列PCR扩增示意图
Fig.1 Schematic diagram of the PCR strategy for Gansu zokorATGLgene CDS cloning
1.3.3 鼢鼠ATGL基因生物信息学分析 采用NCBI、DNAStar等生物信息学网站及软件进行测序结果比对和拼接;采用ExPaSy(http://www.expasy.org/tools/)程序推导ATGL基因 CDS所编码的氨基酸序列,并分析ATGL理化性质及预测其二级结构[15];采用NCBI中BLAST程序及The Sequence Manipulation Suite(SMS,http://www.bio-soft.net/sms/)程序进行序列相似性比对分析;采用MEGA 6.0构建系统进化树[16];采用SWISS-MODEL(https://swissmodel.expasy.org/)预测ATGL蛋白质三维结构模型[15];采用NCBI中CDD分析ATGL蛋白质保守结构域。
1.3.4 鼢鼠ATGL基因组织表达分析 根据鼢鼠ATGL基因和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因(GenBank登录号:AF036934.1)序列设计qRT-PCR引物(表1)。qRT-PCR反应体系为:SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)5 μL,10 μmol/L上、下游引物各0.5 μL,cDNA1 μL,加去离子水至10 μL。反应条件为:95℃预变性1 min;95℃变性10 s,60℃退火30 s,72℃延伸20 s,共40个循环;反应结束后进行溶解曲线分析验证产物特异性:55℃、30 s进行81个循环。自动采集荧光信号。每个样品进行4次技术重复。
1.3.5 数据分析 以鼢鼠肾组织ATGL基因的表达量为1,将GAPDH基因作为内参,采用Ct法(Qr=2-ΔΔCt,ΔCt=CtATGL-CtGAPDH)计算分析鼢鼠各组织中ATGL基因mRNA的相对表达量。
2 结果与分析
2.1 鼢鼠ATGL基因CDS克隆
以鼢鼠内脏脂肪组织cDNA为模板,AT1、AT2、AT3为引物进行PCR扩增,扩增产物用1%琼脂糖凝胶电泳检测。结果显示,3对引物经特定反应均可产生PCR扩增产物(图2),且目标条带清晰,大小与预期相符,回收片段,克隆测序。测序分别得到长为603、740 bp和561 bp的序列,去重叠拼接后将该序列与小鼠ATGL基因进行比对,结果显示,两者核苷酸序列相似性高达89 %,确定该序列为鼢鼠ATGL基因。鼢鼠ATGL基因CDS序列全长1461 bp,编码486个氨基酸,起始密码子为ATG,终止密码子为TGA(图3)。将所得序列提交至GenBank,登录号为KY030728。

注:PCR模板为内脏脂肪组织cDNA;1、2、3分别代表AT1、AT2、AT3 PCR产物;M:DL 2 000 DNA分子标记。

注:氨基酸序列由ExPASy程序推导;下划线的ATG为起始密码子;星号部分的TGA为终止密码子;灰色阴影部分为Patatin结构域;方框内为“GXSXG”模序。
图3鼢鼠ATGL基因部分cDNA序列及推导的氨基酸序列
Fig.3 Nucleotide and deduced amino acid sequence of part of the cDNA of Gansu zokorATGLgene
2.2 鼢鼠ATGL基因生物信息学分析
2.2.1 鼢鼠ATGL基因序列相似性分析及系统进化树构建 采用BLAST程序将克隆得到的鼢鼠ATGL基因CDS序列与GenBank中收录的11个不同物种的ATGL进行比对,结果表明,鼢鼠ATGL基因与其他物种相似性较高(表2)。其中,鼢鼠ATGL核苷酸序列与小鼹形鼠的相似性最高,为92.95 %;其编码的氨基酸序列与中国仓鼠的相似性最高,为95.47%。依据不同物种的ATGL氨基酸序列构建系统进化树(图4),结果表明,鼢鼠ATGL与中国仓鼠、小鼠和大鼠的亲缘关系较近。
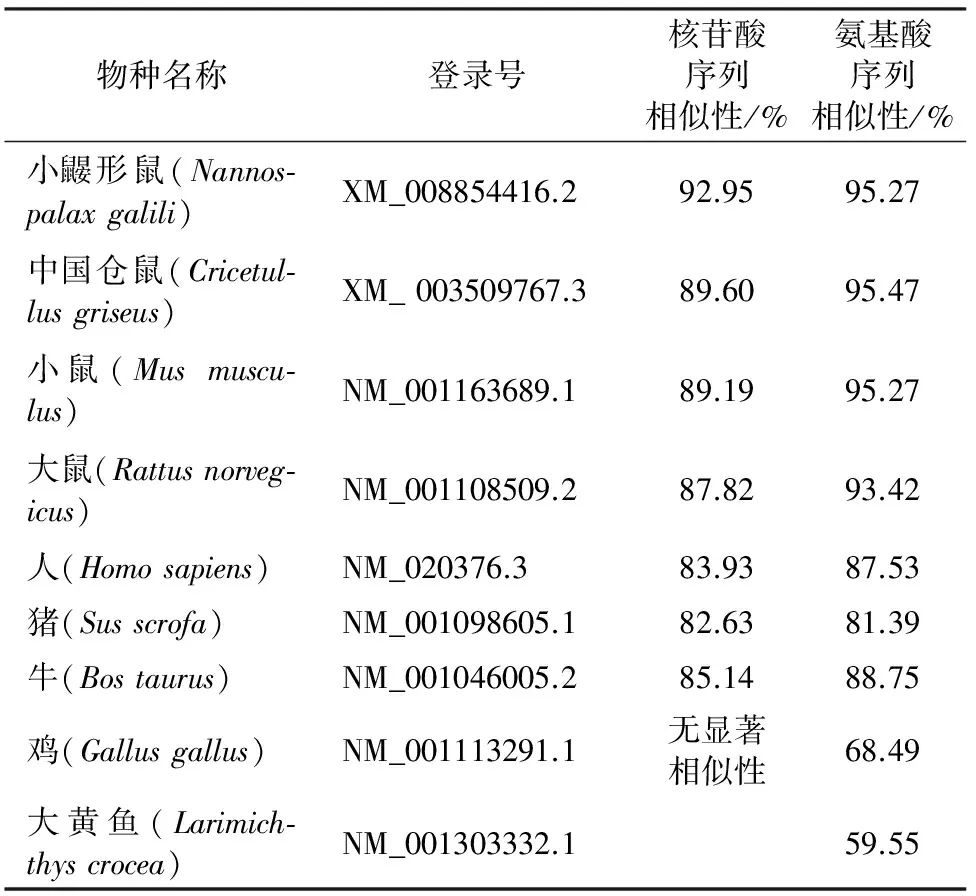
表2 鼢鼠与其他物种ATGL基因相似性分析
2.2.2 鼢鼠ATGL的理化性质 鼢鼠ATGL基因共编码486个氨基酸,N端为蛋氨酸(Met),分子式为C2382H3803N669O695S26,相对分子质量53 767.02,理论等电点为6.68。构成该蛋白质的各氨基酸中,亮氨酸(Leu)含量最高,为13.4%,丙氨酸(Ala)和脯氨酸(Pro)含量次之,均为8.2%。带正电(Arg+Lys)和带负电(Asp+Glu)的总残基数分别为48和50,总平均亲水性(GRAVY)为-0.129,脂溶指数为93.95,在哺乳动物体外半衰期为30 h,其不稳定系数为54.41,为不稳定蛋白。
2.2.3 鼢鼠ATGL的分子结构 鼢鼠ATGL二级结构以α-螺旋、β-折叠和无规卷曲为主。共有175个氨基酸残基参与了20个α-螺旋的形成,占36.01%,53个氨基酸残基参与了13个β-折叠的形成,占10.91%,其余氨基酸残基参与无规卷曲的形成(图5A)。蛋白质生物学功能正确行使与否很大程度上取决于其空间结构,其不同构象导致生物学功能多样。通过SWISS-MODEL预测得到的三维结构显示,鼢鼠ATGL蛋白空间结构以α-螺旋和β-折叠为主(图5B)。与其他物种ATGL相似,鼢鼠ATGL蛋白N端也存在1个保守的Patatin结构域(图3,图5C),并且在其AA45~AA50间存在具有酯酶活性的氨基乙酸-丙氨酸-丝氨酸-丙氨酸-氨基乙酸(GASAG)结构,其中位于第47位的丝氨酸与该蛋白催化活性相关。

注:采用MEGA 6.0 软件、邻接法构建系统进化树,0.05代表遗传距离。
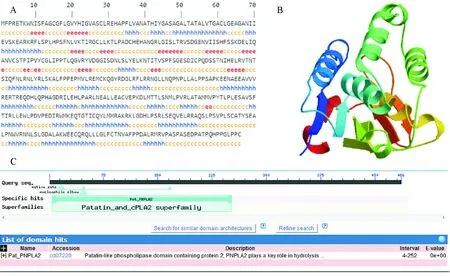
注:5A:ExPASy预测ATGL蛋白二级结构,“h”表示α-螺旋,“e”表示β-折叠,“c”表示无规卷曲;5B:SWISS-MODEL预测ATGL蛋白三级结构;5C:NCBI预测ATGL氨基酸序列保守结构域。
图5鼢鼠ATGL蛋白二级结构、三级结构及保守结构域预测
Fig.5 Prediction of the secondary structure,three dimensional structure and conserved domain of Gansu zokor ATGL
2.3 鼢鼠ATGL基因组织表达分析
将鼢鼠GAPDH作为内参基因,经qRT-PCR反应,所得溶解曲线均为单峰,说明定量引物的特异性良好,未产生非目的荧光干扰试验结果,因此该数据可真实反映ATGL基因在各组织中的相对表达量。结果表明,ATGL基因在被检测的8个组织中均有表达,其表达量由高到低依次为棕色脂肪组织、皮下脂肪组织、肝脏、内脏脂肪组织、心脏、脾、肌肉和肾。其中,棕脂中ATGL基因的表达水平显著高于其他组织(P<0.05),其表达量是皮下脂肪的9.3倍、肝脏的15倍;肾中ATGL基因表达水平最低(图6)。
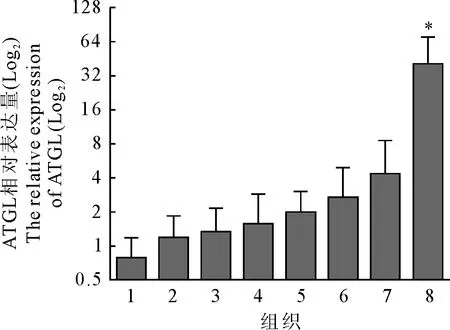
注:采用qRT-PCR检测ATGL基因在不同组织中的相对表达量,GAPDH为内参基因;1~8:肾、肌肉、脾、心脏、内脏脂肪组织、肝脏、皮下脂肪组织和棕色脂肪组织;*表示差异显著,P<0.05;n=4。
图6鼢鼠ATGL基因在不同组织中的表达量分析
Fig.6 The relative expression level of Gansu zokorATGLgene in various tissues
3 结论与讨论
ATGL是近年来新发现的启动脂肪动员的关键酶,在脂质分解、能量代谢中发挥重要作用,与其相关研究一直备受关注,但主要集中于畜禽或模式动物,在地下鼠中相当少见。本研究克隆了鼢鼠ATGL基因的CDS序列,该区全长1 461 bp,编码486个氨基酸,蛋白分子式为 C2382H3803N669O695S26,相对分子质量53 767.02,为进一步丰富ATGL基因功能、研究鼢鼠适应地下生活的能量代谢方式奠定基础。
序列比对结果显示,鼢鼠ATGL氨基酸序列与小鼹形鼠、中国仓鼠、小鼠、大鼠、人、猪、牛等哺乳动物相比具有较高的相似性(81%以上),与鸡和大黄鱼相比,其氨基酸序列相似性分别为68.49%和59.55%。当序列一致性>40%,蛋白质功能变异很少见[17]。较高的序列相似性预示着该基因在不同物种中行使功能相似,充分说明ATGL功能在进化中高度保守。将大黄鱼作为外群构建的系统进化树显示,人、牛、小鼠、鼢鼠等哺乳动物处于同一分支,鸡处于另一分支,且在哺乳动物中,啮齿动物聚为一支,这与脊椎动物进化关系相吻合。构建系统进化树是通过序列相似性推断功能相似性最经典的方法,由图4可知,鼢鼠ATGL基因与中国仓鼠、小鼠和大鼠这3个物种的亲缘关系较近,功能更相似。
与其他物种相似,鼢鼠ATGL蛋白N端含有1个Patatin结构域,并且存在具有酯酶活性的GASAG结构。含有Patatin结构域的蛋白在生物界广泛存在,原核、真核生物中均有发现[18-19],但功能却相差很大。植物根、茎中的Patatin蛋白与营养物质的储存相关[20],而在动物体内则与免疫相关,广泛的物种性说明该结构域具有很高的同源性。该结构域可以作用于磷脂、甘油一酯和甘油二酯,且具有酰基水解酶和酯酶活性[21]。GXSXG(氨基乙酸-X-丝氨酸-X-氨基乙酸)是脂肪酶的特征性结构域,丝氨酸为其活性位点,催化脂解反应的进行。这进一步说明ATGL基因在鼢鼠脂质水解和能量代谢中占有重要地位。
ATGL基因在多种动物体中均有表达。R.Zimmermann[11]、J.A.Villena[22]、Shan T[24]、崔欢欢[24]、滕炎玲[26]、Nie Q[23]等分别以小鼠、猪、牛、羊、鸡为研究对象检测不同组织中ATGL基因表达情况发现该基因在被检测组织中几乎均有表达,且在脂肪组织中表达量最高。本研究结果表明,鼢鼠ATGL基因在8个被检测组织中均有表达,且在棕脂中表达量最高,其次为皮下脂肪、肝和内脏脂肪组织,而其他组织中表达较少,这与小鼠、猪、牛、羊、鸡的表达模式基本一致,即均在脂肪代谢活跃的组织中高表达。ATGL在被检组织中均有表达,说明在能量消耗时,绝大多数组织均可水解组织自身储存的TG供能,但其能量储存较少,主要的能量仍需脂肪组织水解提供。大量研究表明,白色脂肪组织水解主要为各组织、器官提供能量,而棕脂水解则与解偶联蛋白(uncoupling protein 1,UCP1)的激活和适应性产热相关[27-28],且冷刺激可以促进棕脂中脂肪消耗[29]。G.Haemmerle[10]和M.Ahmadian[27]等还发现ATGL基因对于棕色脂肪组织表型的维持是必须的。ATGL基因在鼢鼠棕脂中表达量显著高于其他组织,表明棕脂对于鼢鼠能量代谢有重要意义。鼢鼠野外生存环境多变,且没有稳定的食物来源,在应对寒冷、休眠和营养不足等刺激时,棕脂有助于维持体温从而保护机体免受低温伤害。由此可见,棕色脂肪组织对于野生动物野外生存非常必要,对于提高动物对环境骤变的适应能力和扩大动物生态位意义重大。
本研究克隆得到鼢鼠ATGL基因CDS序列,并在此基础上进行序列分析、ATGL蛋白结构预测以及组织表达分析,结果表明,ATGL功能在进化中高度保守,其在鼢鼠脂质水解和能量代谢中发挥重要作用,且棕脂对于鼢鼠野外生存意义重大。本研究为进一步研究鼢鼠适应地下生活的能量代谢方式及ATGL基因在地下鼠能量代谢中的作用机制提供基础资料。
参考文献:
[1] 安永平,郎杏茹,李继光,等.宁夏固原市甘肃鼢鼠生物学习性研究[J].中国森林病虫,2007,26(5):29-30.
AN Y P,LANG X R,LI J G,etal.Biological habit ofMyospalaxcansusin Guyuan of Ningxia Hui Autonomous Region[J].Forest Pest and Disease,2007,26(5):29-30.(in Chinese)
[2] 韩崇选,杨学军,王明春,等.林区鼢鼠的综合管理研究[J].西北林学院学报,2002,17(3):53-57.
HAN C X,YANG X J,WANG M C,etal.The integrated pest management of zoker in forest area[J].Journal of Northwest Forsstry University,2002,17(3):53-57.(in Chinese)
[3] 王明春,韩崇选,杨学军,等.林区甘肃鼢鼠危害的主要特征及生态控制对策[J].西北林学院学报,2004,19(3):105-108.
WANG M C,HAN C X,YANG X J,etal.Harmfulness characteristic and bionomic control measurements to Gansu zokor in plantation areas[J].Journal of Northwest Forsstry University,2004,19(3):105-108.(in Chinese)
[4] 郑燕燕,李金钢.地下鼠的地下适应性特征及其行为对策[J].安徽农学通报,2008,14(9):38-41.
ZHENG Y Y,LI J G.Subterranean adaptability characteristics and behavior countermeasures of subterranean rodents[J].Anhui Agricultural Science Bulletin,2008,14(9):38-41.(in Chinese)
[5] 张小刚,麻安卫,张卫国,等.地下啮齿动物的生存环境及对代谢的影响[J].黑龙江畜牧兽医,2017(2):219-222.
[6] VLECK D.The energy cost of burrowing by the pocket gopherThomomysBottae[J].Physiological and Biochemical Zoology,1979,52(2):122-136.
[7] CUTRERA A P,ANTINUCHI C D,MORA M S,etal.Home-range and activity patterns of the South American subterranean rodent Ctenomys talarum[J].Journal of Mammalogy,2006,87(6):1183-1191.
[8] LUNA F,ANTINUCHI C D.Energy and distribution in subterranean rodents:Sympatry between two species of the genus Ctenomys[J].Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology,2007,147(4):948-954.
[9] LAKE A C,SUN Y,LI J L,etal.Expression,regulation,and triglyceride hydrolase activity of Adiponutrin family members[J].Journal of Lipid Research,2005,46(11):2477-2487.
[10] HAEMMERLE G,LASS A,ZIMMERMANN R,etal.Defective lipolysis and altered energy metabolism in mice lacking adipose trigly ceride lipase[J].Science,2006,312(5774):734-737.
[11] ZIMMERMANN R,STRAUSS J G,HAEMMERLE G,etal.Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase[J].Science,2004,306(57):1383-1386.
[12] SMIRNOVA E,GOLDBERG E B,MAKAROVA K S,etal.ATGL has a key role in lipid droplet/adiposome degradation in,mammalian cells[J].EMBO Reports,2006,7(1):106 -113.
[13] CAIMARI A,OLIVER P,PALOU A.Impairment of nutritional regulation of adipose triglyceride lipase expression with age[J].International Journal of Obesity,2008,32(8):1193-1200.
[14] BERTILE F,RACLOT T.ATGL and HSL are not coordinately regulated in response to fuel partitioning in fasted rats[J].Journal Nutritional Biochemistry,2011,22(4):372-379.
[15] GASTEIGER E,HOOGLAND C,GATTIKER A,etal.Protein identification and analysis tools on the ExPASy Server[M].New York:The proteomics Protocols Handbook Humana Press,2005:571-607
[16] TAMURA K,PETERSON D,PETERSON N,etal.MEGA5:molecular evolutionary genetic analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[17] TODD A E.Evolution of function in protein superfamilies[J].Journal of Molecular Biology,2001,307(4):1113 -1143.
[18] BANERJI S,FLIEGER A.Patatin-like proteins:a new family of lipolytic enzymes present in bacteria?[J].Microbiology,2004,150(3):522-525.
[19] SATO H,FRANK D.ExoU is a potent intrace-llular phospholipase[J].Molecular Microbiology,2004,53(5):1279-1290.
[20] SHEWRY P R.Tuber storage proteins [J].Annals of Botany,2003,91(7):755-769.
[21] BATEMAN A,COIN L,DURBIN R,etal.The pfam protein families database[J].Nucleic Acids Research,2004,32(Database issue):263-266.
[22] VILLENA J A,ROY S,SARKADI-NAGY E,etal.Desnutrin,an adipocyte gene encoding a novel patatin Domain-containing protein,is induced by fasting and glucocorticoids:ectopic expression of desnutrin increases triglyceride hydrolysis[J].Journal of Biological Chemistry,2004,279(45):47066-47075.
[23] NIE Q,FANG M,XIE L,etal.cDNA cloning,characterization,and variation analysis of chicken adipose triglyceride lipase (ATGL) gene[J].Molecular and Cellular Biochemistry,2009,320(1):67-74.
[24] SHAN T,WANG Y,WU T,etal.Porcine adipose triglyceride lipase complementary deoxyribonucleic acid clone,expression pattern,and regulation by resveratrol[J].Journal of Animal Science,2008,86(8):1781-1788.
[25] 崔欢欢,昝林森,王洪宝,等.牛ATGL基因的cDNA克隆、序列分析及组织表达研究[J].畜牧兽医学报,2010,41(2):141-146.
[26] 滕炎玲,罗军,李君,等.西农萨能奶山羊甘油三酯水解酶基因(ATGL)的cDNA克隆与组织表达分析[J].农业生物技术学报,2010,18(6):1134-1142.
[27] AHMADIAN M,ABBOTT M J,TANG T,etal.Desnutrin/ATGL is regulated by AMPK and is required for a brown adipose phenotype[J].Cell Metabolism,2011,13(6):739-748.
[28] CANNON B,NEDERGAARD J.Brown adipose tissue:function and physiological significance[J].Physiological Reviews,2004,84(1):277-359.
[29] MATINEZLOPEZ N,GARCIAMACIA M,SAHU S,etal.Autophagy in the CNS and periphery coordinate lipophagy and lipolysis in the brown adipose tissue and liver[J].Cell Metabolism,2016,23(1):113-127.

